1. 领域背景与文献引入
文献英文标题:Serum soluble CD26/DPP4 titer variation is a potential prognostic biomarker in cancer therapy with a humanized anti-CD26 antibody;发表期刊:Biomarker Research;影响因子:3.498(2021年);研究领域:肿瘤免疫治疗中CD26靶向治疗的预后生物标志物研究。
CD26是一种110kDa的II型跨膜糖蛋白,兼具二肽基肽酶4(DPP4)活性与细胞黏附功能,在恶性间皮瘤、肾细胞癌等多种肿瘤细胞表面高表达,通过调控细胞周期、促进肿瘤-基质相互作用参与癌症进展,是肿瘤靶向治疗的重要靶点。近年来,人源化抗CD26单克隆抗体YS110的I期临床试验完成,结果显示其对CD26阳性肿瘤患者具有可控的安全性(如输注反应轻微)及初步疗效,但临床中缺乏动态预测治疗 efficacy的生物标志物,限制了精准治疗的实施。现有研究虽发现血清可溶性CD26(sCD26)与尿路上皮癌、胃癌的诊断相关,或术后sCD26变化与结直肠癌复发风险关联,但均未涉及治疗过程中sCD26动态变化与预后的关系。本研究基于YS110的I期临床试验数据,系统分析sCD26滴度变化与肿瘤应答及无进展生存期(PFS)的关联,旨在填补CD26靶向治疗预后生物标志物的研究空白。
2. 文献综述解析
文献综述围绕“CD26的生物学功能→CD26靶向治疗进展→sCD26作为生物标志物的现有研究”展开评述,通过梳理现有研究的结论与局限性,凸显本研究的创新价值。现有研究指出:① CD26通过与纤维连接蛋白结合、诱导G1/S期阻滞等机制促进肿瘤生长,是肿瘤治疗的潜在靶点;② YS110作为首个人源化抗CD26抗体,其I期试验显示对CD26阳性肿瘤患者的客观缓解率(ORR)约为15%,安全性良好;③ sCD26的基线水平可辅助诊断尿路上皮癌(AUC=0.78)、胃癌(灵敏度82%),术后sCD26升高与结直肠癌复发风险增加相关(HR=2.1,p=0.03)。但上述研究均聚焦于疾病诊断或术后监测,未涉及“治疗过程中sCD26动态变化与治疗疗效的关联”。本研究的创新点在于:首次以CD26靶向治疗药物(YS110)的临床试验为基础,动态监测患者治疗中的sCD26滴度变化,并关联临床结局(肿瘤体积变化、PFS),为CD26靶向治疗的预后评估提供了可量化的生物标志物。
3. 研究思路总结与详细解析
本研究以“探索sCD26滴度变化作为YS110治疗预后生物标志物”为目标,核心科学问题是“YS110治疗中sCD26动态变化与肿瘤应答及PFS是否相关”,技术路线遵循“临床数据收集→sCD26动态监测→统计关联分析→体外机制验证”的闭环逻辑,结合临床试验与基础实验系统验证sCD26的预后价值。
3.1 临床患者数据与样本收集
实验目的:获取YS110治疗患者的临床特征、血清样本及疗效数据,为后续分析提供基础。方法细节:纳入26例可评估的CD26阳性肿瘤患者(19例恶性间皮瘤、6例肾细胞癌、1例尿路上皮癌),记录患者年龄、性别、基线肿瘤体积、YS110剂量(0.1-6mg/kg)及给药频率(每2周1次Q2W,18例;每周1次Q1W,8例);于治疗前(day1pre)、治疗中(day15pre/post、day29pre/post)采集血清样本,通过ELISA检测sCD26滴度,比色法检测DPP4活性;于day43通过RECIST 1.0标准评估肿瘤体积变化,随访记录PFS(中位数随访时间12个月)。结果解读:患者基线特征无明显偏倚(除性别外,女性患者SD率更高:6/8 vs 4/11,p=0.026),所有血清样本均成功检测sCD26及DPP4活性。实验所用关键产品:文献未提及具体血清检测试剂品牌,领域常规使用ELISA试剂盒检测sCD26(如R&D Systems的sCD26 ELISA Kit),DPP4活性检测试剂盒(如Abcam的DPP4 Activity Assay Kit)。
3.2 血清sCD26滴度的动态变化分析
实验目的:观察YS110给药后患者血清sCD26滴度的变化趋势。方法细节:采用箱线图分析26例患者day1、15、29pre/post的sCD26滴度变化(以day1pre为基线100%)。结果解读:所有患者的sCD26滴度在YS110给药后立即显著降低(如day1post较day1pre降低约50%,n=26,p<0.01),随后逐渐恢复,但至下次给药前(day15pre、day29pre)仍低于基线水平(day15pre约为基线的70%,day29pre约为基线的50%);Q2W组患者的sCD26恢复趋势更明显(day29pre约为基线的60%),而Q1W组因给药频率高、剂量大(2-6mg/kg),day15pre、day29pre的sCD26滴度更低(约为基线的40%)(图1)。实验所用关键产品:同3.1。
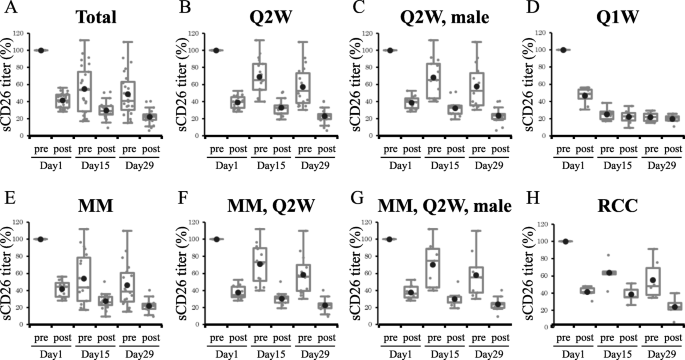
3.3 sCD26滴度变化与临床结局的相关性分析
实验目的:验证sCD26滴度变化与肿瘤应答(SD/PD)及PFS的关联。方法细节:① 散点图分析SD(12例)与PD(11例)患者的sCD26滴度变化与肿瘤体积变化的关系;② Pearson/Spearman相关性分析sCD26变化与肿瘤体积、PFS的相关性;③ ROC曲线确定sCD26变化的cutoff值,评估其预测效能。结果解读:散点图显示,day29pre的sCD26滴度在SD患者中显著低于PD患者(SD组约为基线的30%,PD组约为基线的60%,n=23,p=0.016),且与肿瘤体积变化呈正相关(r=0.47,n=25,p=0.006);相关性分析显示,day29pre的sCD26变化与PFS显著相关(r=0.43,n=26,p=0.011);ROC曲线显示,day29pre的sCD26变化cutoff值为37.7%时,预测SD的AUC为1.000(p<0.001),预测PFS≥90天的AUC为0.950(p<0.001)(图2、3,表1、2)。实验所用关键产品:同3.1。
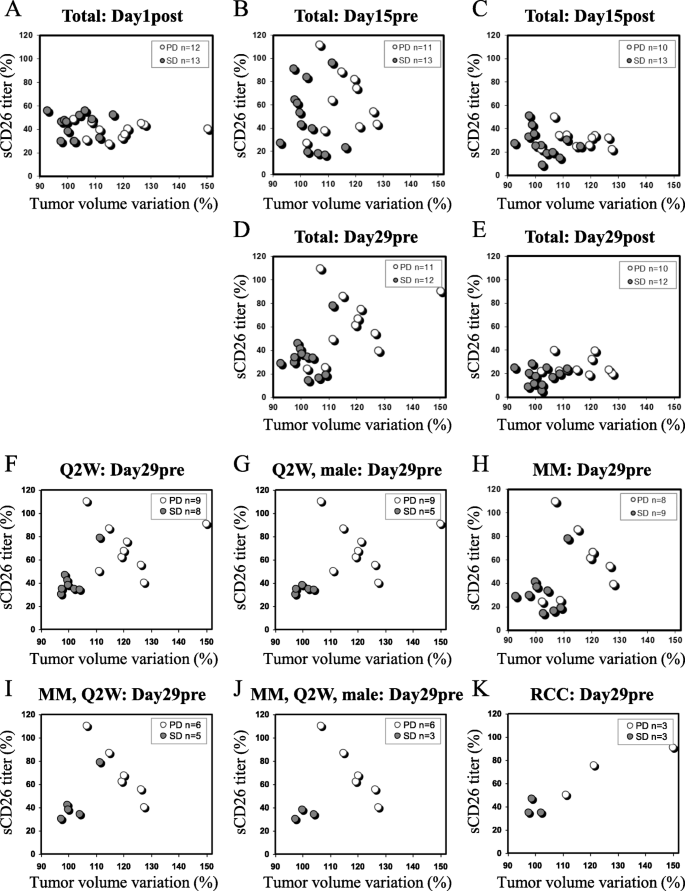
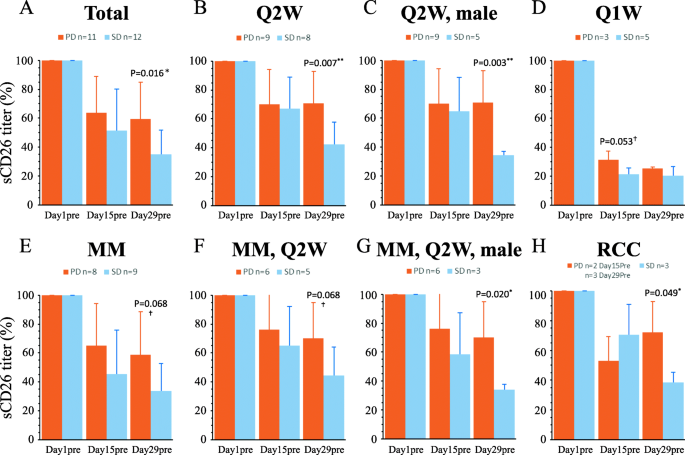
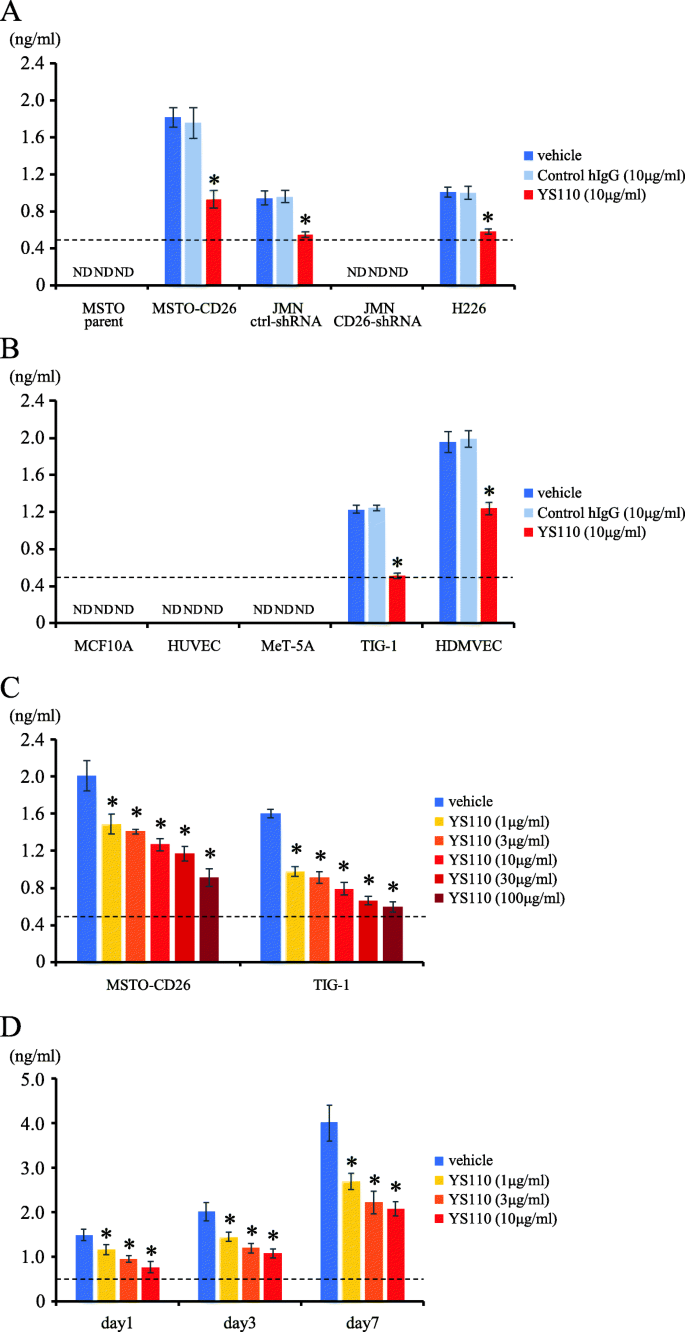
3.4 体外实验验证sCD26降低的机制
实验目的:探究YS110降低血清sCD26的细胞学机制。方法细节:选取CD26阳性的恶性间皮瘤细胞系(MSTO-CD26、JMN ctrl-shRNA)及非肿瘤细胞(TIG-1成纤维细胞、HDMVEC内皮细胞),分别加入YS110(0-10μg/ml)或对照IgG(BioLegend,货号QA16A12),培养1-7天后,通过ELISA检测上清液中的sCD26浓度。结果解读:YS110显著抑制CD26阳性细胞的sCD26分泌(如MSTO-CD26细胞加入10μg/ml YS110后,sCD26分泌减少约70%,n=4,p<0.01),且呈剂量和时间依赖性(1mg/ml YS110抑制约30%,7天培养抑制约80%);CD26阴性细胞(MSTO parent、JMN CD26-shRNA)的sCD26分泌不受YS110影响(图4)。实验所用关键产品:对照IgG购自BioLegend(货号QA16A12),sCD26检测采用自制ELISA试剂盒(基于抗CD26单抗5F8和9C11)。
4. Biomarker研究及发现成果解析
本研究聚焦的Biomarker为血清可溶性CD26(sCD26)及关联的DPP4酶活性,通过“临床动态监测→统计关联→机制验证”的逻辑链,明确其作为YS110治疗预后生物标志物的价值。
Biomarker定位与验证逻辑
Biomarker类型为“血清可溶性蛋白标志物”(sCD26)及“酶活性标志物”(DPP4),筛选/验证逻辑为:① 从YS110的I期临床试验患者中动态监测sCD26滴度变化;② 通过统计分析关联sCD26变化与肿瘤应答(SD/PD)及PFS;③ 体外实验验证YS110对sCD26分泌的抑制作用,确认Biomarker与药物作用的因果关系。
研究过程与数据
Biomarker来源为临床患者的血清样本,验证方法包括:① ELISA定量检测sCD26滴度(检测限0.488ng/ml);② 比色法检测DPP4活性(检测范围1-100nM/min/ml)。特异性与敏感性数据:ROC曲线显示,day29pre的sCD26变化cutoff值为37.7%时,预测SD的AUC为1.000(95% CI 1.000-1.000,p<0.001),敏感性与特异性均为100%;预测PFS≥90天的AUC为0.950(95% CI 0.850-1.000,p<0.001),预测PFS≥180天的AUC为0.879(95% CI 0.700-1.000,p=0.027)。
核心成果
- sCD26动态变化与预后的关联:day29pre的sCD26滴度在SD患者中显著低于PD患者(SD组约为基线的30%,PD组约为基线的60%,n=23,p=0.016),且与肿瘤体积变化(r=0.47,n=25,p=0.006)、PFS(r=0.43,n=26,p=0.011)显著正相关。
- Biomarker的预测效能:day29pre的sCD26变化是预测YS110疗效的强指标,cutoff值37.7%时可100%区分SD与PD患者,预测PFS≥90天的准确率达95%。
- 机制验证:YS110通过抑制CD26阳性细胞的sCD26分泌,导致血清sCD26滴度降低,且该作用依赖于CD26表达(CD26阴性细胞无此效应)。
本研究首次证明,治疗过程中sCD26的动态变化与CD26靶向治疗的疗效相关,为YS110的临床应用提供了可量化的预后指标,也为其他CD26靶向药物的生物标志物研究提供了参考。
