1. 领域背景与文献引入
文献英文标题:Advanced single-cell and spatial analysis with high-multiplex characterization of circulating tumor cells and tumor tissue in prostate cancer: Unveiling resistance mechanisms with the CoDuCo in situ assay;发表期刊:Biomarker Research;影响因子:未公开;研究领域:前列腺癌液体活检与耐药机制研究。
前列腺癌是全球第三大常见实体癌,2020年新增约140万例,预计2040年将增至290万例。转移性前列腺癌具有高度异质性,耐药机制复杂多样,包括雄激素受体(AR)信号异常(如AR-V7剪接变体表达)、神经内分泌分化(如突触素SYP、嗜铬粒蛋白A CHGA、神经细胞黏附分子NCAM1表达)等。尽管雄激素剥夺治疗(ADT)及新型AR靶向药物(如恩扎卢胺)是治疗核心,但患者最终会进展为去势抵抗性前列腺癌(CRPC),且目前缺乏基于生物标志物的个体化治疗推荐,临床亟需能同时监测多耐药机制的实用工具。
液体活检作为微创监测手段,通过分析循环肿瘤细胞(CTCs)、循环肿瘤DNA(ctDNA)等反映疾病状态,但其应用受限于传统检测方法的局限性:抗体染色通道有限,难以同时检测多标志物;ctDNA虽能检测遗传变异,但无法捕捉转录水平的变化(如AR剪接、神经内分泌标志物表达)。作者团队此前开发了基于mRNA的原位padlock探针杂交技术检测CTCs,但仅能检测3个标志物,multiplex能力不足。因此,开发高multiplex的原位检测方法,实现单细胞水平同时分析多耐药标志物,成为领域关键需求。
2. 文献综述解析
文献综述围绕前列腺癌的临床挑战、液体活检的潜力与局限,及现有技术不足展开,逐步引出研究创新方向。作者首先强调转移性前列腺癌的异质性与耐药多样性是治疗核心难题,现有方案缺乏生物标志物指导;接着阐述液体活检的优势(微创、实时),但指出传统CTCs检测(如抗体染色、PCR)难以同时检测多耐药机制,尤其是转录变化;随后回顾自身前期研究(mRNA原位padlock探针检测CTCs),明确其multiplex能力有限的局限;最终提出研究空白:需要高multiplex的原位方法,同时分析CTCs中的多耐药标志物(神经内分泌分化、AR-V7、可靶向靶点),并结合单细胞与空间分析揭示耐药机制。
现有研究的关键结论:液体活检是前列腺癌微创监测的重要手段,CTCs能反映肿瘤异质性与耐药状态;传统方法(如抗体染色、ctDNA分析)难以同时检测多耐药机制,限制临床应用。现有研究的优势:前期mRNA原位技术实现了CTCs转录检测;液体活检的微创性适合动态监测。现有研究的局限:multiplex能力不足,无法同时分析多耐药标志物。文献的创新价值:开发组合双色(CoDuCo)原位assay,将multiplex能力提升至11个标志物,结合机器学习分类CTCs,实现单细胞与空间分析,解决传统方法的瓶颈。
3. 研究思路总结与详细解析
研究以“开发高multiplex原位检测方法→验证特异性→训练机器学习分类器→应用于患者样本揭示耐药机制”为技术路线,实现了CTCs与肿瘤组织的多标志物检测及空间分析。
3.1 CoDuCo原位assay开发
实验目的:突破传统荧光显微镜通道限制,开发高multiplex的原位mRNA检测方法。
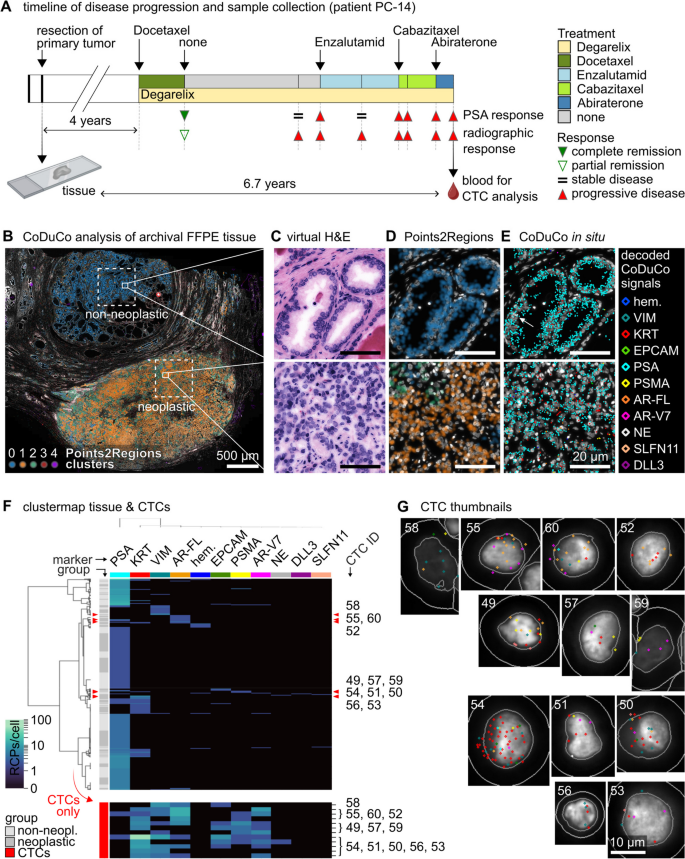
方法细节:基于padlock探针技术,设计组合双色(CoDuCo)编码策略——每个标志物对应两个荧光通道的组合(如Cy3+TexasRed对应造血标志物,Atto425+Cy5对应角蛋白KRT标志物),利用7通道显微镜(DAPI+6信号通道)实现最多15个标志物检测(因Cy5与TexasRed串扰,实际应用11个)。每个基因设计最多44条反转录引物与20条padlock探针,通过bridge探针与荧光readout探针间接杂交解码信号。
结果解读:成功设计11个标志物的双色编码方案(涵盖造血、上皮、前列腺特异性、神经内分泌等类型),数学验证编码特异性(Fig.1)。
实验所用关键产品:反转录引物与padlock探针(IDT);TranscriptMe Reverse Transcriptase(DNA-Gdansk,货号RT32-010);Ampligase(Biozym Biotech Trading,货号111075);RiboLock RNase抑制剂(Thermo Fisher Scientific,货号EO0381)。

3.2 细胞系与PBMCs验证
实验目的:验证CoDuCo assay的特异性与敏感性,区分肿瘤细胞与正常细胞。
方法细节:将assay应用于健康人外周血单个核细胞(PBMCs)、前列腺癌细胞系(VCaP、PC-3)及非小细胞肺癌细胞系(NCI-H1299),检测各标志物表达;通过CellProfiler分析信号计数,比较不同细胞类型的表达谱差异。
结果解读:PBMCs主要表达造血标志物(如CD45、CD11B),中位数3个滚环产物(RCPs)/细胞(IQR 1-5);肿瘤细胞系(VCaP、PC-3、NCI-H1299)主要表达上皮标志物(如KRT)与肿瘤特异性标志物(如VCaP的AR-FL,中位数34 RCPs/细胞)。不同细胞系表达谱具有特异性,PBMCs中肿瘤标志物表达中位数0 RCPs/细胞,验证了assay的特异性(Fig.2)。

3.3 机器学习分类器训练
实验目的:开发机器学习模型,自动分类CTCs,减少手动分析误差。
方法细节:收集3例健康对照(无spike-in)与3例健康对照(spike-in VCaP、PC-3细胞)的血液样本,富集CTCs后进行CoDuCo assay;手动标注细胞类型(CTCs、PBMCs、 artefacts等)作为ground truth;使用CellProfiler Analyst训练随机森林分类器,基于标志物表达谱分类细胞。
结果解读:训练后的分类器在健康对照样本中表现优异,CTCs召回率0.89、精度0.88、F1-score0.89(Fig.3、Fig.4);在患者样本中,召回率0.76、特异性0.99,有效识别CTCs并减少假阳性。


3.4 患者CTCs与肿瘤组织分析
实验目的:应用CoDuCo assay分析患者CTCs与肿瘤组织的耐药标志物及空间异质性。
方法细节:收集3例前列腺癌患者的血液样本(富集CTCs)与1例患者的匹配FFPE肿瘤组织,进行CoDuCo assay;通过CellProfiler分析CTCs标志物表达,结合TissUUmaps分析肿瘤组织空间表达;关联临床参数(如PSA水平、神经内分泌标志物血清水平)。
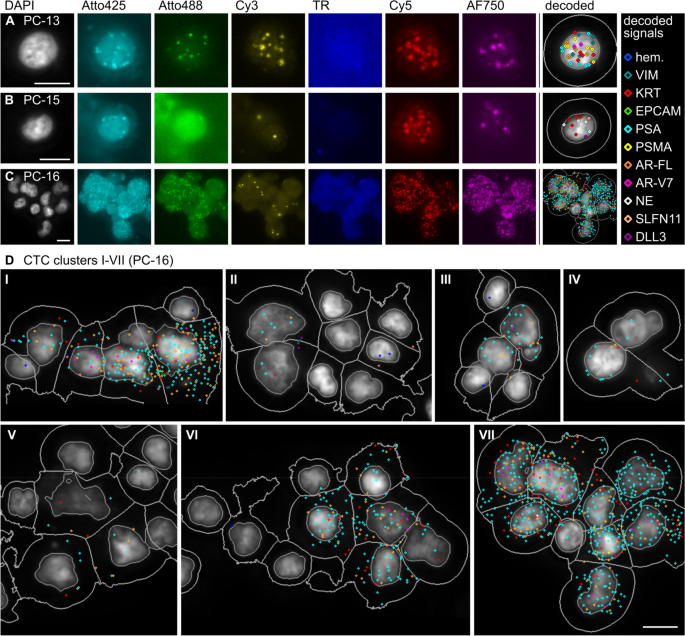
结果解读:患者CTCs表现出显著异质性:PC-13患者CTCs高表达VIM与KRT,无AR-V7;PC-15患者CTCs高表达神经内分泌标志物(SYP、CHGA、NCAM1),与血清神经元特异性烯醇化酶(NSE)、嗜铬粒蛋白A(CgA)升高一致;PC-16患者CTCs高表达PSA,存在9细胞集群(Fig.5、Fig.6)。匹配肿瘤组织分析显示,CTCs与肿瘤组织的表达谱差异(如CTCs中AR-V7表达升高)反映了肿瘤进化中的耐药亚克隆扩张(Fig.10)。
实验所用关键产品:CTC富集使用Cytogen Smart Biopsy Cell Isolator;荧光显微镜为Slideview VS200(Evident);图像分析软件为CellProfiler、TissUUmaps。

4. Biomarker研究及发现成果解析
文献涉及的Biomarker涵盖前列腺癌耐药的关键机制(神经内分泌分化、AR信号异常)、可靶向靶点(PSMA、DLL3)及细胞表型标志物(KRT、VIM),通过“细胞系验证→患者样本验证→临床关联”的逻辑链确认其价值。
Biomarker定位与筛选逻辑
Biomarker类型:神经内分泌分化标志物(SYP、CHGA、NCAM1)、AR剪接变体(AR-V7)、可靶向靶点(PSMA、DLL3、SLFN11)、上皮标志物(KRT、EPCAM)、间充质标志物(VIM)、造血标志物(CD45、CD11B)。筛选逻辑:基于文献选择与耐药相关的标志物,通过细胞系验证特异性,再通过患者样本结合临床参数验证临床相关性。
研究过程详述
Biomarker来源:患者CTCs(血液样本富集)与FFPE肿瘤组织。验证方法:CoDuCo原位杂交检测mRNA表达,通过CellProfiler计数RCPs/细胞,结合机器学习分类器识别CTCs。特异性数据:PBMCs中肿瘤标志物(如KRT、AR-FL)表达中位数0 RCPs/细胞,肿瘤细胞系(如VCaP的AR-FL)中位数34 RCPs/细胞。敏感性数据:机器学习分类器在患者样本中CTCs召回率0.76,能检测到低表达的AR-V7(中位数0 RCPs/细胞,阳性CTCs中位数3 RCPs/细胞)。
核心成果提炼
- 神经内分泌分化标志物:PC-15患者CTCs高表达SYP、CHGA、NCAM1,中位数7 RCPs/细胞(IQR 6-10),与血清NSE(1451 ng/ml)、CgA(2764 ng/ml)升高一致,提示神经内分泌分化是其AR非依赖性耐药机制(q ≤ 0.05)。
- AR-V7表达:PC-16患者12/38个CTCs表达AR-V7,中位数3 RCPs/细胞(IQR 2-4),提示AR信号异常是耐药机制之一。
- 可靶向靶点:PC-13患者CTCs表达PSMA(中位数4 RCPs/细胞),为PSMA靶向治疗提供依据;PC-15患者CTCs表达DLL3(中位数1 RCPs/细胞),支持DLL3靶向治疗研究。
- 异质性分析:患者CTCs存在显著intrapatient异质性——PC-13患者CTCs分为VIM/KRT高表达与PSA/AR-V7高表达两个亚群;PC-16患者存在9细胞CTCs集群,与高转移潜能相关。
- 空间分析:匹配肿瘤组织的空间表达显示,CTCs与肿瘤组织的表达谱差异(如CTCs中AR-V7表达升高)反映了肿瘤进化中的耐药亚克隆扩张(Fig.10)。
统计学结果:神经内分泌标志物在PC-15患者中的表达显著高于其他患者(q ≤ 0.05);AR-V7在PC-16阳性CTCs中的中位数表达为3 RCPs/细胞(IQR 2-4);机器学习分类器的召回率0.76(95% CI 未明确),特异性0.99。