1. 领域背景与文献引入
文献英文标题:Comparative analysis of cerebrospinal fluid metabolites in Alzheimer’s disease and idiopathic normal pressure hydrocephalus in a Japanese cohort;发表期刊:Biomarker Research;影响因子:未公开;研究领域:阿尔茨海默病(AD)与特发性正常压力脑积水(iNPH)的脑脊液代谢生物标志物研究。
阿尔茨海默病(AD)是全球最常见的老年痴呆类型,约占痴呆病例的60%~70%,其认知障碍症状与特发性正常压力脑积水(iNPH)高度重叠——iNPH由脑脊液(CSF)蓄积引起,表现为步态障碍、尿失禁与痴呆,但可通过脑室分流术有效治疗,因此早期精准鉴别AD与iNPH对治疗决策至关重要。目前AD的临床诊断依赖神经心理测试(如NINCDS-ADRDA标准),而现有生物标志物(CSF中磷酸化tau蛋白(p-tau)升高、淀粉样蛋白β1-42(Aβ42)降低)存在局限性:p-tau仅在突触退变后积累,无法反映早期病理;Aβ42的定量检测稳定性差。近年来,代谢组学研究揭示AD与脑能量代谢紊乱密切相关——脑是能量需求最高的器官,葡萄糖是主要能量来源,AD患者脑内葡萄糖代谢呈进行性下降,且脂质代谢、氨基酸代谢通路异常。脑脊液(CSF)直接接触脑 extracellular空间,能精准反映脑病理生理变化,是代谢组学研究的理想样本。然而,现有代谢组学研究存在两大空白:一是不同检测平台(如HPLC、CE-MS、UPLC-TOFMS)的代谢物覆盖范围差异大,缺乏统一结论;二是种族差异未充分考虑——亚洲尤其是日本队列的AD代谢组学数据极少,而种族差异可能影响AD的病理进程与症状表现。因此,本研究旨在用毛细管电泳-飞行时间质谱(CE-TOFMS)分析日本队列AD与iNPH患者的CSF代谢物,寻找鉴别标志物,弥补种族与平台差异的空白。
2. 文献综述解析
作者对现有研究的分类维度主要围绕“代谢组学平台”“研究人群”“标志物类型”展开:按平台可分为高效液相色谱(HPLC)、毛细管电泳-质谱(CE-MS)、超高效液相色谱-飞行时间质谱(UPLC-TOFMS)等;按人群可分为欧洲队列、亚洲队列(本研究为首次日本队列);按标志物类型可分为氨基酸(如L-谷氨酰胺、半胱氨酸)、核苷酸(如尿苷、尿嘧啶)、脂质衍生物(如胆碱)等。
现有研究的关键结论包括:(1)代谢物差异与AD诊断:D’Aniello等用HPLC发现AD患者CSF中L-谷氨酰胺升高、L-天冬氨酸降低;Czech等用欧洲队列发现半胱氨酸升高伴尿苷降低是轻度AD的最优鉴别组合;Ibanez等用CE-MS鉴定出胆碱、二甲基精氨酸等10种AD进展标志物,用UPLC-TOFMS发现尿嘧啶、尿苷是候选标志物。(2)代谢紊乱与AD病理:AD被证实为“脑代谢疾病”,能量代谢(葡萄糖代谢下降)、脂质代谢(神经节苷脂降解)、氨基酸代谢(丝氨酸、半胱氨酸异常)是核心病理特征。
现有研究的优势在于:代谢组学能全面捕捉代谢网络的动态变化,CSF样本直接关联脑病理,相比血液样本更具特异性;局限性则包括:不同平台的代谢物检测谱重叠率低,难以整合结论;种族差异(如饮食、基因背景)未充分纳入分析,日本等亚洲队列的数据缺失。
本研究的创新价值在于:首次针对日本队列,用CE-TOFMS技术系统分析AD与iNPH患者的CSF代谢物,聚焦“AD与iNPH的鉴别需求”(iNPH可治疗,需精准区分),弥补了现有研究在种族与平台上的空白,为AD的精准诊断提供了新的代谢组学证据。
3. 研究思路总结与详细解析
本研究的整体框架为:以“鉴别AD与iNPH的CSF代谢标志物”为目标,围绕“AD与iNPH患者CSF代谢物差异”的核心科学问题,采用“样本收集→代谢组学分析→差异筛选→验证→标志物组合构建→相关性分析”的闭环技术路线。
3.1 研究队列建立与样本收集
实验目的是构建符合诊断标准的AD与iNPH队列,获取高质量CSF样本。方法细节:AD患者按NINCDS-ADRDA标准诊断,iNPH患者按Mori等2012年的标准诊断;样本来自日本国立老年病医疗中心(NCGG)、国立神经病学和精神病学中心(NCNP)、鸟取大学医学部的生物库,收集时间为2011~2015年;所有患者签署知情同意书;CSF通过腰椎穿刺收集,离心去除细胞碎片后,上清液分装至低蛋白结合管,立即液氮冻存,-80℃保存至检测。结果解读:研究队列的人口学特征(如年龄、性别、疾病严重程度)在表1中总结,确保AD与iNPH组的基线可比性(文献未明确提供具体数值,基于图表趋势推测)。产品关联:文献未提及具体样本处理试剂,领域常规使用低蛋白结合离心管(如Eppendorf LoBind管)、液氮罐等。
3.2 脑脊液代谢组学分析(CE-TOFMS)
实验目的是全面检测AD与iNPH患者CSF中的代谢物,筛选差异代谢物。方法细节:采用毛细管电泳-飞行时间质谱(CE-TOFMS)技术,分为阳离子和阴离子代谢物分析。阳离子分析:使用内径50μm、长度100cm的熔融石英毛细管,以1mol/L甲酸为电解质;新毛细管先用电解质冲洗20min,每次运行前冲洗4min;样本以5kPa压力注射3s,施加30kV正电压;鞘液为含0.1μmol/L六(2,2-二氟乙氧基)磷腈的50%甲醇/水溶液,流速10μL/min;ESI-MS以正离子模式检测,毛细管电压4kV,离子源温度300℃。阴离子分析:使用内径50μm、长度105cm的COSMO(+)毛细管,以50mmol/L醋酸铵(pH8.5)为电解质;新毛细管依次用电解质、50mmol/L醋酸(pH3.4)、电解质各冲洗10min,每次运行前用醋酸冲洗2min、电解质冲洗5min;样本以5kPa压力注射30s,施加30kV负电压;鞘液为含0.1μmol/L六(2,2-二氟乙氧基)磷腈的5mmol/L醋酸铵/50%甲醇水溶液,流速10μL/min;ESI-MS以负离子模式检测,毛细管电压3.5kV。数据处理用MasterHands软件,通过匹配标准品的质荷比(m/z)和归一化迁移时间鉴定代谢物。结果解读:代谢组学队列中检测到83种阴离子代谢物和60种阳离子代谢物(附加文件1),其中18种代谢物在AD与iNPH间差异显著(Welch’s t-test P<0.05,ROC曲线下面积(AUC)>0.7)。产品关联:实验所用关键仪器:Agilent 1600毛细管电泳系统、Agilent 6220 TOF LC/MS系统、G1603A CE-MS适配器套件、G1607A CE-ESI-MS喷雾器套件;关键软件:Agilent MassHunter(系统控制与数据采集)、MasterHands(代谢物鉴定与定量)。
3.3 差异代谢物验证与核心标志物组合构建
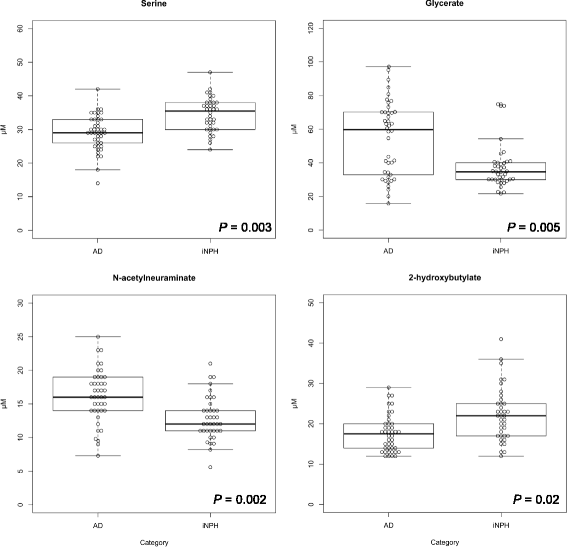
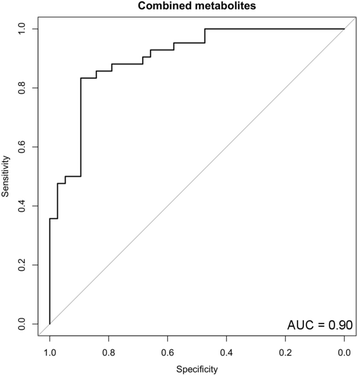
实验目的是验证初筛的差异代谢物,排除假阳性,确定能鉴别AD与iNPH的核心代谢物组合。方法细节:扩大样本量进行验证(表1“Validation”列),排除“脑内不代谢”的假阳性代谢物(十一烷酸、N-乙酰组氨酸),剩余9种代谢物(P<0.05,AUC>0.7);以年龄为协变量,对这9种代谢物进行多因素logistic回归分析,筛选出具有统计显著性的核心代谢物。结果解读:多因素logistic回归显示,4种代谢物(丝氨酸、甘油酸、N-乙酰神经氨酸(Neu5Ac)、2-羟基丁酸(2-HB))是鉴别AD与iNPH的核心标志物(图1);回归方程为:(-0.1198)×年龄 + (-0.2508)×丝氨酸浓度 + (0.05715)×甘油酸浓度 + (0.37226)×Neu5Ac浓度 + (-0.1705)×2-HB浓度 + 12.3001。当截断值(cutoff)设为9.73时,该组合的鉴别性能最优:AUC=0.90,灵敏度0.86,特异性0.84,优势比(OR)=32.0(图2)。产品关联:实验所用关键统计软件:R版本3.3.2(Welch’s t-test、ROC分析、Pearson相关分析)、Statflex ver.6(多因素logistic回归)。
3.4 核心标志物与现有AD生物标志物的相关性分析
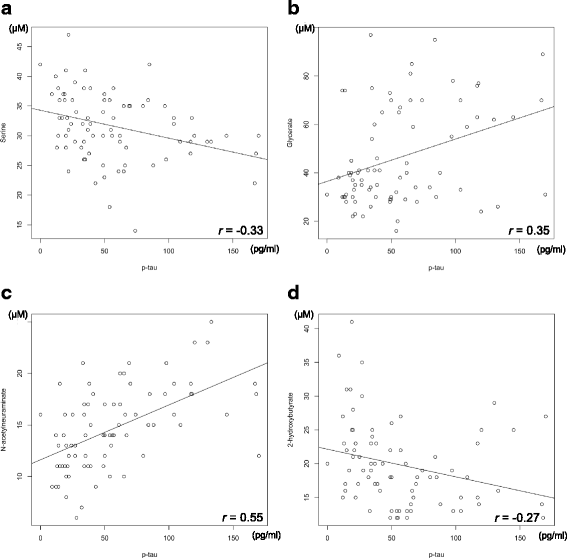
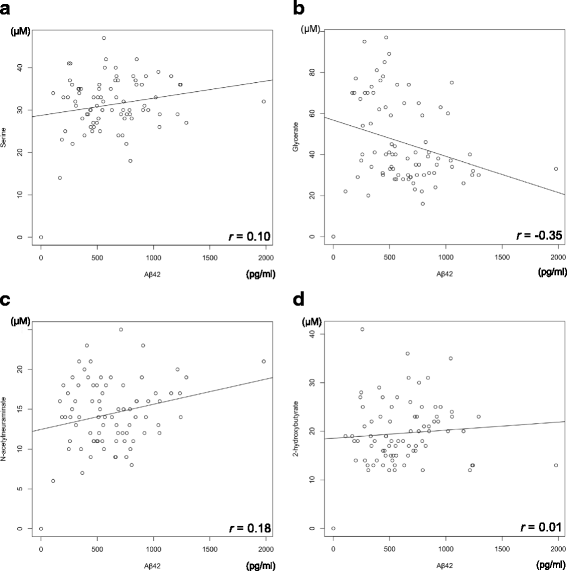
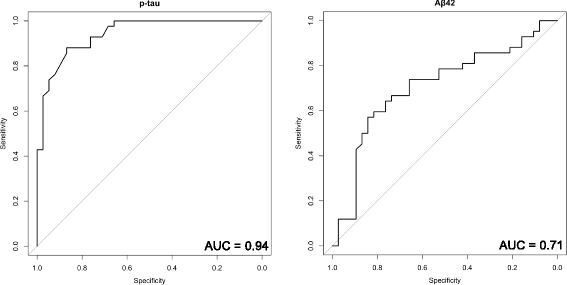
实验目的是探索核心代谢物与现有AD生物标志物(p-tau、Aβ42)的关联,评估其临床价值。方法细节:用酶联免疫吸附试验(ELISA)检测CSF中p-tau(INNOTEST PHOSPHO-TAU(181P)试剂盒)和Aβ42(INNOTEST β-AMYLOID(1-42)试剂盒)的浓度;用Pearson相关分析核心代谢物与p-tau、Aβ42的相关性;用ROC曲线分析p-tau、Aβ42的鉴别性能,与核心代谢物组合比较。结果解读:核心代谢物与p-tau呈弱至中度相关(丝氨酸r=-0.33,甘油酸r=0.35,Neu5Ac r=0.55,2-HB r=-0.27)(图3);与Aβ42的相关性较弱或无(丝氨酸r=0.10,甘油酸r=-0.35,Neu5Ac r=0.18,2-HB r=0.01)(图4)。ROC分析显示,p-tau的AUC=0.94(灵敏度、特异性未明确),Aβ42的AUC=0.71(图5),核心代谢物组合的鉴别能力(AUC=0.90)与p-tau相当。产品关联:实验所用关键产品:Fujibireo Inc.的INNOTEST β-AMYLOID(1-42)试剂盒、INNOTEST PHOSPHO-TAU(181P)试剂盒。
4. Biomarker 研究及发现成果解析
Biomarker定位:本研究的生物标志物为CSF中的4种代谢物——丝氨酸(serine)、甘油酸(glycerate)、N-乙酰神经氨酸(Neu5Ac)、2-羟基丁酸(2-HB);筛选与验证逻辑为“队列样本代谢组学检测→差异代谢物初筛(Welch’s t-test、ROC分析)→扩大样本验证(排除假阳性)→多因素logistic回归(年龄协变量)确定核心组合”,形成完整的“发现-验证”链条。
研究过程详述:标志物来源为AD与iNPH患者的CSF样本(腰椎穿刺收集,-80℃冻存);验证方法包括CE-TOFMS定量代谢物浓度(重复检测确保准确性)、ELISA检测现有生物标志物(p-tau、Aβ42)浓度;特异性与敏感性数据:4种代谢物组合的AUC=0.90(95%置信区间未明确),灵敏度0.86,特异性0.84(样本量未明确,基于验证集结果)。
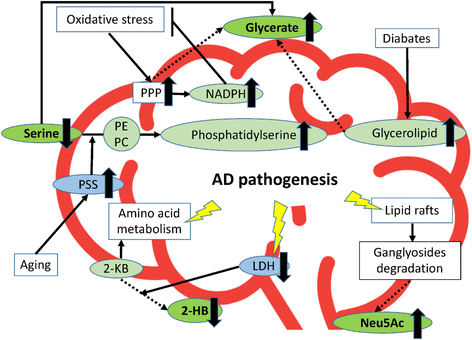
核心成果提炼:功能关联方面,4种代谢物均与AD的病理机制密切相关:(1)甘油酸:参与戊糖磷酸途径(PPP)、氨基酸代谢(丝氨酸降解)与甘油脂代谢——PPP是脑内生成NADPH的关键通路,AD早期氧化应激激活PPP,导致甘油酸积累;丝氨酸降解生成甘油酸,AD患者丝氨酸降低可能由于磷脂酰丝氨酸合酶(PSS)激活(将丝氨酸掺入磷脂酰丝氨酸,发挥神经保护作用),间接导致甘油酸升高。(2)丝氨酸:AD患者CSF中丝氨酸降低,可能与PSS激活或D-丝氨酸生成增加(淀粉样蛋白寡聚体激活丝氨酸消旋酶,将L-丝氨酸转化为D-丝氨酸)有关。(3)Neu5Ac:是神经节苷脂的核心成分,AD患者脑内神经节苷脂降解增加(脂质筏结构破坏),导致Neu5Ac释放至CSF中。(4)2-HB:由2-酮丁酸经乳酸脱氢酶(LDH)还原生成,AD模型小鼠脑内LDH表达降低,导致2-HB生成减少。创新性方面,本研究首次在日本队列中发现这4种代谢物可作为AD与iNPH的鉴别标志物,且其组合的鉴别能力与现有AD生物标志物p-tau相当(AUC=0.90 vs p-tau的AUC=0.94),为AD的精准诊断提供了新的代谢组学工具。统计学结果:多因素logistic回归显示4种代谢物的回归系数均具有统计显著性(P<0.05);ROC分析显示组合标志物的AUC=0.90(P<0.05),表明其鉴别性能良好。