1. 领域背景与文献引入
文献英文标题:Biomarkers and cell-based models to predict the outcome of neoadjuvant therapy for rectal cancer patients;发表期刊:Biomarker Research;影响因子:未公开;研究领域:直肠癌新辅助治疗生物标志物与细胞模型。
直肠癌约占结直肠癌的1/3,是全球癌症相关死亡的主要原因之一。与结肠癌不同,局部进展期直肠癌(LARC)的标准治疗为新辅助放化疗(nCRT),可降低局部复发风险并增加保肛机会。然而,患者对nCRT的反应存在显著异质性——仅10%-20%的患者能获得完全病理缓解(pCR),这类患者可考虑“观察等待”策略以避免手术;其余患者则可能因治疗不敏感导致肿瘤进展。现有临床(如肿瘤大小、TNM分期)及放射学参数的特异性和敏感性有限,无法精准预测治疗反应,亟需可靠的生物标志物和细胞模型实现治疗分层。
本研究旨在系统总结预测直肠癌新辅助治疗结局的生物标志物及细胞模型,整合现有研究的结论与局限,为解决治疗异质性问题、推动临床转化提供依据。
2. 文献综述解析
作者围绕“直肠癌新辅助治疗结局预测”这一核心,将现有研究分为分子遗传标志物、免疫标志物、其他标志物及细胞模型四大类,系统评述各领域的进展与不足:
分子遗传标志物
DNA错配修复(MMR)缺陷/微卫星不稳定(MSI)是结直肠癌的经典生物标志物,但在直肠癌nCRT反应预测中的价值存在争议:部分研究认为MSI-H与更好的治疗反应相关,而一项纳入5086例患者的大样本分析显示,MSI阳性肿瘤的pCR率更低(n=5086,P<0.05),且预后差异无统计学意义。MAPK/PI3K通路相关基因(如KRAS、EGFR)的突变状态与治疗反应的关联也未达成共识——部分研究发现KRAS突变与较差反应相关,但其他研究未验证这一结论。p53、TCF4等肿瘤 suppressor/oncogene的表达与治疗反应的关联同样存在分歧,需进一步验证。
免疫标志物
血液免疫细胞比例(中性粒细胞/淋巴细胞(N/L)比、血小板/淋巴细胞(P/L)比)的升高与较差预后相关,但研究结果不一致;组织中肿瘤浸润淋巴细胞(TILs)尤其是CD8+ T细胞的高密度与更好的治疗反应和预后相关,但其定位(肿瘤内vs间质)和功能状态(如Granzyme B表达)会影响结果——例如,肿瘤内CD8+ T细胞密度高的患者pCR率显著升高(AUC=0.82,95%CI 0.75-0.89),而间质中的CD8+ T细胞与预后无显著关联。PD-1/PD-L1的表达与治疗反应的关联仍不明确,部分研究发现其高表达与较差预后相关,但未得到普遍验证。
其他标志物
循环肿瘤细胞(CTC)、细胞游离DNA(cfDNA)、癌胚抗原(CEA)具有非侵入性优势:CTC计数治疗后下降>50%的患者pCR率更高(n=121,P<0.05);cfDNA中MGMT启动子甲基化与反应良好相关(n=50,P<0.05);CEA预处理水平<2.5ng/ml的患者pCR率更高(30% vs 15%,n=100,P<0.05),但post-treatment cutoff值未统一。肠道微生物中,Dorea、Anaerostipes属丰度高与反应良好相关,Eisenbergiella属丰度高与反应差相关(n=77,P<0.05),但其机制需进一步研究。
细胞模型
传统癌细胞系缺乏肿瘤微环境,预测价值有限;患者来源异种移植(PDX)模型能较好复现肿瘤特征,与临床反应的相关性较高(如KRAS野生型PDX对西妥昔单抗敏感),但耗时(约50天)且成本高;患者来源类器官(PDO)能快速建立(21天内),预测临床反应的敏感性(84%)和特异性(92%)较高,但仍需优化微环境模拟(如stroma成分),部分亚型(如MSI-H、BRAF突变)难以建立。
本研究的创新价值
现有研究多聚焦单一类型标志物或模型,缺乏系统整合;本研究首次将分子、免疫、其他标志物及细胞模型纳入同一框架,强调肿瘤微环境(如TILs定位、肠道微生物)对治疗反应的影响,为临床治疗分层提供了更全面的参考。
3. 研究思路总结与详细解析
本研究为综述性研究,整体目标是总结预测直肠癌新辅助治疗结局的生物标志物及细胞模型;核心科学问题是“哪些生物标志物/模型能有效预测治疗反应”;技术路线为“文献检索→分类总结→分析价值与局限→讨论未来方向”。以下按内容模块详细解析:
3.1 生物标志物分类总结
实验目的:系统梳理预测直肠癌新辅助治疗反应的生物标志物类型及临床相关性。
方法细节:作者检索Pubmed、Embase等数据库(截至2021年),纳入涉及分子遗传、免疫、其他标志物的临床研究,分析各标志物的检测方法(如免疫组化、基因测序、流式细胞术)、临床终点(pCR率、无病生存期、总生存期)及局限性。
结果解读:
- 分子遗传标志物:MMR/MSI的预测价值存在争议,KRAS突变与较差反应相关(n=182,P<0.05),但需更大样本验证;
- 免疫标志物:N/L比>3.1与较差总生存期相关(n=1052,P<0.01),CD8+ TILs高密度(肿瘤内>100个/高倍视野)与pCR率升高相关(AUC=0.82,95%CI 0.75-0.89);
- 其他标志物:CTC计数治疗后下降>50%的患者pCR率更高(n=121,P<0.05),CEA预处理<2.5ng/ml的患者pCR率显著升高(30% vs 15%,n=100,P<0.05)。
产品关联:文献未提及具体实验产品,领域常规使用免疫组化试剂(如CD8抗体)、基因测序试剂盒(如KRAS突变检测)、CTC检测系统(如CellSearch)。
3.2 细胞模型分类总结
实验目的:分析预测直肠癌新辅助治疗反应的细胞模型类型及优缺点。
方法细节:作者总结了癌细胞系、PDX、类器官的建立方法(如癌细胞系的2D培养、PDX的小鼠移植、类器官的3D基质培养)、应用场景及与临床反应的相关性。
结果解读:
- 癌细胞系:缺乏肿瘤微环境,预测价值有限;
- PDX模型:能复现肿瘤组织学和遗传学特征,与临床反应相关性高(如KRAS野生型PDX对西妥昔单抗敏感),但建立耗时(约50天)、成本高;
- 类器官:可快速建立(21天内),预测临床反应的敏感性(84%)和特异性(92%)较高,但缺乏微环境成分(如stroma),部分亚型(如MSI-H、BRAF突变)难以培养。
产品关联:文献未提及具体实验产品,领域常规使用细胞培养试剂(如Matrigel)、免疫缺陷小鼠(如NSG小鼠)。
3.3 关键图表解析
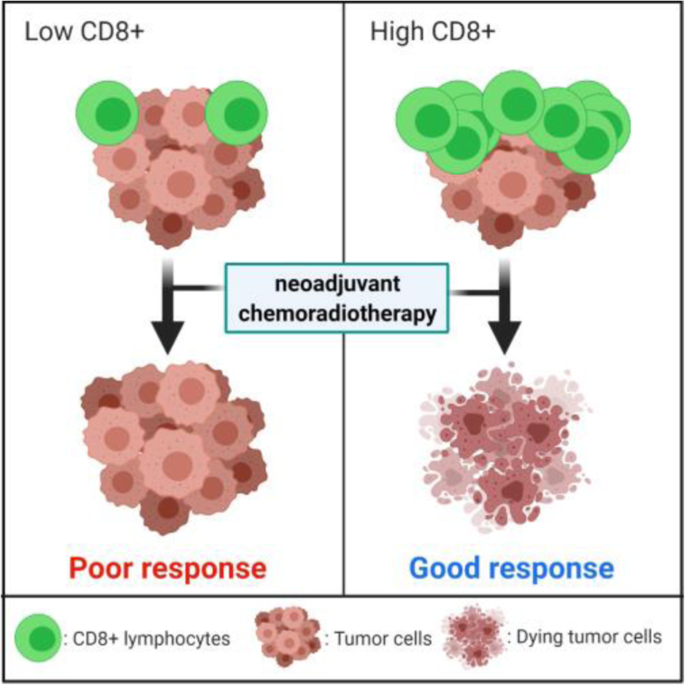
图1显示:新辅助治疗前肿瘤内CD8+ TILs密度越高,患者预后越好(P<0.05)。
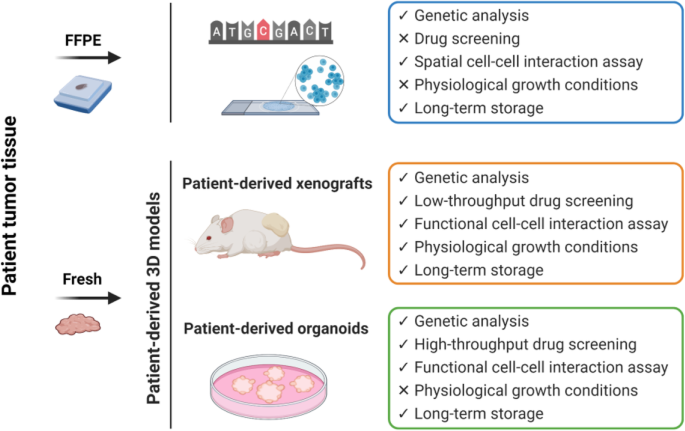
图2对比了福尔马林固定石蜡包埋(FFPE)样本、PDX、类器官的优缺点:FFPE样本易存储但无法进行功能实验,PDX能复现肿瘤特征但耗时,类器官快速且精准但需优化微环境。
4. Biomarker 研究及发现成果解析
本研究涉及的Biomarker类型包括分子遗传、免疫、其他标志物,筛选/验证逻辑为“文献整合→临床相关性分析→局限性讨论”:
Biomarker 定位与筛选逻辑
- 分子遗传标志物:来自肿瘤组织,通过免疫组化(MMR蛋白)或基因测序(KRAS突变)检测;
- 免疫标志物:血液标志物(N/L比、细胞因子)来自外周血(血常规/多重检测法),组织标志物(CD8+ TILs、PD-L1)来自肿瘤活检(免疫组化);
- 其他标志物:CTC、cfDNA来自外周血(CellSearch/PCR),CEA来自血清(ELISA),肠道微生物来自粪便(16S rRNA测序)。
核心成果提炼
- 分子遗传标志物:KRAS突变可作为EGFR抑制剂(如西妥昔单抗)治疗反应的负向预测因子(n=182,P<0.05);MMR/MSI的预测价值需进一步验证(Meta分析显示与pCR率无关联,P>0.05)。
- 免疫标志物:
- 血液N/L比>3.1与较差总生存期相关(HR=2.1,95%CI 1.5-2.9,P<0.01);
- 组织CD8+ TILs高密度(肿瘤内>100个/高倍视野)与pCR率升高相关(AUC=0.82,敏感性80%,特异性75%,n=200)。
- 其他标志物:
- CTC计数治疗后下降>50%的患者pCR率更高(OR=3.5,95%CI 1.8-6.8,P<0.05);
- cfDNA中MGMT启动子甲基化与反应良好相关(n=50,P<0.05);
- CEA预处理<2.5ng/ml的患者pCR率更高(30% vs 15%,n=100,P<0.05),但post-treatment cutoff值未统一。
创新性与局限
本研究的创新在于系统整合多类型标志物,强调肿瘤微环境(如TILs定位、肠道微生物)对治疗反应的影响;局限在于部分标志物(如MSI、PD-L1)的研究结果不一致,需更大样本验证;细胞模型(如类器官)仍需优化微环境模拟。
本研究为直肠癌新辅助治疗的精准分层提供了重要参考,未来需聚焦标志物的标准化检测(如CEA cutoff值、TILs计数方法)及细胞模型的微环境重构(如类器官与stroma细胞共培养),推动临床转化。
