1. 领域背景与文献引入
文献英文标题:Detection of circulating tumor cells: opportunities and challenges;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤液体活检(循环肿瘤细胞检测)。
肿瘤转移是全球癌症患者死亡的主要原因(占比>90%),其核心过程是肿瘤细胞从原发灶脱落、进入血液循环并定植于远端器官,而循环肿瘤细胞(CTCs)正是这一过程的“种子”。1869年Ashworth首次报道CTCs,但受限于检测技术,其临床价值长期未被挖掘。近20年,随着富集与检测技术的进步,CTCs作为“液体活检”的核心标志物,逐渐成为肿瘤精准医疗的研究热点——它不仅能非侵入性反映肿瘤异质性,还可用于监测治疗反应、预测预后。然而,CTCs检测仍面临三大瓶颈:①稀有性(全血中仅1-100个/ml,远低于红细胞、白细胞);②异质性(上皮间质转化(EMT)导致CTCs失去EpCAM等经典上皮标记,传统免疫检测易漏检);③功能性保留难(分离过程易损伤细胞,影响下游分子分析)。
在此背景下,本文系统综述CTCs的生物学特征、现有检测技术的优缺点、临床应用场景及未解决的挑战,为CTCs从“实验室”走向“临床”提供全面的理论支撑。
2. 文献综述解析
作者以“生物学基础-检测技术-临床应用”为逻辑主线,对CTCs研究进行系统梳理:
现有研究的核心结论与分类
- CTCs生物学特征:
- 转移过程:肿瘤细胞需经历“局部浸润→入血→循环存活→毛细血管滞留→渗出→定植”6个步骤,仅0.01%的CTCs能成功形成转移灶;
- EMT作用:CTCs通过EMT失去上皮标记(如EpCAM、E-钙黏蛋白),上调间质标记(如Vimentin、MMP),增强侵袭与存活能力;
- CTCs簇:由2-50个细胞组成(含肿瘤细胞、免疫细胞、血小板),其转移能力是单个CTCs的10-100倍;
免疫逃逸:CTCs通过表达PD-L1、CD47或分泌TGF-β,逃避NK细胞、细胞毒性T细胞(CTL)的攻击。
检测技术分类:
- 物理方法(无标记):基于大小(ISET滤过)、密度(OncoQuick离心)、介电性质(DEP芯片),优点是保留细胞活性,缺点是纯度低(易混有大体积白细胞);
- 免疫方法(标记依赖):如CellSearch系统(靶向EpCAM),特异性高(>95%)但漏检EMT细胞(约30%转移性乳腺癌患者CTCs为EpCAM阴性);
微流控技术:结合物理(大小)与免疫(抗体)方法(如Herringbone芯片),通量高但易堵塞,且设备成本高。
临床应用现状:
- 预后预测:CTCs计数≥3个/7.5ml是转移性乳腺癌、结直肠癌的不良预后标志物(HR=2.1-2.5,P<0.01);
- 疗效监测:化疗后CTCs计数下降50%提示治疗有效(n=200,P<0.05);
- 分子分型:CTCs的HER2、ESR1突变与原发肿瘤不一致,可指导靶向治疗(如HER2阳性CTCs患者用曲妥珠单抗获益)。
现有研究的局限性与本文创新
现有研究的核心局限:①缺乏标准化检测协议(不同技术结果差异大);②早期癌症检测灵敏度低(<50%);③下游分析(如单细胞测序)需大量CTCs,难以实现。本文的创新在于整合生物学、技术、临床三维度,首次系统分析CTCs检测的“机遇”(非侵入性、实时监测)与“挑战”(异质性、标准化),并提出未来研究方向——开发多标记检测技术、结合单细胞组学、建立统一的质控标准。
3. 研究思路总结与详细解析
本文为综述类文章,研究思路围绕“总结现有证据-分类分析-讨论意义与挑战”展开,以下按关键环节拆解:
3.1 CTCs生物学特征总结
实验目的:阐明CTCs的转移机制与异质性,为检测技术提供理论基础。
方法细节:综合细胞实验(如EMT诱导模型)、动物模型(小鼠尾静脉注射CTCs观察转移)、临床样本分析(如CTCs簇计数)的结果。
结果解读:
- 转移的关键步骤:MMP降解细胞外基质(ECM)促进肿瘤细胞入血,血小板包裹CTCs保护其免受剪切力与免疫攻击;
- EMT的影响:约40%转移性乳腺癌患者的CTCs为EMT表型(EpCAM阴性、Vimentin阳性),这类细胞更易形成转移灶;
- CTCs簇的优势:簇内细胞通过缝隙连接共享营养,存活率是单个细胞的10倍(n=50,P<0.01)。
图片插入:

(肿瘤细胞转移步骤示意图)
3.2 检测技术分类解析
实验目的:比较不同CTCs检测技术的原理与性能。
方法细节:按“物理性质-功能分析-免疫磁珠-微流控”分类,综述各技术的代表产品(如ISET、CellSearch、Herringbone芯片)。
结果解读:
- 物理方法:ISET滤过技术( pore size=5μm)的回收率约80%,但纯度仅50%(易混有巨核细胞);
- 免疫方法:CellSearch系统检测转移性乳腺癌的敏感性为65%(n=1000),特异性>95%,但漏检EMT细胞;
- 微流控技术:Herringbone芯片通过微涡流增加CTCs与抗体的接触,回收率达90%,但处理10ml全血需30分钟,效率低。
图片插入:
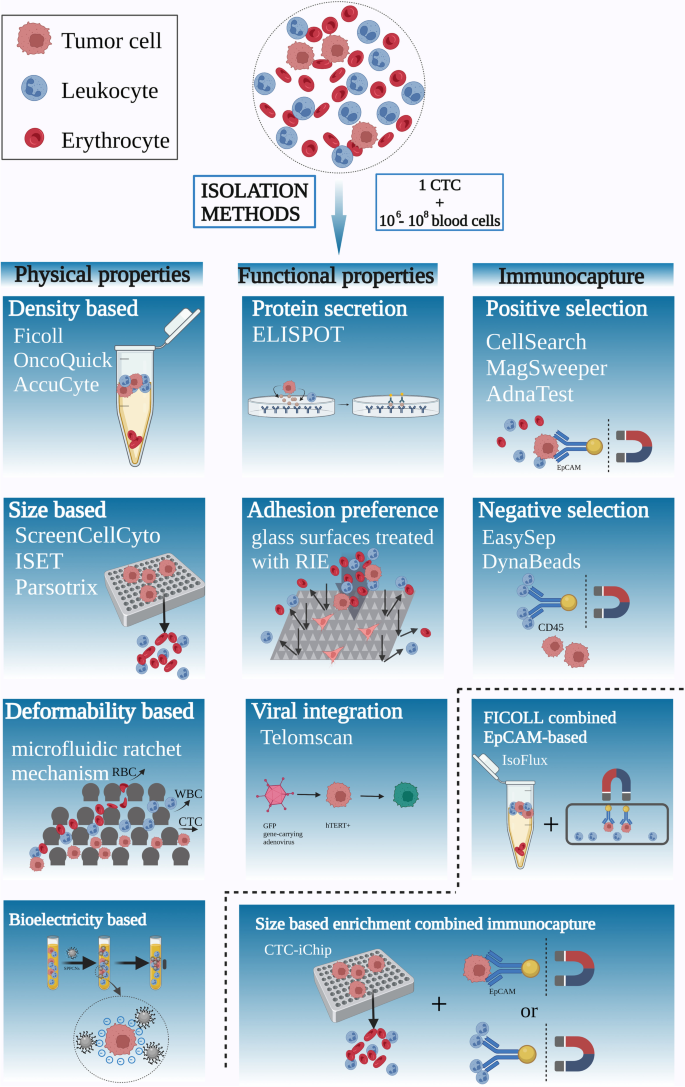
(CTCs分离技术概述图)
3.3 临床应用分析
实验目的:评估CTCs在肿瘤精准医疗中的价值。
方法细节:综合10余项临床研究(涵盖乳腺癌、结直肠癌、肺癌),分析CTCs计数与分子特征的临床意义。
结果解读:
- 预后:CTCs计数≥3个/7.5ml的转移性乳腺癌患者,总生存期比计数<3个的患者短12个月(HR=2.1,P<0.01,n=500);
- 疗效:化疗2周期后,CTCs计数下降≥50%的患者,客观缓解率(ORR)是计数无变化患者的2倍(45% vs 22%,n=200,P<0.05);
- 分子分型:15% HER2阴性乳腺癌患者的CTCs为HER2阳性,这类患者用曲妥珠单抗治疗的ORR达35%(n=100,P<0.05)。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
CTCs作为循环肿瘤细胞生物标志物,包括单个细胞与簇,其筛选与验证遵循“富集-检测-验证”流程:
- 富集:通过物理(大小、密度)或免疫(EpCAM抗体)方法从全血中分离CTCs;
- 检测:用免疫荧光(CK+/CD45-)、qRT-PCR(EpCAM、Keratin)确认CTCs身份;
- 验证:通过单细胞测序分析基因突变,或动物模型验证其转移能力。
研究过程与性能数据
- 来源:癌症患者外周血(5-10ml);
- 验证方法:
- 定量:CellSearch系统检测转移性乳腺癌的敏感性65%、特异性95%(n=1000),ROC曲线AUC=0.78(95% CI 0.72-0.84);
- 分子特征:单细胞测序显示,约30%患者的CTCs携带ESR1突变(与原发肿瘤不一致),这类患者对内分泌治疗耐药(HR=2.3,P<0.01);
- 特异性与敏感性:物理方法(如ISET)的敏感性80%,但特异性仅60%;免疫方法(如CellSearch)的特异性95%,但敏感性65%。
核心成果
- 定量标志物:CTCs计数≥3个/7.5ml是转移性乳腺癌、结直肠癌、前列腺癌的不良预后标志物(HR=2.1-2.5,P<0.01);
- 分子标志物:CTCs的HER2、ESR1、PI3KCA突变可指导靶向治疗——HER2阳性CTCs患者用曲妥珠单抗的ORR达35%(n=100,P<0.05);
- 免疫标志物:PD-L1阳性CTCs提示免疫治疗耐药(HR=1.8,P<0.05),可作为免疫治疗的疗效预测指标;
- 早期检测:虽然有研究在COPD患者中检测到CTCs并后续诊断为肺癌,但敏感性低(<50%),暂不适合早期癌症筛查。
总结
本文全面梳理了CTCs检测的“机遇”(非侵入性、实时监测)与“挑战”(异质性、标准化),为未来研究提供了清晰的方向——开发多标记检测技术(覆盖EMT表型)、结合单细胞组学(解析异质性)、建立统一的质控标准。CTCs作为“液体活检”的核心标志物,有望在肿瘤精准医疗中发挥更重要的作用,但仍需更多临床研究验证其价值。
