1. 领域背景与文献引入
文献英文标题:Emerging treatment modalities for systemic therapy in hepatocellular carcinoma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肝细胞癌系统治疗(靶向与免疫治疗)。
肝细胞癌(HCC)是全球第四大癌症死亡原因,占原发性肝癌的90%以上,其发病与乙肝/丙肝病毒感染、酒精性肝病等密切相关。早期HCC患者可通过肝切除术、肝移植或消融术获得潜在治愈,但超过70%的患者确诊时已处于晚期,常规化疗(如多柔比星)无法延长生存期,5年生存率不足10%。近年来,分子生物学的进展揭示了HCC的关键信号通路异常(如Ras-Raf-MAPK、PI3K-AKT-mTOR等),为靶向治疗提供了理论基础;2007年索拉非尼(首个多激酶抑制剂)的获批成为HCC系统治疗的里程碑,延长了晚期患者的中位总生存期(mOS)至10.7个月,但仍面临耐药性和不良反应(如手足皮肤反应、高血压)的挑战。2017年以来,免疫检查点抑制剂(如纳武利尤单抗)的出现为HCC治疗带来新希望,但其单药响应率仅约20%,且缺乏明确的生物标志物预测响应。此外,组合疗法(如抗血管生成药物联合免疫检查点抑制剂)显示出协同效应,成为当前研究热点——抗血管生成药物可改善肿瘤微环境(如减少血管渗漏、增强T细胞浸润),从而增强免疫治疗的疗效。然而,HCC的异质性、靶向治疗的耐药机制及免疫治疗的响应预测等问题仍未解决,亟需系统总结现有治疗策略及进展,为临床决策提供参考。
本研究旨在系统综述HCC的关键信号通路、靶向治疗与免疫治疗的最新进展,以及组合疗法的临床潜力,为解决现有治疗的局限性提供思路。
2. 文献综述解析
作者通过回顾HCC的分子病理机制(信号通路异常)及系统治疗的临床研究,按“信号通路-靶向治疗-免疫治疗-组合疗法”的逻辑展开综述,重点分析了各治疗策略的疗效、局限性及改进方向。
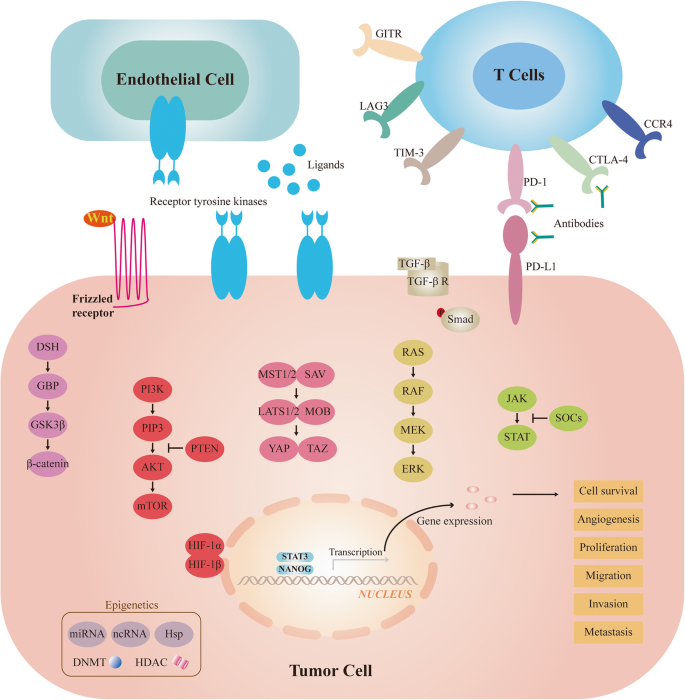
现有研究表明,HCC的发生与多条信号通路异常激活密切相关:Ras-Raf-MAPK通路调控细胞增殖,其异常激活(如Ras、Raf基因突变)促进HCC进展;PI3K-AKT-mTOR通路参与索拉非尼耐药,mTOR抑制剂(如依维莫司)在肝移植后患者中显示获益;Wnt-β-catenin通路与HCC复发相关,约40%的患者存在该通路突变(如β-catenin基因);促血管生成通路(如VEGF高表达)驱动HCC血管生成,VEGF受体抑制剂(如ramucirumab)可抑制肿瘤生长。靶向治疗方面,多激酶抑制剂(如索拉非尼、仑伐替尼)是晚期HCC的一线标准,但其疗效受限于靶点单一及耐药;免疫治疗方面,PD-1抑制剂(如纳武利尤单抗)在二线治疗中显示持久响应,但单药有效率低;组合疗法方面,抗血管生成药物(如贝伐珠单抗)联合PD-L1抑制剂(如阿替利珠单抗)的IMbrave150试验显示,mOS显著延长(未达到 vs 13.2个月,HR=0.58,P=0.0006),成为首个超越索拉非尼的一线方案。现有研究的局限性包括:靶向治疗的耐药机制未完全阐明,免疫治疗的生物标志物缺乏,组合疗法的最优剂量与顺序未确定。
本综述的创新之处在于系统整合了HCC的分子机制与最新临床数据,强调组合疗法的协同效应——抗血管生成药物改善肿瘤微环境、增强免疫治疗疗效,为临床制定个体化治疗策略提供了全面参考,弥补了现有研究对组合疗法总结不足的空白。
3. 研究思路总结与详细解析
本研究为系统综述,通过检索PubMed、Embase等数据库(方法细节未明确),纳入2007-2021年间HCC信号通路、靶向治疗、免疫治疗及组合疗法的关键研究(如索拉非尼的SHARP试验、仑伐替尼的REFLECT试验、阿替利珠单抗+贝伐珠单抗的IMbrave150试验),总结各治疗策略的疗效、安全性及研究进展。
3.1 关键信号通路解析
实验目的:明确HCC发生发展中的关键信号通路及其调控机制,为靶向治疗提供靶点依据。
方法细节:回顾HCC相关的信号通路研究,包括Ras-Raf-MAPK、PI3K-AKT-mTOR、Wnt-β-catenin、JAK-STAT、Hippo-YAP及促血管生成通路(VEGF、FGF等)。
结果解读:Ras-Raf-MAPK通路异常激活促进HCC细胞增殖,MEK抑制剂(如曲美替尼)联合索拉非尼在临床前研究中显示协同效应;PI3K-AKT-mTOR通路激活与索拉非尼耐药相关,mTOR抑制剂(如依维莫司)在肝移植后患者中显示获益;Wnt-β-catenin通路突变与HCC复发相关,约40%的患者存在该通路异常;促血管生成通路(如VEGF高表达)驱动HCC血管生成,VEGF受体抑制剂(如ramucirumab)可抑制肿瘤生长。
产品关联:文献提及的靶向药物包括索拉非尼(多激酶抑制剂)、仑伐替尼(多激酶抑制剂)、ramucirumab(VEGFR2抑制剂)等,均为临床常用药物,未提及具体实验试剂品牌。
3.2 靶向治疗策略总结
实验目的:总结HCC靶向治疗的临床进展,评估各药物的疗效与安全性。
方法细节:回顾一线(索拉非尼、仑伐替尼)及二线(regorafenib、cabozantinib、ramucirumab)靶向治疗的Ⅲ期临床试验数据。
结果解读:索拉非尼的SHARP试验显示,mOS为10.7个月 vs 安慰剂7.9个月(n=299 vs 303,P<0.001),成为首个延长晚期HCC生存期的靶向药;仑伐替尼的REFLECT试验显示,mOS为13.6个月 vs 索拉非尼12.3个月(非劣效,HR=0.92,P=0.026),且无进展生存期(mPFS)更长(7.4个月 vs 3.7个月,P<0.001);二线治疗中,regorafenib的RESORCE试验显示,mOS为10.6个月 vs 安慰剂7.8个月(n=573 vs 284,P<0.001),ramucirumab的REACH-2试验显示,AFP>400ng/ml的患者mOS为8.5个月 vs 安慰剂7.3个月(n=292 vs 146,P=0.019)。
产品关联:文献提及的靶向药物均为已获批的临床药物,如索拉非尼(拜耳)、仑伐替尼(卫材)、regorafenib(拜耳)、cabozantinib(Exelixis)、ramucirumab(礼来),未提及实验试剂。
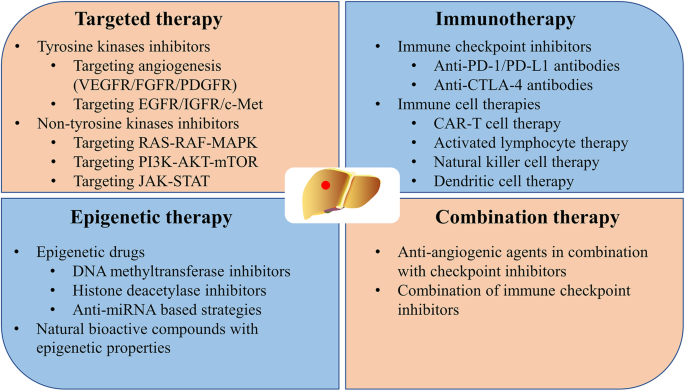
3.3 免疫治疗策略总结
实验目的:评估免疫治疗(免疫检查点抑制剂、细胞治疗)在HCC中的疗效与安全性。
方法细节:回顾免疫检查点抑制剂(PD-1/PD-L1、CTLA-4抑制剂)及细胞治疗(CAR-T、CIK)的临床研究。
结果解读:PD-1抑制剂纳武利尤单抗的CheckMate 040试验显示,二线治疗的客观响应率(ORR)为20%,疾病控制率(DCR)为60%,响应持续时间最长达30.5个月;帕博利珠单抗的KEYNOTE-224试验显示,二线治疗的mOS为12.9个月,ORR为17%;CTLA-4抑制剂伊匹木单抗联合纳武利尤单抗的CheckMate 040试验显示,二线治疗的ORR为33%,mOS为22.8个月;细胞治疗方面,CAR-T靶向GPC3的Ⅰ期试验显示,ORR为10%,但仍需更大样本验证。
产品关联:文献提及的免疫药物包括纳武利尤单抗(百时美施贵宝)、帕博利珠单抗(默沙东)、伊匹木单抗(百时美施贵宝),未提及细胞治疗的具体产品。
3.4 组合疗法研究解析
实验目的:分析组合疗法的协同机制与临床疗效,探索最优治疗方案。
方法细节:回顾抗血管生成药物联合免疫检查点抑制剂、双免疫检查点抑制剂联合的临床研究。
结果解读:抗血管生成药物(贝伐珠单抗)联合PD-L1抑制剂(阿替利珠单抗)的IMbrave150试验显示,一线治疗的mOS未达到 vs 索拉非尼13.2个月(HR=0.58,P=0.0006),ORR为27% vs 12%(P<0.001);双免疫检查点抑制剂(纳武利尤单抗+伊匹木单抗)的CheckMate 040试验显示,二线治疗的ORR为33%,mOS为22.8个月;仑伐替尼联合帕博利珠单抗的Ⅰb试验显示,ORR为46%,mPFS为9.3个月。组合疗法的不良反应与单药类似,主要为高血压、蛋白尿、免疫相关不良反应(如肺炎、结肠炎),多数可通过药物管理控制。
产品关联:文献提及的组合药物包括阿替利珠单抗+贝伐珠单抗(罗氏+安维汀)、纳武利尤单抗+伊匹木单抗(百时美施贵宝)、仑伐替尼+帕博利珠单抗(卫材+默沙东),未提及实验试剂。
4. Biomarker研究及发现成果解析
文献中涉及的Biomarker主要包括甲胎蛋白(AFP)、PD-L1表达、肿瘤突变负荷(TMB),其中AFP是唯一经Ⅲ期临床试验验证的预测 biomarker,用于筛选ramucirumab的获益人群,而PD-L1、TMB等仍处于探索阶段。
Biomarker定位与筛选逻辑
- AFP:HCC的经典血清标志物,用于ramucirumab的二线治疗筛选(REACH-2试验纳入索拉非尼耐药且AFP>400ng/ml的患者);
- PD-L1表达:用于预测免疫检查点抑制剂的响应,但不同研究的cutoff值不一致(如CPS≥1或CPS≥10);
- TMB:用于预测免疫治疗的响应,但HCC的TMB较低(中位数约3.8 mutations/Mb),相关性不明确。
研究过程与结果
- AFP:验证基于REACH-2试验,共纳入292例AFP>400ng/ml的晚期HCC患者,随机接受ramucirumab或安慰剂。结果显示,ramucirumab组mOS为8.5个月 vs 安慰剂7.3个月(HR=0.71,95%CI 0.53-0.95,P=0.019),ORR为4.6% vs 0.4%(P=0.016),表明AFP可有效筛选ramucirumab的获益人群;
- PD-L1表达:回顾性研究显示,CheckMate 040试验中PD-L1阳性(CPS≥1)患者的ORR为28% vs 阴性患者15%,但无统计学差异(P=0.12);
- TMB:小规模研究显示,高TMB(≥10 mutations/Mb)患者的免疫治疗响应率更高(ORR为33% vs 低TMB患者13%),但需更大样本验证。
核心成果提炼
- AFP是ramucirumab二线治疗的有效预测 biomarker(HR=0.71,P=0.019),可筛选出索拉非尼耐药且AFP升高的获益人群;
- PD-L1表达及TMB等Biomarker的预测价值仍需更大样本的前瞻性研究验证;
- 目前尚无明确的免疫治疗响应预测 biomarker,是未来研究的重点(如探索多基因 panel 或肿瘤微环境标志物)。
综上,本综述系统总结了HCC系统治疗的最新进展,强调组合疗法的协同效应,为临床制定个体化治疗策略提供了全面参考。未来研究需重点探索靶向治疗的耐药机制、免疫治疗的生物标志物及组合疗法的最优方案,以进一步提高HCC患者的生存率。
