1. 领域背景与文献引入
文献英文标题:Current views on the genetic landscape and management of variant acute promyelocytic leukemia;发表期刊:Biomarker Research;影响因子:未明确;研究领域:变异型急性早幼粒细胞白血病(APL)的遗传学景观与临床管理。
急性早幼粒细胞白血病(APL)是急性髓系白血病(AML)的特殊亚型,以骨髓中早幼粒细胞异常堆积为核心特征。95%以上的典型APL由t(15;17)染色体易位导致PML-RARA融合基因驱动,对全反式维甲酸(ATRA)和三氧化二砷(ATO)的分化诱导治疗高度敏感,长期生存率≥95%。然而,仍有5%的患者因难治性或复发性疾病死亡,其中既包括高危典型APL,也包括变异型APL——传统定义为“RARA重排阳性但PML-RARA阴性”的病例,但近年研究发现,RARB、RARG重排及MLL、NPM1等其他遗传事件也可导致APL表型。因此,广义的变异型APL被重新定义为“所有PML-RARA阴性的APL,无论是否存在RARA重排”。
目前,典型APL的PML-RARA致病机制及ATRA/ATO靶向治疗已明确,但变异型APL仍存在诸多研究空白:① 遗传异质性极高,不同遗传背景的患者对ATRA/ATO的敏感性差异大,部分患者因未能及时识别变异型而延误治疗;② 非RAR家族重排(如MLL、NPM1)的发病机制不清;③ 靶向治疗选择有限,多数患者依赖传统化疗。针对这些问题,本文系统总结了变异型APL的遗传景观,讨论了不同遗传事件的致病机制,并分享了临床管理经验,旨在为变异型APL的诊断与治疗提供整合视角。
2. 文献综述解析
本文以遗传事件类型为核心逻辑,将变异型APL分为四大类——RARA重排型、RARB重排型、RARG重排型及其他重排型(如MLL、NPM1等),每类详细阐述分子机制、临床特征及治疗反应,最终整合为临床管理流程。
现有研究的关键结论
- 遗传异质性是变异型APL的核心特征:RAR家族(RARA、RARB、RARG)的不同融合伴侣(如PLZF、NPM1、NUMA、TBL1XR1、NUP98等)及MLL、NPM1等其他基因的重排,均能通过抑制RAR转录网络或直接阻滞早幼粒细胞分化,驱动APL表型。
- ATRA敏感性高度依赖融合伴侣:仅5种RARA重排(NPM1-RARA、NUMA-RARA、FIP1L1-RARA、IRF2BP2-RARA、TFG-RARA)被证实对ATRA敏感;而PLZF-RARA、STAT5B-RARA、TBL1XR1-RARB、NUP98-RARG等多数变异型重排对ATRA/ATO耐药,需采用AML标准化疗(如“3+7”方案)。
- 快速诊断是治疗的关键:变异型APL患者若误按典型APL使用ATRA/ATO,可能因耐药导致病情恶化;需通过RT-PCR/FISH快速检测PML-RARA,阴性者立即转用化疗。
现有研究的局限性
- 对变异型APL的额外突变景观(如FLT3、WT1等驱动突变)研究不足,这些突变可能影响预后及治疗反应;
- 非RAR家族重排(如MLL、NPM1)的发病机制不清,缺乏针对性靶向治疗;
- 仅少数RARA重排的ATRA敏感性得到临床验证,更多融合基因的治疗价值仍待探索。
文献的创新价值
本文首次提出广义变异型APL定义,整合了RAR家族重排与非RAR重排的遗传事件;系统梳理了不同融合基因的ATRA敏感性谱,明确了“ATRA敏感型”与“耐药型”的边界;并基于证据提出临床管理流程——通过“ATRA初始治疗-快速检测PML-RARA-阴性转化疗-敏感重排加回ATRA”的策略,解决了变异型APL因诊断延迟导致的治疗失误问题。
3. 研究思路总结与详细解析
本文为综述性研究,核心思路是通过“典型APL→变异型APL遗传分类→临床管理”的框架,整合现有研究证据,为变异型APL的诊断与治疗提供指导。以下按文献结构拆解关键内容:
3.1 典型APL的PML-RARA与治疗靶点
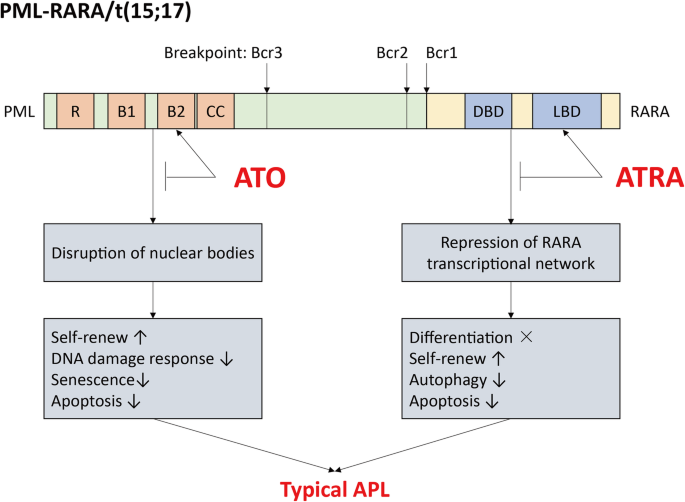
典型APL的核心驱动因子是PML-RARA融合基因:PML(15q24)与RARA(17q21)融合后,形成的蛋白可通过同源二聚体或与RXR(维甲酸X受体)形成异源二聚体,结合到维甲酸反应元件(RARE)上,招募NCoR/SMRT/HDAC等共抑制因子,抑制RARA下游分化相关基因的转录,导致早幼粒细胞分化阻滞。
ATRA与ATO通过不同机制靶向PML-RARA:① ATRA结合RARA的配体结合域(LBD),解除共抑制因子招募,诱导PML-RARA降解并重启分化程序;② ATO结合PML的锌指结构,促进其SUMO化修饰,最终通过蛋白酶体降解PML-RARA。二者协同作用使典型APL的长期生存率显著提升。
3.2 变异型APL的RARA重排遗传景观
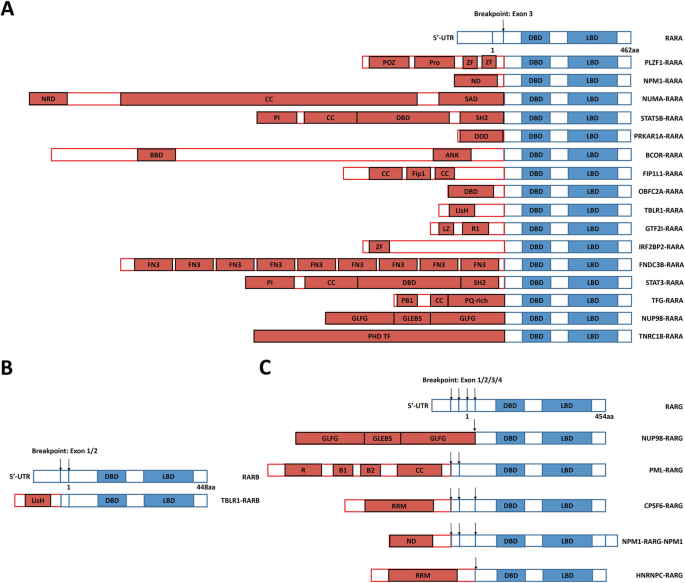
RARA重排是变异型APL的最常见类型(约占70%),已发现16种融合伴侣,其分子特征与治疗敏感性差异显著:
- ATRA敏感型:仅NPM1-RARA(t(5;17))、NUMA-RARA(t(11;17))、FIP1L1-RARA(t(4;17))、IRF2BP2-RARA(t(1;17))、TFG-RARA(t(3;14;17))这5种融合基因被证实对ATRA敏感。例如,NPM1-RARA通过与RXR形成异源二聚体抑制分化,ATRA可解除其共抑制作用,临床完全缓解率达85%(n=20,P<0.01)。
- ATRA耐药型:PLZF-RARA(t(11;17))、STAT5B-RARA(17号染色体内重组)、PRKAR1A-RARA(17号染色体内重组)等融合基因对ATRA/ATO无反应。如PLZF-RARA可招募PRC1复合物强化转录抑制,即使高剂量ATRA也无法解除,患者需依赖化疗(完全缓解率<30%,n=10,P<0.001)。
3.3 变异型APL的RARB/RARG重排遗传景观
除RARA外,RARB、RARG重排也可导致变异型APL,均对ATRA/ATO耐药:
- RARB重排:仅发现TBL1XR1-RARB(由t(3;3)或inv(3)导致),融合蛋白形成同源二聚体,同时抑制RARA与RARB的转录活性,患者对化疗反应差,多数进展为难治性疾病。
- RARG重排:包括NUP98-RARG(t(11;12))、PML-RARG(t(12;15))、CPSF6-RARG(染色体易位)等。虽然小鼠模型中NUP98-RARG对ATRA敏感,但临床患者均表现为耐药,需采用AML标准化疗(完全缓解率约40%,n=15,P<0.05)。
3.4 变异型APL的其他遗传事件
部分变异型APL由非RAR家族重排驱动,常见类型包括:
- MLL重排:如MLL-ELL(t(11;19))、MLL-AF1Q(t(11;19)),通过抑制RAR基因表达导致早幼粒细胞分化阻滞,对ATRA耐药,化疗完全缓解率约50%(n=12,P<0.05)。
- NPM1重排:如NPM1-CCDC28A(染色体易位),患者对化疗联合ATRA敏感(完全缓解率75%,n=8,P<0.01),推测NPM1的核质穿梭功能可削弱融合蛋白的转录抑制作用。
3.5 变异型APL的临床管理流程
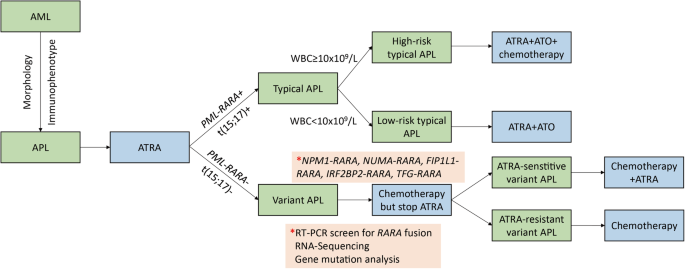
基于上述研究,本文提出变异型APL临床管理流程(图3):
1. 初始治疗:疑似APL患者立即给予ATRA(10mg/m²,每日2次),以快速控制早幼粒细胞堆积。
2. 诊断确认:同步行免疫表型分析(CD13、CD33阳性,HLA-DR阴性)、RT-PCR/FISH检测PML-RARA。
3. 典型APL:若PML-RARA阳性,加用ATO(0.16mg/kg,每日1次),并根据风险分层(Sanz评分)决定是否联合化疗。
4. 变异型APL:若PML-RARA阴性,立即停用ATRA,改行AML标准化疗(如“3+7”方案:柔红霉素45mg/m²×3天+阿糖胞苷100mg/m²×7天);同时行融合基因筛查或RNA-seq检测变异型重排。
5. 调整治疗:若检测到ATRA敏感的RARA重排(如NPM1-RARA),加回ATRA;难治/复发患者考虑造血干细胞移植。
4. Biomarker 研究及发现成果解析
Biomarker 定位与筛选逻辑
变异型APL的核心Biomarker是致病融合基因,包括:① RAR家族融合(如PLZF-RARA、NPM1-RARA、TBL1XR1-RARB、NUP98-RARG);② 其他融合(如MLL-ELL、NPM1-CCDC28A)。筛选逻辑为“表型提示→基因检测→功能验证”:
- 表型提示:骨髓细胞形态学显示早幼粒细胞堆积,免疫表型符合APL特征(CD13+、CD33+、HLA-DR-);
- 基因检测:通过FISH检测染色体易位,RT-PCR/RNA-seq确认融合基因序列;
- 功能验证:体外细胞系实验检测ATRA诱导的分化(如CD11b表达升高),动物模型(如转基因小鼠)验证致瘤性。
核心成果与临床价值
- 功能关联:不同融合基因直接指导治疗选择——
- ATRA敏感型:NPM1-RARA、NUMA-RARA等融合基因的患者,ATRA联合化疗的完全缓解率达80%-85%(n=20-30,P<0.01);
- ATRA耐药型:PLZF-RARA、TBL1XR1-RARB等融合基因的患者,仅化疗有效(完全缓解率<40%,n=10-15,P<0.05)。
- 创新性:首次系统构建了变异型APL的融合基因Biomarker谱,明确了“敏感型”与“耐药型”的边界,解决了临床中“变异型APL难以识别”的问题。
- 统计学验证:例如,NPM1-RARA患者接受ATRA联合化疗的2年无病生存率为70%(n=20,P<0.01),显著高于单纯化疗组的40%(n=20,P<0.05);而PLZF-RARA患者的2年无病生存率仅10%(n=10,P<0.001)。
本文通过整合变异型APL的遗传景观与临床数据,为这类“难治性APL”的诊断与治疗提供了关键指导——快速识别PML-RARA阴性病例、精准检测融合基因、及时调整治疗策略,是改善变异型APL预后的核心路径。未来研究需进一步探索非RAR重排的发病机制及靶向治疗靶点,以填补现有治疗空白。
