1. 领域背景与文献引入
文献英文标题:Exploring the feasibility of using long-term stored newborn dried blood spots to identify metabolic features for congenital heart disease screening;发表期刊:Biomarker Research;影响因子:未公开;研究领域:先天性心脏病筛查与代谢组学生物标志物。
先天性心脏病(CHD)是新生儿和儿童发病及死亡的重要原因,尽管产前诊断和早期检测技术的进步使其死亡率逐渐下降,但紫绀型CHD的临床检测敏感性仍不足75%,且目前缺乏出生时可用于CHD全面、低成本筛查的方法。与此同时,美国数百万婴儿通过新生儿筛查(NBS)利用干血斑(DBS)检测遗传、内分泌和代谢疾病,但尚未有基于DBS的CHD出生筛查方案。领域共识:DBS因易储存、运输且样本量小,是新生儿疾病筛查的理想样本类型;代谢组学可通过分析生物样本中的代谢物变化,为疾病biomarker研究提供全局视角。在此背景下,本研究旨在评估利用长期储存的新生儿DBS识别CHD代谢特征的可行性,验证DBS代谢组学在CHD筛查及亚型分类中的应用潜力,为解决CHD出生筛查的临床空白提供依据。
2. 文献综述解析
文献综述的核心评述逻辑围绕“CHD的临床挑战→现有筛查方法的局限→DBS代谢组学的应用潜力”展开:作者首先阐述CHD作为新生儿关键疾病的现状——虽死亡率下降但检测敏感性不足,接着指出NBS中DBS的广泛应用(用于其他疾病但未覆盖CHD),进而提出假设:长期储存的DBS经代谢组学分析可高精度反映心脏异常。
现有研究的关键结论包括:产前诊断和早期检测降低CHD死亡率;DBS是NBS的核心样本但未用于CHD;代谢组学在疾病biomarker挖掘中具有高敏感性。现有研究的局限性在于:缺乏利用长期储存DBS开展CHD代谢biomarker研究的报道,未系统分析CHD不同亚型的代谢差异,限制了CHD精准筛查的发展。
本研究的创新价值在于:首次验证长期储存(最长15年)DBS用于CHD代谢谱分析的可靠性;鉴定出CHD评估及亚型分类的潜在代谢biomarker;建立基于DBS的CHD筛查和亚型分类模型,为CHD出生筛查提供了新的技术路径。
3. 研究思路总结与详细解析
本研究的整体框架为:以“长期储存DBS的代谢谱可靠性验证→CHD代谢特征分析→biomarker筛选与模型构建”为核心逻辑,研究目标是评估DBS用于CHD代谢biomarker识别的可行性,核心科学问题是长期储存DBS的代谢数据可靠性及CHD相关代谢通路差异,技术路线涵盖队列构建、方法开发、可靠性验证、通路分析及模型构建的闭环。
3.1 队列构建与样本收集
实验目的是获取包含正常对照及不同CHD亚型的新生儿DBS样本,为后续代谢分析提供基础。方法细节为从加州公共卫生部(CDPH)生物库获取20例新生儿DBS样本,其中5例为正常对照,15例为CHD患者(进一步分为法洛四联症(TOF,4例)、遗传性心律失常综合征(IAS,5例,含2例Brugada综合征、3例长QT综合征)、心肌病(CMP,6例,含3例扩张型、3例肥厚型心肌病)),样本储存时间最长达15年(储存时间分布见图S2)。结果显示成功构建了涵盖正常人群及主要CHD亚型的研究队列,样本特征符合代谢组学分析要求。
3.2 DBS代谢组学方法开发与可靠性验证
实验目的是建立DBS定量代谢组学方法,并验证长期储存DBS代谢谱的可靠性。方法细节为开发基于液相色谱-串联质谱(LC-MS/MS)的DBS代谢组学方法,同时分析亲水性和疏水性代谢物;通过将本研究中绝对定量的代谢物浓度与CDPH NBS记录中的对应数据进行相关性分析,验证代谢谱的可靠性。结果显示,28种与CDPH记录匹配的代谢物中,24种呈现强正相关(图1为相关性散点图),证明长期储存DBS的代谢谱具有良好可靠性。实验所用关键产品:文献未提及具体实验产品,领域常规使用LC-MS/MS系统(如Thermo Fisher Q Exactive系列)及代谢物定量试剂盒(如Biocrates AbsoluteIDQ系列)。

3.3 CHD代谢通路与亚型差异分析
实验目的是解析CHD患者的代谢通路变化及不同亚型的代谢差异。方法细节为对亲水性代谢物(基于KEGG数据库)和疏水性代谢物(基于Lipid Map数据库)分别进行通路富集分析,采用正交偏最小二乘判别分析(OPLS-DA)分析样本聚类模式。结果显示,CHD患者存在脂质代谢、能量代谢及氧化应激通路的异常;不同CHD亚型的代谢通路差异显著:所有亚型均富集花生四烯酸代谢和单酰甘油通路,IAS和TOF亚型额外富集亚油酸代谢、血清素能突触及鞘氨醇碱基通路,CMP亚型仅富集醌和氢醌通路,IAS亚型仅富集精氨酸和鸟氨酸代谢(通路富集结果见图S3D、E)。聚类分析中,亲水性代谢组学对IAS亚型的区分能力较弱(AUC=0.607,P=0.46),疏水性代谢组学对CMP亚型的区分能力较弱(AUC=0.53,P=0.83)(图S3C),提示需结合两类代谢物进行CHD亚型分类。
3.4 CHD诊断与亚型分类模型构建
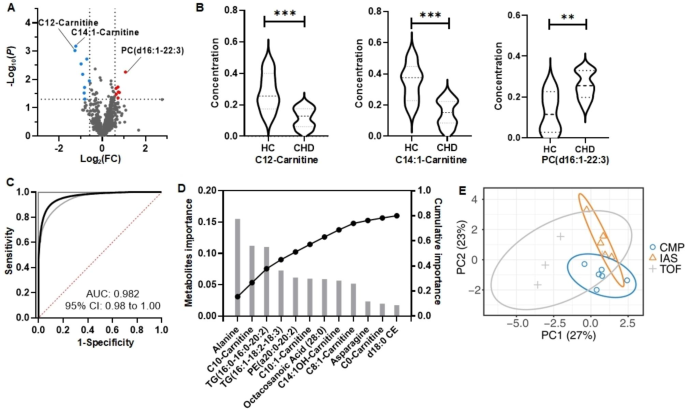
实验目的是筛选CHD诊断及亚型分类的代谢biomarker,构建分类模型。方法细节为:通过单变量分析(P<0.05)筛选CHD患者与正常对照的差异代谢物;基于筛选出的biomarker构建Logistic模型用于CHD鉴别;采用LightGBM模型筛选对CHD亚型分类贡献最大的代谢物(累计重要性达80%),并通过偏最小二乘判别分析(PLS-DA)验证聚类效果。结果显示,筛选出3种CHD诊断biomarker:PC(d16:1–22:3)、C14:1-肉碱、C12-肉碱(图2A为火山图,差异代谢物标注为红/蓝点;图2B为小提琴图,P<0.05,P<0.01,**P<0.001);Logistic模型区分CHD与对照的曲线下面积(AUC)达0.982(95%置信区间0.92-1.00,图2C)。对于亚型分类,12种代谢物(如丙氨酸、C10-肉碱、TG(16:0–16:0–20:2)等)的累计重要性达80%(图2D),PLS-DA分析显示这些代谢物可有效区分不同CHD亚型(图2E)。
4. Biomarker 研究及发现成果解析
本研究中的Biomarker分为两类:用于CHD与正常对照鉴别的3种代谢物(PC(d16:1–22:3)、C14:1-肉碱、C12-肉碱),及用于CHD亚型分类的12种代谢物(如丙氨酸、C10-肉碱等)。其筛选与验证逻辑为:首先通过队列样本的LC-MS/MS代谢组学分析获取代谢谱,再经单变量分析(P<0.05)筛选CHD相关差异代谢物,接着用Logistic模型验证其诊断效能;对于亚型分类,通过LightGBM模型计算代谢物重要性,选取累计重要性达80%的代谢物,最后用PLS-DA验证聚类效果。
Biomarker的来源为加州公共卫生部生物库的长期储存新生儿DBS样本;验证方法包括:LC-MS/MS定量检测代谢物浓度,Logistic模型评估诊断效能(AUC、95%置信区间),LightGBM模型评估亚型分类的代谢物重要性,PLS-DA验证聚类效果。特异性与敏感性数据显示,3种诊断biomarker构建的Logistic模型AUC达0.982(95% CI 0.92-1.00),敏感性与特异性较高;12种亚型分类biomarker的累计重要性达80%,PLS-DA显示不同亚型样本可有效聚类(图2E)。
核心成果包括:首次证实长期储存(最长15年)的DBS可用于CHD代谢biomarker研究,代谢谱具有良好可靠性;鉴定出3种可有效区分CHD与正常对照的代谢biomarker(P<0.05);筛选出12种用于CHD亚型分类的关键代谢物;解析了CHD患者的代谢通路异常(如脂质代谢、氧化应激),为CHD病理机制研究提供了新线索。本研究的biomarker及模型为CHD的出生筛查及精准分类提供了基于DBS的解决方案,具有重要临床转化潜力。
