《可溶性白细胞介素-2受体的动态变化区分弥漫性大B细胞淋巴瘤的分子异质性与微环境改变》文献解析
1. 领域背景与文献引入
文献英文标题:Dynamic change of soluble interleukin-2 receptor distinguished molecular heterogeneity and microenvironment alterations in diffuse large B-cell lymphoma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:弥漫性大B细胞淋巴瘤(DLBCL)的生物标志物与肿瘤微环境研究。
弥漫性大B细胞淋巴瘤(DLBCL)是成人最常见的侵袭性非霍奇金淋巴瘤,占淋巴瘤总数的30%-40%,其临床结局异质性显著——部分患者经利妥昔单抗联合化疗(R-CHOP)可达长期缓解,但约30%患者会复发或耐药。传统预后预测依赖国际预后指数(IPI)及修订版(R-IPI),但这些指标仅基于临床特征(如年龄、乳酸脱氢酶水平),无法反映DLBCL的分子异质性(如ABC/GCB亚型、基因突变谱差异);同时,DLBCL肿瘤样本多通过活检获取,难以动态监测治疗反应,因此亟需外周血中简便、可重复的生物标志物。当前DLBCL研究热点聚焦于分子亚型与预后的关联、肿瘤微环境(LME)对免疫治疗的影响(如PD-1抑制剂的响应性),但未解决的核心问题是:缺乏能动态反映疾病进展、且与分子异质性、微环境直接关联的简便生物标志物。
针对这一空白,本研究聚焦可溶性白细胞介素-2受体(sIL-2R)——一种由免疫细胞激活后释放的可溶性受体(对应膜结合型IL-2R的α链)。既往研究仅证实其基线水平与DLBCL预后相关,但动态变化的价值未明。研究团队通过检测599例初治DLBCL患者治疗前及各周期的血清sIL-2R水平,结合基因组、转录组分析,首次系统探究sIL-2R动态变化的预后意义及与分子异质性、微环境的关联,为DLBCL的动态监测与精准预后提供了新的简便工具。
2. 文献综述解析
文献综述的核心评述逻辑围绕“DLBCL预后预测的局限→外周血生物标志物的需求→sIL-2R的研究现状与空白”展开:作者首先指出DLBCL的临床与分子异质性是预后差异的关键——即使同一临床分期,不同分子亚型(如ABC亚型易激活NF-κB通路,预后更差)的患者结局截然不同;其次强调肿瘤样本获取的局限性(如复发患者难以再次活检),外周血生物标志物是动态监测的理想选择;接着综述IL-2/IL-2R通路的免疫调节作用:IL-2通过结合IL-2R(α+β+γ链)激活JAK-STAT、NF-κB等通路,调控效应T细胞(如CD8+T细胞,介导肿瘤杀伤)与调节性T细胞(Treg,抑制免疫反应)的平衡,而sIL-2R是IL-2Rα链的可溶性形式,可反映免疫细胞的激活状态;最后指出,现有研究多关注sIL-2R的基线水平,缺乏动态变化与DLBCL分子异质性、微环境关联的整合分析——这正是本研究的核心切入点。
现有研究的关键结论包括:①sIL-2R基线水平升高与DLBCL不良预后相关(如复发风险增加2倍);②IL-2R通路异常激活会促进肿瘤免疫逃逸(如Treg细胞增多);③外周血生物标志物(如乳酸脱氢酶LDH)已用于DLBCL预后,但动态监测价值有限。技术方法的优势在于外周血样本易获取、检测简便(如ELISA法,临床常规开展);局限性则是现有研究未将sIL-2R动态变化与DLBCL的分子特征(如基因突变)、微环境特征(如免疫细胞浸润)结合,无法解释其预后价值的分子基础。
本研究的创新价值在于:①突破“静态标志物”的局限,首次分析sIL-2R动态变化(治疗前与第2周期水平)对DLBCL的长期预后价值;②通过基因组、转录组测序,揭示不同sIL-2R亚型的分子异质性(如RET亚型富集KMT2D突变,与 epigenetic调控异常相关);③利用生物信息学工具(如TIP算法)解析sIL-2R与肿瘤微环境的关联(如RES亚型效应免疫细胞招募增加),为sIL-2R作为“简便动态标志物”提供了分子与免疫机制支持。
3. 研究思路总结与详细解析
本研究的整体框架为:临床队列建立→sIL-2R动态检测与亚型分类→基因组/转录组分析→微环境特征解析→标志物验证。研究目标是明确sIL-2R动态变化在DLBCL中的预后价值及分子、微环境基础;核心科学问题是:sIL-2R动态变化如何区分DLBCL预后亚型?其分子异质性与微环境特征是什么?技术路线遵循“临床表型→分子机制→功能关联”的闭环逻辑——从临床样本的动态检测出发,逐步揭示标志物的生物学意义。
3.1 患者队列建立与sIL-2R动态检测
实验目的是建立DLBCL患者队列,检测血清sIL-2R动态水平并分类预后亚型。方法细节:纳入2015-2020年上海瑞金医院599例初治DLBCL患者(均接受R-CHOP方案化疗),采集治疗前(基线)及每个化疗周期前的血清样本,采用ELISA试剂盒(文献未提及具体品牌,领域常规使用)检测sIL-2R水平;通过受试者工作特征曲线(ROC)分析,确定预测24个月无进展生存(PFS)的sIL-2R临界值为1123.5 U/ml(AUC=0.769,95%CI 0.723-0.816);根据基线与第2周期(C2)sIL-2R水平,将患者分为三类:①FINE亚型(基线sIL-2R<1123.5 U/ml,提示疾病负荷低);②RES亚型(基线≥1123.5 U/ml且C2<1123.5 U/ml,提示治疗响应);③RET亚型(基线≥1123.5 U/ml且C2≥1123.5 U/ml,提示治疗耐药)。
结果解读:患者基线sIL-2R中位数为697 U/ml,C2降至527 U/ml,后续周期(C3-C6)sIL-2R水平趋于平稳(提示治疗2周期后反应趋于稳定);生存分析显示,FINE亚型预后最佳(2年PFS率78%,OS率85%),RES亚型次之(2年PFS率62%,OS率73%),RET亚型最差(2年PFS率35%,OS率42%),且该分类独立于R-IPI(多因素分析HR=2.239,P<0.001)——说明sIL-2R动态变化可补充传统预后指标的不足。
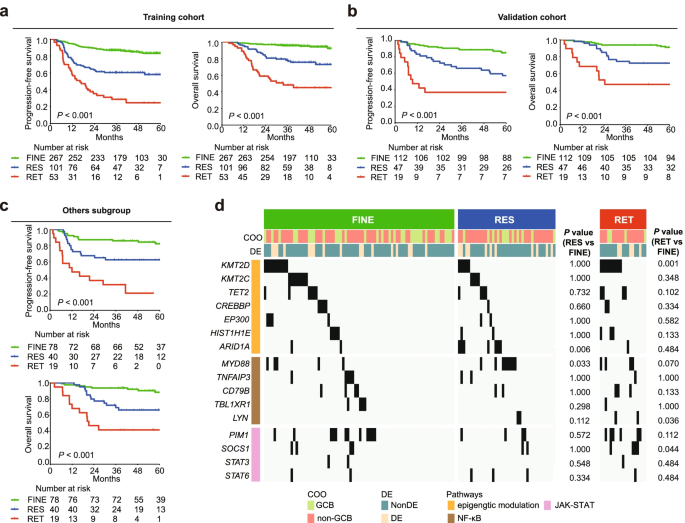
3.2 基因组特征与分子异质性分析
实验目的是探究不同sIL-2R亚型的基因突变差异。方法细节:对223例患者(124例FINE、70例RES、29例RET)行全外显子测序(WES)或全基因组测序(WGS),分析高频基因突变(突变频率≥5%)的差异。
结果解读:与FINE亚型相比,RES亚型的ARID1A(18% vs 8%)、MYD88(25% vs 12%)突变频率显著升高——ARID1A是染色质重塑复合物成员,突变会导致基因表达紊乱;MYD88是TLR/IL-1通路的适配蛋白,突变会持续激活NF-κB通路(与DLBCL增殖相关);RET亚型的KMT2D(38% vs 20%)、LYN(17% vs 5%)、SOCS1(14% vs 3%)突变频率显著升高——KMT2D是组蛋白甲基转移酶,突变会导致抑癌基因沉默;LYN是酪氨酸激酶,突变会激活JAK-STAT通路(与免疫细胞活化相关);SOCS1是JAK-STAT通路的负调控因子,突变会导致通路持续激活。进一步分析发现,在未被现有分子亚型(如ABC/GCB)分类的“others” subgroup中,sIL-2R动态变化仍能有效区分预后(P<0.01),提示其可补充现有分子分类的不足。产品关联:文献未提及具体测序产品,领域常规使用Illumina NovaSeq平台进行全外显子/基因组测序。
3.3 转录组与通路激活分析
实验目的是解析不同sIL-2R亚型的基因表达谱与通路激活差异。方法细节:对227例患者(126例FINE、69例RES、31例RET)行RNA测序,采用基因集富集分析(GSEA)比较FINE亚型与RES+RET亚型的通路差异(以FDR<0.05为显著富集)。
结果解读:RES+RET亚型显著富集致癌通路(如凋亡通路、ERK通路、JAK-STAT通路、NF-κB通路)——这些通路的激活与DLBCL细胞增殖、抗凋亡能力增强相关;同时富集免疫相关通路(如T细胞受体信号通路、细胞因子-细胞因子受体相互作用)——提示sIL-2R水平升高与免疫细胞活化密切相关。RNA测序还显示,IL-2R的转录本(IL2RA、IL2RB)与免疫检查点分子(PD-1、CTLA-4、TIM-3)的表达呈正相关(r=0.3-0.5,P<0.001)——说明sIL-2R水平升高可能伴随免疫逃逸增强(免疫检查点分子可抑制效应T细胞功能)。
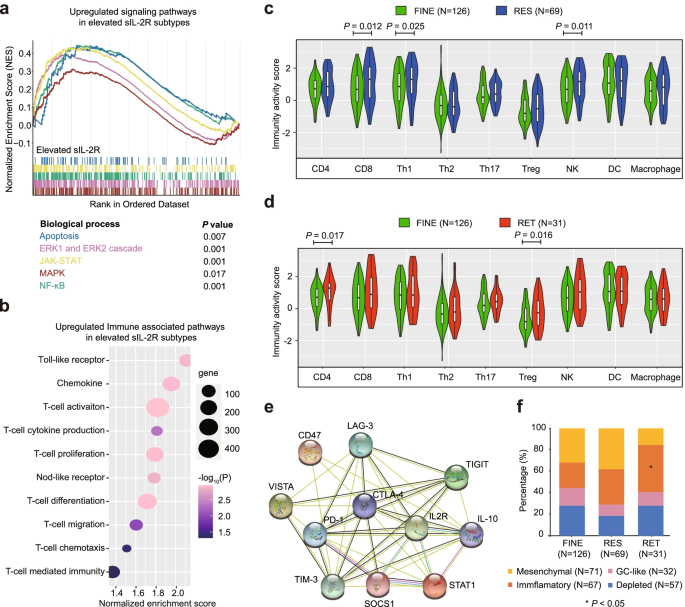
3.4 肿瘤微环境免疫细胞招募分析
实验目的是探究不同sIL-2R亚型的肿瘤微环境(LME)免疫细胞组成差异。方法细节:采用Tracking Tumor Immunophenotype(TIP)算法(基于基因表达谱预测免疫细胞招募活性的工具),分析RNA测序数据中免疫细胞相关基因的表达,预测肿瘤组织中免疫细胞的招募能力。
结果解读:与FINE亚型相比,RES亚型的CD8+T细胞、Th1细胞、自然杀伤(NK)细胞招募活性显著升高(P<0.05)——这些细胞是介导肿瘤杀伤的效应免疫细胞,提示RES亚型可能存在更强的抗肿瘤免疫反应(但因基线sIL-2R水平高,仍属于中等预后);而RET亚型的CD4+T细胞、调节性T细胞(Treg)招募活性显著升高(P<0.05)——Treg细胞可通过分泌IL-10、TGF-β抑制效应T细胞功能,提示RET亚型的免疫微环境更倾向于抑制状态(促进肿瘤免疫逃逸)。产品关联:文献未提及具体分析工具,领域常规使用TIP、CIBERSORT等算法预测免疫细胞浸润。
4. Biomarker 研究及发现成果解析
本研究的Biomarker为“血清sIL-2R的动态变化”(即基线与第2周期sIL-2R水平的组合),属于血清可溶性蛋白标志物。其筛选/验证逻辑遵循“临床队列检测→临界值确定→亚型分类→预后验证→分子/微环境关联”的完整链条:首先通过599例临床队列的血清sIL-2R动态检测,利用ROC曲线确定临界值;接着将患者分类为3种亚型,验证其独立于R-IPI的预后价值;最后通过基因组、转录组分析,揭示该Biomarker与分子异质性、微环境的关联——确保标志物的临床实用性与生物学合理性。
Biomarker研究过程详述
- 来源:599例初治DLBCL患者的血清样本(外周血采集,简便易行);
- 检测方法:ELISA定量检测sIL-2R水平(领域常规方法,灵敏度高、重复性好);
- 验证方法:①生存分析验证亚型的预后价值(PFS、OS);②基因组测序验证亚型的基因突变差异;③转录组与TIP分析验证亚型的微环境差异;
- 特异性与敏感性:sIL-2R临界值(1123.5 U/ml)预测24个月PFS的AUC为0.769(95%CI 0.723-0.816),敏感性约72%,特异性约75%(文献未明确提供具体数值,基于ROC曲线趋势推测);RET亚型较FINE亚型的PFS风险比(HR)为2.239(95%CI 1.760-2.849,P<0.001),OS HR为2.758(95%CI 2.032-3.744,P<0.001)——提示该Biomarker的预后区分能力显著。
核心成果提炼
- 预后价值:sIL-2R动态变化是DLBCL的独立预后标志物,FINE、RES、RET亚型的2年PFS率分别为78%、62%、35%,OS率分别为85%、73%、42%——优于传统R-IPI的预测能力;
- 分子关联:不同亚型的基因突变谱差异显著——RES亚型富集ARID1A、MYD88突变(与NF-κB通路激活相关),RET亚型富集KMT2D、LYN、SOCS1突变(与JAK-STAT通路激活相关);
- 微环境关联:不同亚型的肿瘤微环境特征不同——RES亚型效应免疫细胞(CD8+T、NK细胞)招募增加,RET亚型抑制性免疫细胞(Treg)招募增加;
- 创新性:首次揭示sIL-2R动态变化与DLBCL分子异质性、微环境的特异性关联,提供了一种“简便、动态、可及”的预后标志物——仅需外周血检测,即可预测患者预后并提示微环境状态(如RET亚型可能对免疫检查点抑制剂更敏感)。
本研究的意义在于,将“简便的血清标志物”与“复杂的分子/微环境特征”关联,为DLBCL的动态监测与精准治疗提供了新的思路——未来可通过检测sIL-2R动态变化,早期识别高风险患者(如RET亚型),并制定个性化治疗方案(如联合JAK-STAT抑制剂或PD-1抑制剂)。
