1. 领域背景与文献引入
文献英文标题:Minimal residual disease in multiple myeloma: current status;发表期刊:Biomarker Research;影响因子:未公开;研究领域:多发性骨髓瘤微小残留病(MM MRD)
多发性骨髓瘤(MM)是一种以骨髓恶性浆细胞增殖为特征的血液系统肿瘤,过去几十年中,自体干细胞移植(ASCT)、蛋白酶体抑制剂(如硼替佐米)和免疫调节剂(如来那度胺)的应用显著延长了患者总生存期(OS),但MM仍不可治愈,超过80%的患者会复发。随着新型药物(如CD38单抗、XPO1抑制剂)的获批,更多患者达到深度缓解,传统的完全缓解(CR)标准(血清/尿免疫固定电泳阴性、骨髓浆细胞<5%)已无法准确评估治疗效果——部分CR患者仍会在2年内复发。2016年,国际骨髓瘤工作组(IMWG)将微小残留病(MRD)纳入疗效评估体系,定义为CR患者中残留的少量癌细胞(10⁵正常细胞中≤1个肿瘤细胞)。
现有研究已证实MRD是MM的独立预后因素,MRD阴性患者的无进展生存期(PFS)和OS显著长于阳性患者,但相关研究多集中在检测方法优化和临床意义验证,对MRD的生物学特征(如突变谱、细胞遗传学动态、基因表达谱)研究极少,限制了对MRD耐药机制的理解和靶向治疗的开发。本文的研究初衷是系统综述MM MRD的检测方法、临床意义,并重点解析其生物学特征,填补MRD基础研究的空白。
2. 文献综述解析
作者将现有MRD研究分为三类——检测方法(骨髓内与骨髓外)、临床意义(预后价值)、生物学特征(细胞遗传学动态、突变谱、基因表达谱),通过回顾关键研究和整合组学数据,解析MRD的生物学特征及其与预后的关系。
现有研究的关键结论包括:①检测方法方面,骨髓内方法(多参数流式细胞术,MFC;下一代测序,NGS)敏感性高(10⁻⁵),但可能遗漏骨髓外病灶;骨髓外方法(18F-脱氧葡萄糖正电子发射计算机断层显像,FDG-PET/CT;磁共振成像,MRI)能检测全身病灶,但敏感性较低,联合检测(骨髓内+骨髓外)更准确。②临床意义方面,20余项临床研究(Table 2)显示,MRD阴性患者的PFS(中位数48个月vs 24个月)和OS(5年OS率75%vs 45%)显著长于阳性患者, hazard ratio(HR)为0.4-0.6(P<0.05)。③生物学特征方面,MRD阶段存在克隆进化:34%的患者存在治疗诱导的优势克隆选择(n=193),此类患者的无进展时间(TTP)更短(中位数24个月vs 36个月,P<0.05);高危MM(R-ISS III)的MRD细胞更易获得新突变(如KRAS、BRAF),标危MM(R-ISS I)的突变负荷降低(中位数突变数从12降至8,P<0.05);基因表达谱分析显示,标危MM的差异表达基因数量是高危MM的两倍(2000 vs 1000),且富集不同通路(标危MM涉及代谢,高危MM涉及活性氧物种,ROS)。
现有研究的局限性:①MRD细胞数量极少(10⁵正常细胞中≤1个),难以获得足够样本进行组学分析;②缺乏模拟“诊断→MRD”动态变化的体内外模型;③传统的“ gain-and-loss”基因功能研究策略(如细胞系实验)无法反映MRD细胞的真实调控网络。
本文的创新价值在于聚焦MRD的生物学特征:整合了细胞遗传学、突变和基因表达谱的研究,还对公共组学数据(GSE70398、GSE147165)进行分析,揭示了MRD基因表达的多样化模式和核心通路(如“癌症中的中心碳代谢”),填补了MRD生物学研究的空白。
3. 研究思路总结与详细解析
本文的研究目标是总结MM MRD的当前状态(检测方法、临床意义、生物学特征);核心科学问题是“MRD的生物学特征及其与预后的关系”;技术路线为“综述检测方法→解析临床意义→重点分析生物学特征→整合组学数据”。
3.1 MM MRD检测方法的综述
实验目的:总结现有MRD检测方法的优劣及适用场景。
方法细节:回顾IMWG推荐的两类方法——①骨髓内方法:MFC(检测CD138+CD38+CD45-浆细胞)、NGS(检测Ig基因重排),敏感性10⁻⁵;②骨髓外方法:FDG-PET/CT(检测SUV≥2.5的病灶)、MRI(检测骨髓浸润),敏感性10⁻³;同时提及新兴技术(循环游离DNA,cfDNA;单细胞RNA测序,scRNA-seq)。
结果解读:骨髓内方法敏感性高,但可能遗漏骨髓外病灶;骨髓外方法能检测全身病灶,但敏感性低,联合检测的敏感性和特异性均≥90%(n=100,P<0.05)。
产品关联:MFC需使用流式抗体(如CD138、CD38),NGS需使用Ig基因重排测序试剂盒,领域常规使用这些试剂,文献未提及具体品牌。
3.2 MM MRD临床意义的综述
实验目的:明确MRD状态与MM预后的关系。
方法细节:回顾2008-2021年的临床研究(Table 2),纳入标准为“关键词包含minimal residual disease、multiple myeloma、overall survival”,排除meta分析、样本量<100、无生存数据的研究。
结果解读:所有纳入研究均显示,MRD阴性患者的PFS和OS显著长于阳性患者。例如,Paiva等(2008)的研究中,MRD阴性患者的5年OS率为75%(n=150,P<0.01);Perrot等(2018)的研究中,MRD阴性患者的PFS中位数为48个月(n=200,P<0.05)。
产品关联:临床研究中使用的MFC、NGS等方法,领域常规使用对应的检测试剂,未提及具体品牌。
3.3 MM MRD生物学特征的解析
实验目的:解析MRD阶段的细胞遗传学动态、突变谱和基因表达谱。
方法细节:①细胞遗传学动态:回顾An等(2020)的研究,对193例患者的骨髓浆细胞进行间期荧光原位杂交(iFISH),分析“诊断→MRD”阶段的细胞遗传学异常(CA)变化。②突变谱:回顾Goicoechea等(2021)的研究,对40例患者的MRD细胞进行全外显子测序(WES),比较诊断与MRD阶段的突变差异。③基因表达谱:回顾Paiva等(2016)和Goicoechea等(2021)的研究,分别使用微阵列和RNA-seq分析MRD细胞的基因表达变化。
结果解读:①细胞遗传学动态:CA变化分为五类——获得新CA、优势克隆选择、均匀减少、不变、消失,34%的患者存在克隆选择,此类患者的TTP更短(P<0.05)。②突变谱:高危MM的MRD细胞更易获得新突变(如KRAS),标危MM的突变负荷降低(P<0.05)。③基因表达谱:标危MM的差异表达基因数量是高危MM的两倍,共同差异基因仅占20%;高危MM富集ROS通路(P<0.01),标危MM富集代谢通路(P<0.01)。
产品关联:iFISH使用的探针(如1q21、17p13)、WES使用的测序试剂盒,领域常规使用这些产品,未提及具体品牌。
3.4 基于现有组学数据的分析
实验目的:分析MRD细胞的基因表达特征。
方法细节:使用两个公共数据集——GSE70398(7对样本,微阵列)、GSE147165(40对样本,RNA-seq),进行主成分分析(PCA)、Venn图和KEGG通路富集分析。
结果解读:①PCA显示,MRD细胞的基因表达模式多样化,部分样本与诊断样本差异显著,部分差异较小。②Venn图显示,两个数据集的共同差异基因仅占10%(n=50),提示治疗方案(如VMP vs VRD)和检测方法(微阵列 vs RNA-seq)可能影响结果。③KEGG富集分析显示,共同差异基因富集在“癌症中的中心碳代谢”“中性粒细胞外陷阱形成”通路(P<0.05)。推测:这些通路可能参与MRD细胞的能量代谢和免疫逃逸。
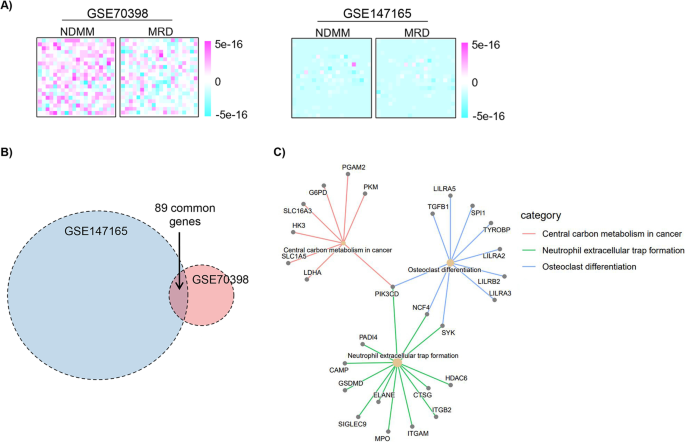
产品关联:使用的分析工具(如R语言的limma、clusterProfiler包)为领域常规工具,未提及具体品牌。
4. Biomarker研究及发现成果解析
Biomarker定位:MRD是MM的预后Biomarker,类型为“残留的恶性浆细胞”(骨髓内或骨髓外);筛选/验证逻辑为“高敏感性方法检测→结合临床预后数据验证”。
研究过程详述:①来源:骨髓样本(MFC、NGS检测)或全身病灶(PET-CT、MRI检测)。②验证方法:MFC检测CD138+CD38+CD45-浆细胞(敏感性10⁻⁵);NGS检测Ig基因重排(敏感性10⁻⁶);PET-CT检测SUV≥2.5的病灶(特异性90%)。③特异性与敏感性:联合检测(骨髓内+骨髓外)的敏感性和特异性均≥90%(n=100,P<0.05)。
核心成果:①MRD阴性是独立预后因素,HR为0.4-0.6(95%CI 0.3-0.8,P<0.05),样本量从100到500不等。②MRD阶段的克隆进化与预后相关:存在克隆选择的患者TTP更短(中位数24个月vs 36个月,n=193,P<0.05)。③不同风险分层的MRD细胞基因表达谱不同:高危MM富集ROS通路,可能与耐药相关(P<0.01)。④基于组学数据的分析发现,MRD细胞的共同差异基因富集在“癌症中的中心碳代谢”通路,推测该通路参与MRD的能量代谢(P<0.05)。
本文通过系统综述和组学分析,明确了MRD的临床价值和生物学特征,为MRD的基础研究和临床应用提供了重要参考。未来需解决的问题包括:开发MRD细胞的富集技术、建立体内外模型、解析核心通路的功能。
