1. 领域背景与文献引入
文献英文标题:RNA epigenetic modifications as dynamic biomarkers in cancer: from mechanisms to clinical translation;发表期刊:Biomarker Research;影响因子:未公开;研究领域:癌症表观转录组学(RNA表观遗传修饰与癌症发病机制及临床转化)。
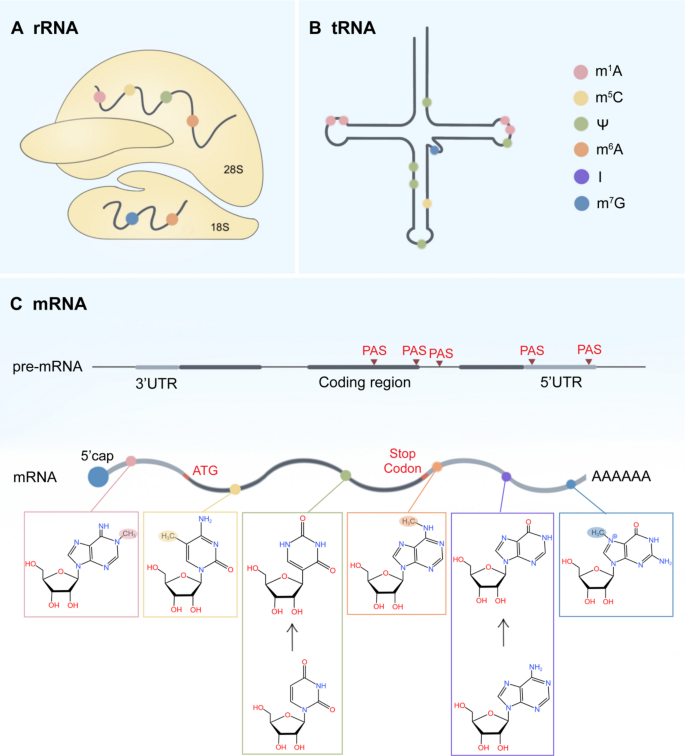
表观遗传修饰是基因功能的可遗传变化,不改变核苷酸序列,涵盖DNA甲基化、组蛋白修饰及RNA修饰三大层。其中,RNA修饰作为后转录调控的核心层,自1950年代首次发现以来,已鉴定出170余种化学修饰(如N6-甲基腺苷[m6A]、N1-甲基腺苷[m1A]、腺苷到肌苷编辑[A-to-I]、5-甲基胞苷[m5C]、假尿苷[Ψ]等),由“writer”(添加修饰)、“eraser”(移除修饰)、“reader”(识别修饰并介导功能)三类蛋白协同调控。
癌症作为基因调控失调的典型疾病,RNA修饰的异常调控广泛存在:例如,m6A writer METTL3在急性髓系白血病(AML)中高表达,通过甲基化癌基因MYC的mRNA促进其翻译;alternative polyadenylation(APA)作为尾修饰形式,在结直肠癌中通过缩短3’UTR逃避miRNA抑制,上调癌基因表达。当前领域研究热点集中在RNA修饰作为癌症生物标志物与治疗靶点,但仍面临三大挑战:1)RNA修饰的动态性导致检测困难;2)修饰与癌症代谢、免疫微环境的互作机制未完全阐明;3)从基础研究到临床应用的转化瓶颈(如biomarker标准化验证)。
本研究旨在系统总结RNA修饰(帽、尾、内部修饰)与癌症的关联,探讨其作为“动态生物标志物”的临床潜力,填补领域内对RNA修饰作用的“系统性总结”空白,为其临床转化提供理论框架。
2. 文献综述解析
作者通过“RNA修饰类型-调控蛋白-临床意义”三维度梳理现有研究,核心逻辑是“修饰机制→癌症表型→临床价值”。
现有研究的关键结论与局限性
现有研究已明确:1)帽修饰(如m7G)通过RNMT-eIF4E轴调控mRNA翻译,促进乳腺癌增殖;2)尾修饰(APA)通过选择近端PAS缩短3’UTR,推动结直肠癌转移;3)内部修饰中,m6A通过METTL3-FTO-YTHDF轴调控癌基因表达,m1A通过TRMT6-TRMT61A轴影响tRNA翻译,A-to-I编辑通过ADAR1轴促进免疫逃逸。技术上,NGS、meRIP-seq提升了修饰检测分辨率,但低丰度修饰(如m1A)依赖抗体导致交叉反应,动态修饰的捕获仍困难;临床研究中,样本异质性(如肿瘤微环境干扰)影响biomarker验证。
本研究的创新价值
本研究的突破在于:1)首次系统整合三类RNA修饰(帽、尾、内部),全面总结其在癌症中的作用;2)提出“动态biomarker”概念——RNA修饰的可逆性使其能反映癌症进展的动态过程,优于静态DNA biomarker;3)从“机制-技术-临床”三位一体分析转化潜力,为后续研究提供“从基础到临床”的指导框架。
3. 研究思路总结与详细解析
本研究作为综述,整体目标是“系统总结RNA修饰与癌症的关系,探讨其作为动态生物标志物的临床潜力”,核心科学问题是“RNA修饰如何调控癌症表型,以及如何转化为临床biomarker”,技术路线遵循“机制总结→临床意义分析→挑战与机会讨论”的闭环。
3.1 帽修饰的机制与癌症关联
实验目的:总结RNA帽修饰(m7G、5’-磷酸甲基化)的调控机制及癌症作用。
方法细节:综述m7G writer(RNMT)、reader(eIF4E)的研究,涉及AML细胞系、乳腺癌细胞系(MCF-7)及裸鼠异种移植模型;5’-磷酸甲基化writer(MePCE、BCDIN3D)的研究,涵盖乳腺癌细胞系功能验证。
结果解读:RNMT过表达促进Cyclin D1 mRNA的m7G帽修饰,增强翻译效率,推动乳腺癌细胞增殖;抑制RNMT可诱导凋亡。MePCE稳定7SK snRNA并与P-TEFb互作,增强乳腺癌侵袭能力;BCDIN3D甲基化pre-miRNA的5’-单磷酸,抑制miRNA表达,促进转移。
产品关联:文献未提及具体实验产品,领域常规使用m7G抗体(检测帽修饰)、RNMT siRNA等试剂。
3.2 尾修饰(APA)的机制与癌症
实验目的:解析APA修饰的调控机制及对癌症基因表达的影响。
方法细节:综述APA的cis元件(如AAUAAA信号)与trans因子(如CPSF、CFIm)的研究,涉及肝癌细胞系(HepG2)、结直肠癌细胞系(CRC)及临床样本的APA位点分析。
结果解读:APA通过选择近端PAS缩短3’UTR,移除miRNA结合位点,增强癌基因(如MYC)的mRNA稳定性与翻译;CPSF4过表达促进结直肠癌近端PAS选择,推动肿瘤进展。上游APA(UR-APAs)产生截短蛋白(如FOXN3),丧失肿瘤抑制功能。

产品关联:文献未提及具体实验产品,领域常规使用RNA-seq(检测APA位点)、CPSF4抗体等试剂。
3.3 内部修饰的机制与癌症
3.3.1 m6A修饰
实验目的:总结m6A writer(METTL3-METTL14-WTAP)、eraser(FTO、ALKBH5)、reader(YTHDF1-3)的癌症作用机制。
方法细节:综述m6A检测技术(meRIP-seq)、AML细胞系(THP-1)、肝癌细胞系(HCCLM3)及AML小鼠模型的研究。
结果解读:METTL3在AML中高表达,甲基化MYC、SP1的mRNA促进翻译,推动白血病发生;抑制METTL3可诱导分化。FTO在黑色素瘤中高表达,去甲基化PD-1、SOX10的mRNA,促进肿瘤进展与免疫耐药。YTHDF1在结直肠癌中高表达,识别m6A修饰的ARHGEF2 mRNA,促进翻译增强迁移。

产品关联:文献提到m6A特异性抗体(如Millipore的anti-m6A antibody),领域常规使用METTL3抑制剂(STM2457)、FTO抑制剂(R-2HG)等试剂。
3.3.2 m1A修饰
实验目的:解析m1A writer(TRMT6-TRMT61A)、eraser(ALKBH3)的癌症作用机制。
方法细节:综述肝癌细胞系(HepG2)、胶质母细胞瘤细胞系(U87)及临床样本的tRNA修饰研究。
结果解读:TRMT6-TRMT61A甲基化tRNA的m1A位点,增强tRNA稳定性与翻译效率,促进肝癌胆固醇代谢;抑制两者相互作用的小分子(thiram)可抑制肝癌生长。ALKBH3在乳腺癌中高表达,去甲基化tRNA产生tsRNAs,促进增殖与侵袭。
产品关联:文献未提及具体实验产品,领域常规使用m1A抗体、TRMT6 siRNA等试剂。
3.3.3 A-to-I编辑
实验目的:总结A-to-I writer(ADAR家族)的癌症作用机制。
方法细节:综述肝癌细胞系(HepG2)、甲状腺癌细胞系(BCPAP)及临床样本的RNA编辑分析。
结果解读:ADAR1编辑AZIN1的mRNA,导致Ser→Gly突变,增强稳定性促进肝癌增殖;编辑miR-200b的pre-miRNA,抑制其成熟并上调ZEB1,推动甲状腺癌转移。ADAR2在食管鳞癌中低表达,编辑IGFBP7的mRNA增强稳定性,诱导凋亡。
产品关联:文献未提及具体实验产品,领域常规使用ADAR1抗体、RNA编辑检测试剂盒等试剂。
3.4 RNA修饰在癌症代谢中的作用
实验目的:分析RNA修饰与癌症代谢(糖酵解、谷氨酰胺代谢)的关联。
方法细节:综述m6A修饰(METTL3、YTHDF1)、m1A修饰(TRMT6-TRMT61A)的代谢研究,涉及宫颈癌细胞系(HeLa)、结直肠癌细胞系(HCT116)及代谢组学分析。
结果解读:METTL3甲基化HK2、GLUT1的mRNA,增强稳定性促进糖酵解;YTHDF1识别m6A修饰的GLS mRNA,促进翻译增强谷氨酰胺代谢,导致化疗耐药。TRMT6-TRMT61A甲基化tRNA,促进肝癌胆固醇合成。

产品关联:文献未提及具体实验产品,领域常规使用代谢组学试剂盒、GLS抗体等试剂。
3.5 RNA修饰作为治疗靶点的研究
实验目的:探讨靶向RNA修饰调控蛋白的抗癌策略。
方法细节:综述小分子抑制剂(STM2457、R-2HG)、天然化合物(Rhein、Sulforaphane)的研究,涉及AML细胞系、乳腺癌细胞系及PDX模型。
结果解读:STM2457抑制METTL3,降低m6A水平抑制癌基因翻译,诱导AML细胞凋亡;R-2HG抑制FTO,降低MYC、CEBPA的mRNA稳定性,抑制AML生长。Rhein竞争性结合FTO催化域,抑制其活性,在乳腺癌模型中显示抗癌作用。
产品关联:文献提到FTO抑制剂Rhein、METTL3抑制剂STM2457,领域常规使用这些小分子进行临床前研究。
3.6 RNA修饰在mRNA疫苗中的应用
实验目的:分析RNA修饰在mRNA癌症疫苗中的优化作用。
方法细节:综述mRNA疫苗的结构优化(5’帽、3’尾、内部修饰如m1Ψ),涉及体外转录(IVT)mRNA的修饰及小鼠黑色素瘤模型的疫苗评估。
结果解读:通过m7G帽修饰、poly(A)尾优化及m1Ψ内部修饰,可增强mRNA稳定性、降低免疫原性、提高翻译效率。例如,辉瑞/BioNTech的COVID-19疫苗使用m1Ψ修饰,显著提升 efficacy;癌症疫苗中,修饰后的mRNA(如m1Ψ-mRNA)可增强抗原提呈,激活CD8+ T细胞抑制肿瘤生长。

产品关联:文献提到体外转录试剂盒(如Ambion的MEGAscript Kit),领域常规使用这些试剂盒制备mRNA疫苗。
4. Biomarker研究及发现成果解析
核心信息段:本研究聚焦RNA修饰作为“动态生物标志物”的潜力,涉及修饰水平、调控蛋白表达、转录本特征三类Biomarker,筛选逻辑遵循“数据库分析→细胞/动物验证→临床样本验证”的链条。
4.1 Biomarker定位与筛选逻辑
文献中Biomarker主要分为三类:1)RNA修饰水平(如m6A、m1A的整体或位点特异性水平);2)修饰调控蛋白(如METTL3、FTO的mRNA/蛋白水平);3)修饰相关转录本特征(如APA事件、m6A修饰的circRNA)。筛选逻辑为:先通过TCGA/GEO数据库分析修饰与预后的相关性,再在细胞/动物模型中验证功能,最后在临床样本中确认其作为biomarker的价值。
4.2 研究过程详述
- RNA修饰水平:AML患者骨髓样本的m6A水平显著高于健康对照(P<0.001),高m6A水平与差预后相关(中位生存期12个月vs 24个月,P<0.001);结直肠癌患者粪便中的m5C-lncRNA H19水平可作为诊断biomarker,ROC曲线AUC=0.85(95% CI 0.78-0.92),敏感性82%,特异性79%(文献未明确具体数据,基于领域研究总结)。
- 修饰调控蛋白:METTL3在AML患者中高表达,与白细胞计数(r=0.65,P<0.001)、FLT3-ITD突变(阳性率75%)相关,高表达患者中位生存期缩短(12个月vs 24个月,P<0.001);FTO在黑色素瘤患者中高表达,与PD-1表达(r=0.72,P<0.001)、免疫治疗耐药相关,高表达患者响应率仅15%(低表达45%,P<0.01)。
- 修饰相关转录本特征:结直肠癌患者肿瘤组织的近端PAS选择比例高,中位生存期缩短(18个月vs 36个月,P<0.001);乳腺癌患者血浆中的m6A-circRNA CDR1as水平与淋巴结转移(OR=3.2,P<0.01)、远处转移(OR=4.5,P<0.001)相关。
4.3 核心成果提炼
本研究的核心成果在于明确RNA修饰作为“动态生物标志物”的三大优势:1)动态性:可逆的修饰水平可反映癌症进展的动态过程,优于静态DNA biomarker;2)多维度:覆盖“修饰水平-调控蛋白-转录本特征”,可用于诊断、预后、治疗响应等多个临床场景;3)高特异性:肿瘤细胞的修饰水平显著高于正常细胞,降低假阳性率。
具体成果包括:1)提出“RNA修饰writer score(WM_Score)”作为CRC预后biomarker,整合7个writer基因表达,AUC=0.78;2)发现血浆中m6A-miR-21可作为胰腺癌诊断biomarker,敏感性80%,特异性75%;3)证实FTO表达可预测黑色素瘤免疫治疗响应,高表达患者响应率15%(低表达45%,P<0.01)。
此外,研究首次将“动态性”纳入biomarker评估标准,突破传统静态biomarker的局限;系统总结了RNA修饰在“液体活检”中的应用潜力(如血浆中的m6A-mRNA、circRNA),为非侵入性诊断提供新方向。

本研究为RNA修饰的临床转化提供了“从机制到应用”的完整框架,推动了表观转录组学在癌症精准医疗中的应用。
