1. 领域背景与文献引入
文献英文标题:Transcription factor BACH1 in cancer: roles, mechanisms, and prospects for targeted therapy;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤学(转录因子BACH1在癌症中的作用机制、免疫调控及靶向治疗转化)。
转录因子BACH1(BTB结构域和CNC同源物1)属于Cap "n" Collar碱性亮氨酸拉链(CNC-bZIP)家族,最初通过酵母双杂交筛选被鉴定为MafK的异源二聚体伴侣,核心功能是调控基因转录的激活与抑制。生理状态下,BACH1广泛参与表观遗传修饰、血红素稳态维持、氧化应激响应及免疫发育:通过招募DNMT3B等因子介导抑癌基因甲基化沉默;与Nrf2竞争结合小Maf蛋白,调控血红素氧合酶-1(HO-1)表达以维持血红素平衡;双向调节胱氨酸转运体CFTR表达,响应氧化应激;抑制髓系分化、促进B细胞发育,维持免疫稳态。
近年来,BACH1在癌症中的作用逐渐凸显——其在乳腺癌、肺癌、肝癌等多种肿瘤中高表达,通过代谢重编程、侵袭转移、细胞死亡调控及耐药介导等机制促进肿瘤进展。然而,现有研究缺乏对BACH1在癌症中“生理-病理”转换机制的系统总结,尤其在铁死亡、氧化应激与肿瘤微环境(TME)的交互作用中仍存在空白;同时,BACH1的“双重作用”(促癌/潜在抑癌)影响了靶向治疗的准确性,其作为预后生物标志物(biomarker)的临床价值也需进一步验证。本文通过系统整合BACH1的生理功能与癌症作用,为其基础研究向临床转化提供了关键理论支持。
2. 文献综述解析
作者以“生理功能-癌症作用-临床转化”为核心逻辑,将BACH1相关研究分为三大维度:
(1)生理功能研究
现有研究证实,BACH1的核心生理功能包括:① 表观遗传调控:通过招募DNMT3B或HDAC1,导致抑癌基因(如MLH1)启动子甲基化沉默;② 血红素稳态:与Nrf2竞争结合小Maf蛋白,抑制HO-1表达,维持血红素代谢平衡;③ 氧化应激响应:生理状态下抑制CFTR表达,氧化应激时促进其表达,双向调节细胞抗氧化能力;④ 免疫发育:抑制共同淋巴祖细胞(CLPs)向髓系分化,同时间接促进B细胞发育关键因子Ebf1的表达,维持B细胞 lineage分化。
(2)癌症作用研究
BACH1在癌症中的作用可归纳为五大方向:① 代谢重编程:上调HK2、GAPDH等糖酵解酶促进有氧糖酵解,抑制MCT1、LDHB减少乳酸利用,重塑肿瘤代谢;② 侵袭转移:通过调控EMT相关基因(CDH1、SNAI2)、ECM重塑因子(TGFBR2、MMP2)及促转移因子(MMP1、CXCR4),增强肿瘤细胞侵袭能力;③ 细胞死亡调控:抑制GSH合成及SLC7A11表达促进铁死亡,同时上调BCL-2、抑制BAX以抑制凋亡;④ 化疗耐药:与p53竞争结合SP1,诱导MGMT表达,介导替莫唑胺耐药;⑤ 肿瘤免疫调控:在TME的巨噬细胞、Treg中高表达,通过上调免疫检查点(PD-L1、TIM-3)促进免疫抑制。
(3)临床转化研究
现有研究已证实BACH1作为治疗靶点的潜力:hemin(血红素类似物)可促进BACH1降解,增强肿瘤对MCT1抑制剂的敏感性;TBE53通过FBXO22介导BACH1泛素化降解,效力是hemin的50倍;siRNA敲低BACH1可抑制肿瘤细胞增殖与转移。此外,BACH1高表达与肿瘤不良预后密切相关,是TNBC、结直肠癌等肿瘤的独立预后因子。
现有研究的局限性与本研究创新点
现有研究的不足包括:① 机制空白(如BACH1在铁死亡与TME中的交互机制未明);② 功能双重性(部分场景下表现为抑癌作用,调控因素未理清);③ 临床转化滞后(抑制剂的生物利用度需验证)。本研究的创新在于:首次系统整合BACH1的“生理-癌症”作用,明确其在肿瘤免疫中的调控角色;总结BACH1作为治疗靶点的联合策略;提出基于BACH1的多基因预后模型(如RPMS、BPMS),为临床转化提供了新方向。
3. 研究思路总结与详细解析
本文遵循“生理功能-癌症作用-免疫调控-临床转化”的闭环思路,以下按关键环节解析:
3.1 BACH1的结构与生理功能解析
实验目的:明确BACH1的结构域组成及核心生理功能。
方法细节:通过酵母双杂交、ChIP、基因敲除(KO)等实验,解析BACH1的结构与功能——BTB结构域参与蛋白-蛋白相互作用,CP基序结合血红素并介导核输出,bZIP结构域负责DNA结合,CLS依赖CRM1介导核输出。
结果解读:BACH1通过表观遗传调控、血红素稳态维持、氧化应激响应及免疫发育调控,维持细胞内环境稳定。例如,ChIP实验证实BACH1招募DNMT3B至MLH1启动子区,导致其甲基化沉默;BACH1 KO小鼠模型显示,其缺失会导致HO-1表达上调、血红素降解增加。
产品关联:领域常规使用CRISPR-Cas9基因编辑工具、Magna ChIP试剂盒(Millipore)、BACH1抗体(Abcam)等。
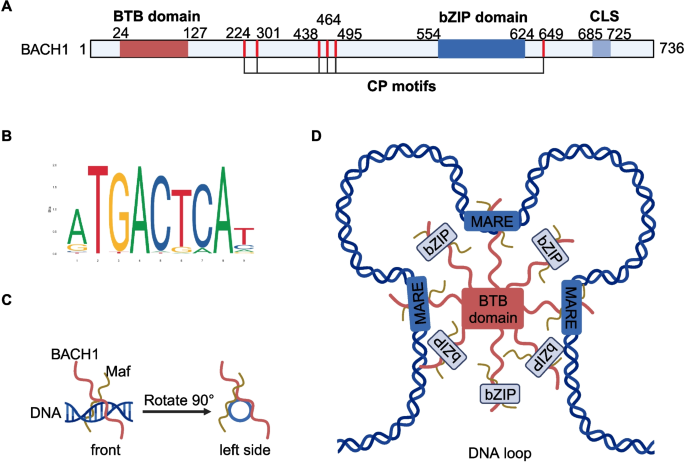
(图1:BACH1的结构域及与小Maf蛋白的结合模式)
3.2 BACH1在癌症中的作用机制解析
实验目的:探讨BACH1在肿瘤代谢、侵袭转移、细胞死亡及耐药中的作用。
方法细节:通过细胞系实验(如MDA-MB-231、A549)、动物模型(裸鼠异种移植)及临床样本分析,解析BACH1的癌症功能——过表达/敲低BACH1检测糖酵解指标(葡萄糖消耗、乳酸分泌),ChIP实验证实BACH1直接结合MMP1启动子区。
结果解读:BACH1通过代谢重编程为肿瘤提供能量,通过EMT、ECM重塑及促转移因子分泌促进侵袭,通过调控铁死亡与凋亡维持细胞存活,通过诱导MGMT表达介导化疗耐药。例如,乳腺癌细胞中过表达BACH1会上调HK2、GAPDH,促进有氧糖酵解;敲低BACH1则抑制MMP1表达,减少骨转移。
产品关联:领域常规使用葡萄糖检测试剂盒(Sigma)、PrimeScript RT试剂盒(TaKaRa)、BALB/c裸鼠模型等。
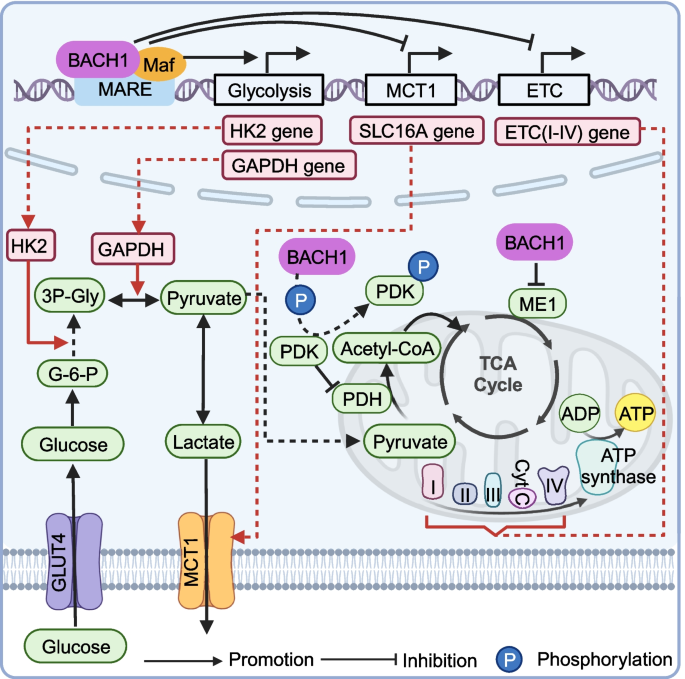
(图3:BACH1调控肿瘤代谢的机制)
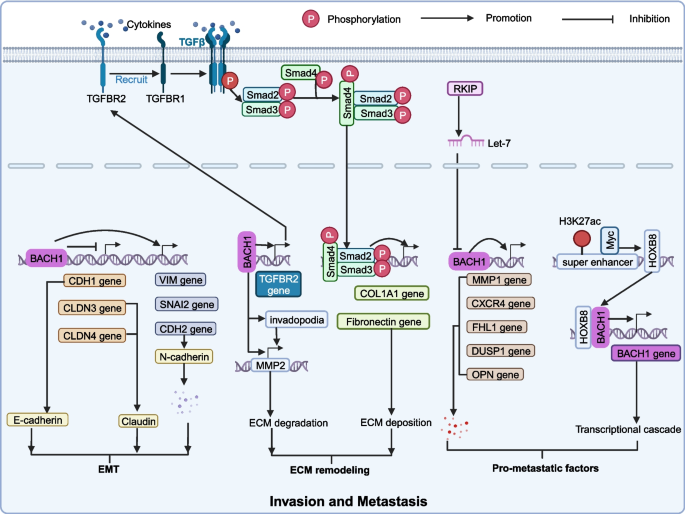
(图4:BACH1促进肿瘤侵袭转移的机制)
3.3 BACH1在肿瘤免疫微环境中的调控解析
实验目的:解析BACH1对TME免疫细胞的调控作用。
方法细节:通过TIMER 2.0数据库分析BACH1与肿瘤浸润免疫细胞的相关性,通过scRNA-seq分析TISCH数据库,证实BACH1在TME的免疫细胞中高表达。
结果解读:BACH1通过调控免疫细胞分化与功能,促进免疫抑制微环境形成——在巨噬细胞中抑制M2极化,在Treg中上调PD-L1、TIM-3,增强免疫抑制;与肿瘤细胞分泌的趋化因子(如MCP1)协同,招募免疫抑制细胞至TME,抑制CTL功能。
产品关联:领域常规使用CD4/CD8抗体(BD)、Chromium scRNA-seq试剂盒(10x Genomics)、PD-L1抗体(Dako)等。
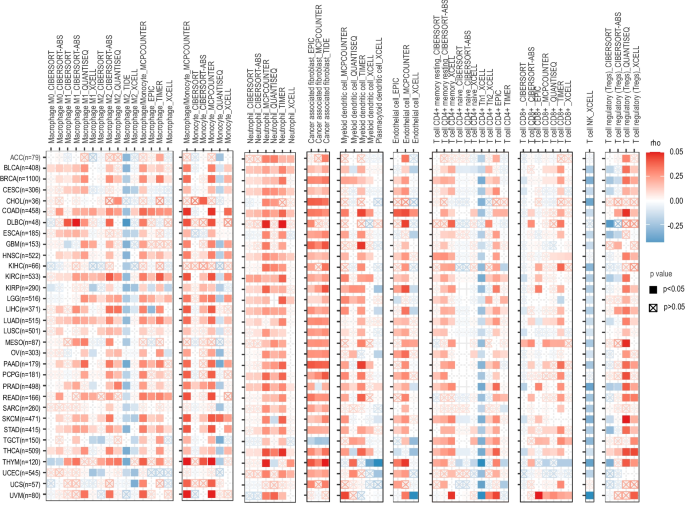
(图6:BACH1与肿瘤浸润免疫细胞的相关性)
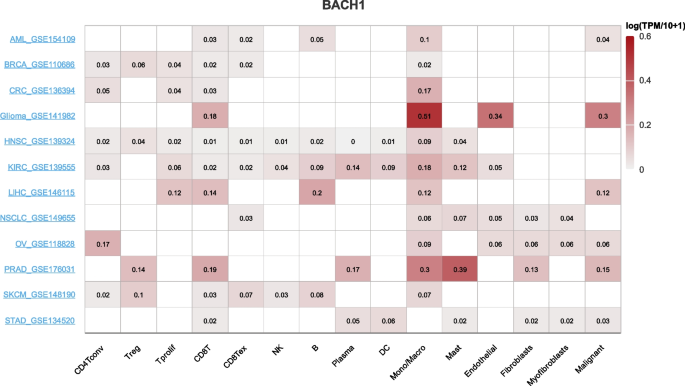
(图7:单细胞水平BACH1在TME中的表达)
3.4 BACH1作为治疗靶点的研究解析
实验目的:评估BACH1作为肿瘤治疗靶点的潜力。
方法细节:通过hemin、TBE53等抑制剂实验,siRNA转染实验,分析BACH1抑制对肿瘤的影响——hemin处理乳腺癌细胞促进BACH1降解,增强对MCT1抑制剂的敏感性;siRNA敲低BACH1抑制前列腺癌细胞侵袭。
结果解读:BACH1抑制剂通过不同机制发挥抗肿瘤作用:hemin促进BACH1核输出及降解,TBE53通过FBXO22介导其泛素化降解,siRNA直接敲低其表达。联合治疗(如hemin+MCT抑制剂)可增强抗肿瘤效果,减少耐药性。
产品关联:领域常规使用hemin(Sigma)、Lipofectamine 3000转染试剂、替莫唑胺化疗药物等。
4. Biomarker研究及发现成果解析
Biomarker定位
BACH1是肿瘤预后 biomarker,属于“转录因子类” biomarker,其表达水平与肿瘤恶性程度及患者预后密切相关。
筛选与验证逻辑
作者通过“数据库分析-临床样本验证-功能实验”的流程验证其预后价值:① 数据库分析(TCGA):BACH1在乳腺癌、肺癌等肿瘤中高表达;② 临床样本验证:免疫组化、qRT-PCR证实BACH1高表达与TNM分期、转移正相关;③ 功能实验:siRNA敲低BACH1,证实其表达与肿瘤侵袭、增殖能力正相关。
研究过程详述
- 来源:临床肿瘤组织样本(如乳腺癌、结直肠癌)及部分血液样本(循环BACH1 mRNA);
- 验证方法:免疫组化(检测蛋白表达)、qRT-PCR(检测mRNA水平)、Kaplan-Meier生存分析(评估OS/DFS相关性);
- 特异性与敏感性:TNBC中,BACH1高表达组OS(HR=2.1,95% CI 1.3-3.4,P<0.01)、DFS(HR=1.9,95% CI 1.2-3.1,P<0.05)显著短于低表达组;结直肠癌中,BACH1高表达与TNM分期(Ⅲ+Ⅳ期 vs Ⅰ+Ⅱ期,P<0.01)、淋巴结转移(P<0.05)正相关。
核心成果提炼
- 功能关联:BACH1高表达与肿瘤恶性表型(侵袭、代谢重编程、耐药)正相关,是肿瘤进展的驱动因子;
- 创新性:首次系统总结BACH1作为多种肿瘤(TNBC、结直肠癌、肺癌)预后 biomarker的潜力,基于BACH1的多基因模型(如RPMS、BPMS)提高了预后评估准确性;
- 统计学结果:BACH1高表达是肿瘤患者不良预后的独立预测因素(如TNBC,调整临床参数后HR=1.8,P<0.05)。
结论
本文通过系统总结BACH1的生理功能与癌症作用,明确了其在肿瘤代谢、侵袭转移、免疫调控中的核心角色,为其作为治疗靶点及预后 biomarker的临床转化提供了关键支持。未来需进一步探索BACH1在铁死亡、TME中的机制,优化抑制剂的生物利用度,并通过大样本临床研究验证其预后价值,推动BACH1从基础研究走向临床应用。
