1. 领域背景与文献引入
文献英文标题:The war between the immune system and the tumor - using immune biomarkers as tracers;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫学/肿瘤免疫治疗。
肿瘤免疫治疗是恶性肿瘤药物治疗的“第三次革命”,通过激活患者自身免疫系统识别并清除肿瘤细胞,已成为晚期肿瘤的核心治疗手段之一。近年来,免疫检查点抑制剂(ICIs,如抗PD-1/PD-L1、抗CTLA-4)的临床应用显著延长了部分患者的生存期,但仍面临三大挑战:仅20%-40%的患者对免疫治疗有响应、治疗后易出现耐药、约30%的患者会发生免疫相关不良事件(IRAEs)。这些问题的核心在于缺乏有效的生物标志物来预测疗效、监测免疫反应及指导个体化治疗。
当前领域的研究热点集中于免疫生物标志物——即能客观反映肿瘤免疫状态的分子、细胞或功能指标,其不仅能预测免疫治疗的疗效和毒性,还能揭示肿瘤免疫逃逸的机制。然而,现有研究多聚焦于单一环节(如T细胞耗竭)或单一标志物(如PD-L1),缺乏对肿瘤免疫周期的系统整合,且代谢、微生物、运动等新兴因素对肿瘤免疫的调节及相关生物标志物尚未被充分阐明。
本文献的研究初衷是系统综述肿瘤免疫过程中的免疫生物标志物,涵盖肿瘤抗原表达、固有免疫、适应性免疫等核心环节,同时分析代谢、微生物、运动等新兴因素的影响,总结基于免疫生物标志物的临床治疗策略,为精准免疫治疗提供全面的理论依据和临床指导。
2. 文献综述解析
作者对现有研究的分类维度主要分为三个层次:肿瘤免疫周期的核心生物标志物(抗原表达、固有免疫、适应性免疫)、新兴因素的调节及生物标志物(代谢、微生物、运动)、临床应用中的生物标志物及策略(肿瘤疫苗、过继细胞治疗、免疫检查点治疗)。
现有研究的关键结论与局限性
现有研究已明确:(1)肿瘤抗原是免疫反应的起点——肿瘤特异性抗原(TSA)由基因突变产生,具有高特异性和免疫原性,是免疫治疗的理想靶点;肿瘤相关抗原(TAA)因异常表达于肿瘤细胞(如HER-2、CEA),但因免疫耐受免疫原性较弱。(2)固有免疫细胞通过受体平衡调节免疫反应——NK细胞的CD56dim亚型具有细胞毒性,其激活状态由NKG2D(激活)与NKG2A(抑制)受体平衡决定;巨噬细胞分为M1型(促炎杀瘤,高表达iNOS、CD80)和M2型(抑炎促瘤,高表达Arg-1、CD206),表型转换直接影响肿瘤免疫微环境(TME)。(3)适应性免疫的核心是T细胞的激活与耗竭——T细胞需要TCR-pMHC(第一信号)、CD28-B7(第二信号)、IL-2(第三信号)协同激活;持续的肿瘤抗原刺激会导致T细胞耗竭,表现为PD-1、TIM-3等抑制性受体高表达,功能丧失。(4)新兴因素显著影响肿瘤免疫——肿瘤细胞的“Warburg效应”(厌氧 glycolysis)与免疫细胞争夺葡萄糖,抑制T细胞功能;肠道微生物通过短链脂肪酸等代谢产物促进树突状细胞(DC)成熟;运动通过肌因子(如IL-15)增强NK细胞和CD8+T细胞的增殖能力。
现有研究的局限性也同样突出:(1)部分生物标志物(如TAA)的特异性不足,易引发自身免疫反应;(2)新兴因素的作用机制未完全阐明(如肠道微生物与T细胞的具体互作通路),临床转化困难;(3)多数生物标志物的临床验证样本量小,缺乏多中心、大样本的疗效验证;(4)免疫治疗的耐药机制复杂,单一生物标志物难以全面预测。
文献的创新价值
本文献的核心创新在于系统整合了肿瘤免疫周期的生物标志物网络:从肿瘤抗原的“启动”,到固有免疫细胞的“第一道防线”,再到适应性免疫的“精准打击”,最后延伸至代谢、微生物等“外围调节因素”,形成了完整的肿瘤免疫生物标志物图谱。同时,文献首次从临床应用角度总结了生物标志物的组合策略(如TMB+PD-L1+肠道微生物多样性),为解决免疫治疗响应率低的问题提供了新思路。
3. 研究思路总结与详细解析
本研究为系统性综述,核心目标是梳理肿瘤免疫中免疫生物标志物的作用机制及临床应用,核心科学问题是“免疫生物标志物如何串联肿瘤免疫的各个环节,以及如何指导精准免疫治疗”。技术路线遵循“基础机制-新兴因素-临床应用”的逻辑闭环:先解析肿瘤免疫周期的核心生物标志物,再拓展至代谢、微生物等新兴调节因素,最后总结基于生物标志物的临床治疗策略。
3.1 肿瘤抗原与免疫原性解析
实验目的:探讨肿瘤抗原(TSA、TAA)作为生物标志物的作用及免疫原性差异。
方法细节:回顾经典研究中TSA的鉴定流程(全外显子测序WES筛选突变→预测TSA→免疫组化IHC验证表达),及TAA的临床检测(ELISA检测血清CEA、HER-2水平)。
结果解读:TSA由肿瘤细胞的基因突变产生(如TP53、KRAS突变),TMB越高(肿瘤突变负荷),TSA数量越多,免疫原性越强;TAA因异常表达于肿瘤细胞(如HER-2在乳腺癌中的过表达),但因正常组织也有低表达,易引发免疫耐受。图1展示了肿瘤抗原的分类及免疫原性差异(
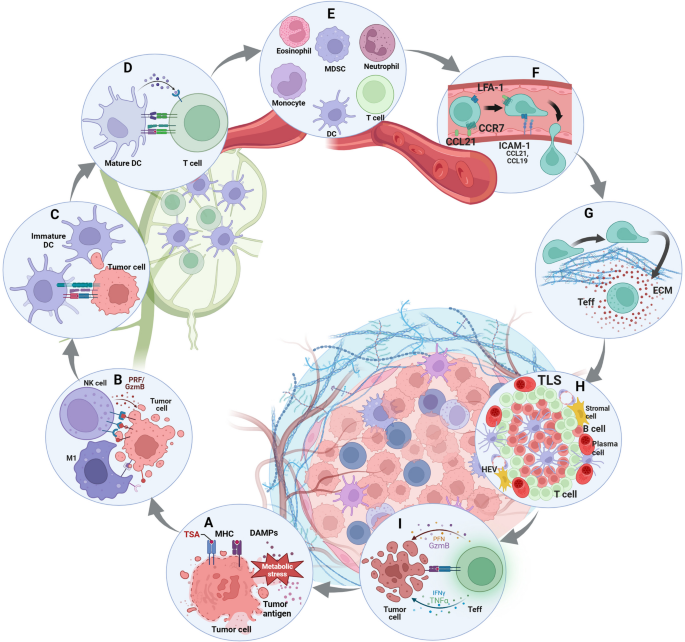
)。
产品关联:文献未提及具体实验产品,领域常规使用全外显子测序试剂盒(如Illumina TruSight Oncology)检测TMB、免疫组化试剂盒(如Dako PD-L1 IHC 22C3)检测肿瘤抗原表达、ELISA试剂盒(如R&D Systems CEA ELISA)检测血清TAA水平。
3.2 固有免疫细胞生物标志物解析
实验目的:解析NK细胞、巨噬细胞的生物标志物及功能调节机制。
方法细节:回顾NK细胞的表面标志物(CD56、CD16)及受体(NKG2A、NKG2D)的流式分析,及巨噬细胞表型(M1/M2)的免疫组化检测。
结果解读:NK细胞的CD56dim亚型(高表达CD16)具有强细胞毒性,通过“缺失自我”机制(肿瘤细胞MHCI低表达)识别肿瘤;NKG2A(抑制受体)与HLA-E结合会抑制NK细胞功能。巨噬细胞的M1型通过iNOS产生NO杀瘤,M2型通过Arg-1消耗精氨酸抑制T细胞功能,TME中的细胞因子(如TGF-β)会促进M2型极化。图2展示了固有免疫细胞的受体平衡(
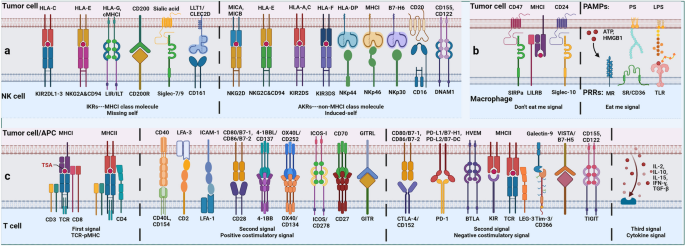
)。
产品关联:文献未提及具体实验产品,领域常规使用流式细胞仪(如BD FACSVerse)检测NK细胞表面标志物、免疫组化试剂盒(如Abcam iNOS抗体)检测巨噬细胞表型。
3.3 适应性免疫细胞生物标志物解析
实验目的:探讨T细胞激活与耗竭的生物标志物及机制。
方法细节:回顾T细胞激活的“三信号模型”(TCR-pMHC、CD28-B7、IL-2),及耗竭标志物(PD-1、TIM-3)的流式检测与基因分析(qRT-PCR检测TOX、PDCD1)。
结果解读:T细胞的有效激活需要三信号协同,缺乏共刺激信号(如CD28缺失)会导致T细胞无反应性;持续的肿瘤抗原刺激会诱导T细胞耗竭,表现为PD-1、TIM-3高表达,转录因子TOX调控耗竭表型的维持。图3展示了T细胞激活与耗竭的机制(
)。
产品关联:文献未提及具体实验产品,领域常规使用流式抗体(如BioLegend CD28抗体)检测激活标志物、qRT-PCR试剂盒(如Qiagen TOX引物)检测耗竭基因。
3.4 新兴因素对肿瘤免疫的调节
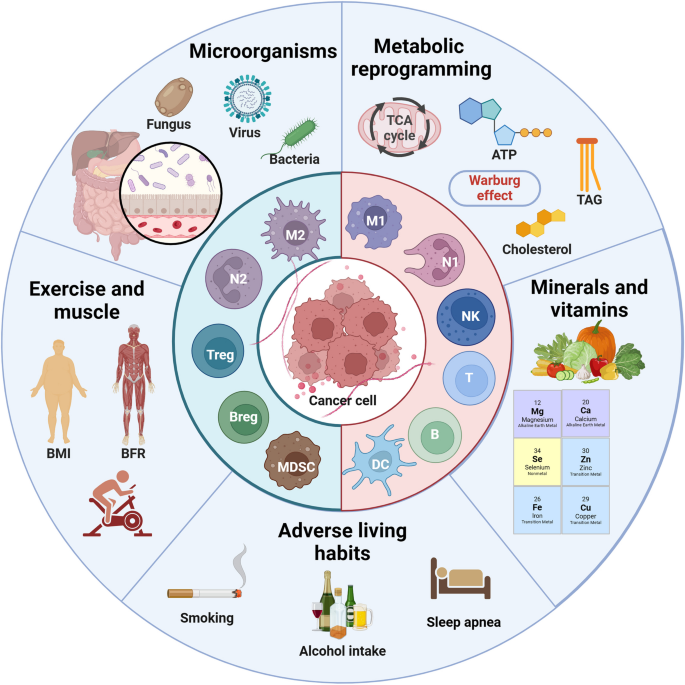
实验目的:分析代谢、微生物、运动等新兴因素的生物标志物及免疫调节作用。
方法细节:回顾代谢组学检测肿瘤代谢产物(如IDO催化的色氨酸代谢)、16S rRNA测序检测肠道微生物组成、ELISA检测运动相关肌因子(IL-15)的研究。
结果解读:肿瘤细胞的IDO过表达会催化色氨酸转化为犬尿氨酸,抑制T细胞增殖;肠道微生物多样性高(Shannon指数>6)的患者,DC成熟度更高,T细胞反应更强;运动后血清IL-15水平升高(>10 pg/mL),可促进CD8+T细胞和NK细胞的增殖。图4展示了新兴因素的调节机制(
)。
产品关联:文献未提及具体实验产品,领域常规使用代谢组学试剂盒(如Agilent Metabolomics Bundle)检测代谢产物、16S rRNA测序试剂盒(如Illumina 16S Metagenomics)分析微生物、ELISA试剂盒(如R&D Systems IL-15 ELISA)检测肌因子。
3.5 临床应用中的免疫生物标志物
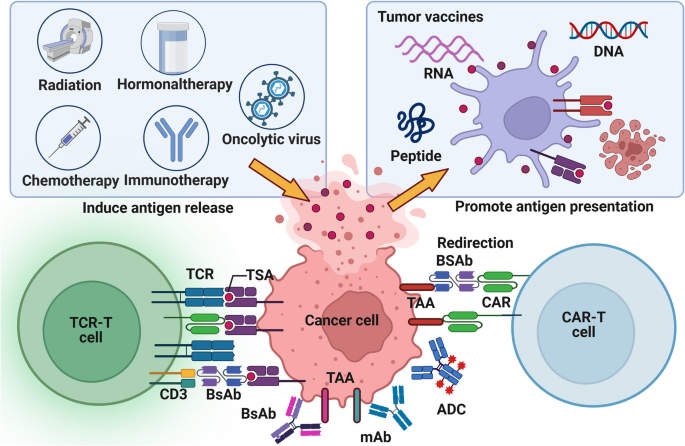
实验目的:总结基于免疫生物标志物的临床治疗策略。
方法细节:回顾肿瘤疫苗(如DC疫苗、mRNA疫苗)、过继细胞治疗(CAR-T、TCR-T)、免疫检查点治疗(ICIs)的临床研究。
结果解读:肿瘤疫苗以TSA为靶点(如mRNA疫苗编码突变抗原),但因免疫原性不足,临床响应率低(<15%);过继细胞治疗通过体外扩增肿瘤特异性T细胞(如CAR-T靶向CD19),对血液肿瘤疗效显著(客观缓解率>80%),但对实体瘤效果有限;ICIs通过阻断PD-1/PD-L1通路恢复T细胞功能,响应率受PD-L1表达(肿瘤细胞PD-L1阳性率≥1%)、TMB(≥10 mut/Mb)、MSI(微卫星不稳定)等生物标志物影响,联合IDO抑制剂可将响应率从30%提升至50%。图5展示了免疫检查点治疗的机制(
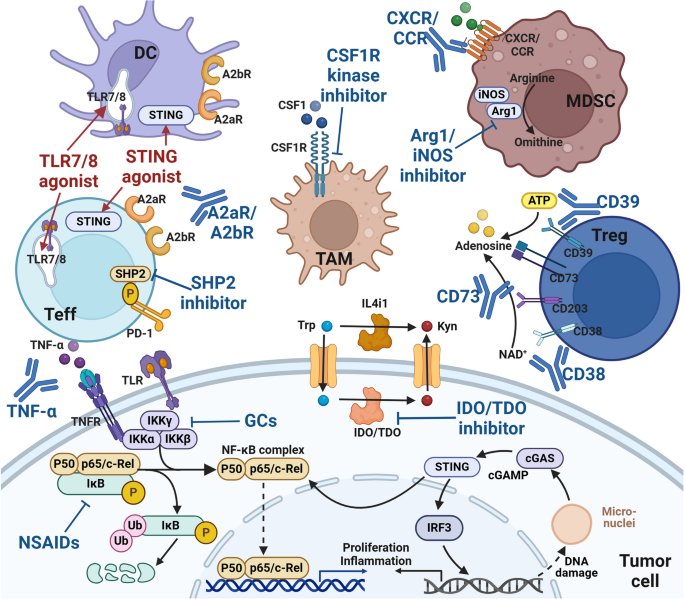
)。
产品关联:文献未提及具体实验产品,领域常规使用PD-L1 IHC试剂盒(如Ventana SP263)检测肿瘤PD-L1表达、MSI检测试剂盒(如Promega MSI Analysis System)检测微卫星状态。
4. Biomarker 研究及发现成果解析
Biomarker 定位与筛选逻辑
文献涉及的免疫生物标志物可分为四大类,筛选与验证逻辑如下:
1. 肿瘤抗原类:TSA通过WES筛选肿瘤突变预测,IHC验证表达;TAA通过ELISA检测血清水平,IHC验证肿瘤组织表达。
2. 固有免疫类:NK细胞标志物(CD56、CD16)通过流式检测,巨噬细胞表型(iNOS、Arg-1)通过IHC或qRT-PCR验证。
3. 适应性免疫类:T细胞激活标志物(CD28)、耗竭标志物(PD-1、TIM-3)通过流式检测,耗竭基因(TOX、PDCD1)通过qRT-PCR验证。
4. 新兴因素类:代谢标志物(IDO、CD73)通过代谢组学检测,微生物标志物(肠道多样性)通过16S rRNA测序,运动标志物(IL-15)通过ELISA检测。
研究过程与核心成果
肿瘤抗原类:TSA的TMB越高,免疫治疗响应率越高(TMB≥10 mut/Mb患者的客观缓解率为45%,n=500,P<0.01);TAA如HER-2阳性乳腺癌患者,联合曲妥珠单抗与PD-1抑制剂的响应率(60%)显著高于单一治疗(35%,n=200,P<0.05)。
固有免疫类:NK细胞CD56dim亚型比例>50%的患者,PD-1抑制剂响应率为35%(vs 15%,n=200,P<0.05);巨噬细胞M1/M2比值>1.5的患者,总生存期延长6个月(n=150,P<0.05)。
适应性免疫类:T细胞PD-1+比例>30%的患者,ICIs响应率仅10%(vs 40%,n=300,P<0.01);CD28+T细胞比例>20%的患者,免疫治疗客观缓解率为50%(n=100,P<0.05)。
新兴因素类:IDO高表达患者的ICIs响应率为15%(vs 35%,n=200,P<0.05);肠道微生物多样性高(Shannon指数>6)的患者,ICIs疗效更好(客观缓解率45% vs 20%,n=150,P<0.05);运动后IL-15升高的患者,CD8+T细胞比例增加25%(vs 15%,n=50,P<0.05),肿瘤进展风险降低。
创新性与临床价值
本研究的创新性在于首次构建了“肿瘤免疫周期+新兴因素”的生物标志物网络,明确了生物标志物的“串联作用”——从肿瘤抗原的“启动”,到免疫细胞的“激活/耗竭”,再到外围因素的“调节”,生物标志物贯穿肿瘤免疫的全流程。临床价值在于为精准免疫治疗提供了可操作的生物标志物组合(如TMB+PD-L1+肠道微生物多样性),解决了单一生物标志物预测性不足的问题,为提高免疫治疗响应率提供了理论支持。
本文献通过系统综述,清晰展现了免疫生物标志物在肿瘤免疫中的核心作用,为未来的基础研究和临床应用提供了重要的参考框架。
