1. 领域背景与文献引入
文献英文标题:A (1;19) translocation involving TCF3-PBX1 fusion within the context of a hyperdiploid karyotype in adult B-ALL: a case report and review of the literature;发表期刊:Biomarker Research;影响因子:未公开;研究领域:B细胞急性淋巴细胞白血病(B-ALL)分子细胞遗传学。
B细胞急性淋巴细胞白血病(B-ALL)是儿童与成人常见的血液系统恶性肿瘤,染色体易位是其核心驱动事件。其中,t(1;19)(q23;p13)是B-ALL中频率约6%的常见易位,可形成TCF3(19p13)与PBX1(1q23)融合基因,编码的融合蛋白通过TCF3的转录激活域与PBX1的DNA结合域,持续激活靶基因,导致B细胞分化阻滞。单独t(1;19)易位通常预后中等,而超二倍体核型(染色体数>50)则与良好预后相关。然而,当t(1;19)与超二倍体核型共存时,现有研究显示仅少数病例表达TCF3-PBX1融合基因,且此类病例的细胞遗传学特征、病因差异及预后意义尚未明确——多数研究聚焦儿童病例或TCF3-PBX1阴性的超二倍体t(1;19)病例,成人病例的分子分类数据缺失。
针对这一空白,本研究报道1例成人复发前体B-ALL病例,其核型同时存在超二倍体与t(1;19)易位,通过荧光原位杂交(FISH)确认TCF3-PBX1融合基因,探讨此类病例的分子分类重要性,为成人B-ALL的精准预后判断提供临床证据。
2. 文献综述解析
作者通过“染色体数目与TCF3-PBX1表达关联→超二倍体与t(1;19)的发生顺序→TCF3-PBX1阳性/阴性的细胞遗传学差异”的逻辑,对现有研究进行分类评述:
现有研究中,Hunger等(1997)发现t(1;19)阳性B-ALL中,染色体数<50的病例95%表达TCF3-PBX1融合转录本,而染色体数>50的病例仅25%表达,且两者免疫表型不同(如TCF3-PBX1阳性病例更易表达CD10),提示病因异质性;Paulsson等(2013)分析42例超二倍体(51-67条染色体)合并t(1;19)的病例,发现超二倍体多为原发性异常(发生在t(1;19)之前),且仅18%病例为平衡易位,多数TCF3-PBX1融合阴性;Barber等(2007)进一步证实,90%以上TCF3-PBX1阴性的t(1;19)病例为不平衡易位,而40%阳性病例为平衡易位,支持亚型的分子异质性。
本研究的创新价值在于:补充了成人B-ALL中“超二倍体+平衡t(1;19)+TCF3-PBX1阳性”这一少见亚型的病例数据——现有Mitelman数据库仅收录5例类似成人病例,本研究通过G显带metaphase的荧光原位杂交(而非仅间期核)确认融合基因,避免了间期核检测的假阳性,强调了分子检测(如FISH、PCR)对区分TCF3-PBX1阳性/阴性超二倍体t(1;19) B-ALL的必要性,纠正了“超二倍体即预后良好”的片面认知。
3. 研究思路总结与详细解析
本研究以“临床病例→细胞遗传学→分子验证→预后关联”为核心逻辑,分4个关键环节展开:
3.1 病例临床特征与样本采集
实验目的:明确患者的疾病进程与样本来源,为后续分析提供临床上下文。
方法细节:纳入1例44岁女性复发前体B-ALL患者,回顾其2013年3月初诊(免疫表型CD10+、CD19+、icCD22+等,核型正常)、治疗史(UK ALL 14方案、FLAG-Ida、blinatumomab,因癫痫停药)及2014年5月死亡结局;采集复发时的骨髓样本用于细胞遗传学分析。
结果解读:患者复发时骨髓blasts占85%,免疫表型为pre-B细胞表型(CD10+、CD19+、PAX-5+、TdT弱阳),提示疾病进展至晚期。
产品关联:文献未提及样本采集试剂,领域常规使用EDTA抗凝管保存骨髓样本。
3.2 细胞遗传学核型分析
实验目的:检测染色体数目与结构异常,初步识别t(1;19)易位与超二倍体核型。
方法细节:采用标准细胞遗传学技术制备骨髓细胞染色体,使用Applied Imaging CytoVision软件分析核型,按ISCN 2013命名法描述结果;因有丝分裂指数低,仅获得3个metaphase细胞。
结果解读:核型显示异常女性核型:53-54,XX,+1,t(1;19)(q23;p13),+8,+8,+8,+11,add(13)(q34),+20,+22,+mar[cp3],确认超二倍体(染色体数53-54)与t(1;19)易位共存。
产品关联:实验所用关键产品:Applied Imaging CytoVision软件(核型分析)。
3.3 多靶点荧光原位杂交验证
实验目的:确认TCF3-PBX1融合基因,排除其他驱动突变(如MYC-IGH、BCR-ABL、MLL重排)。
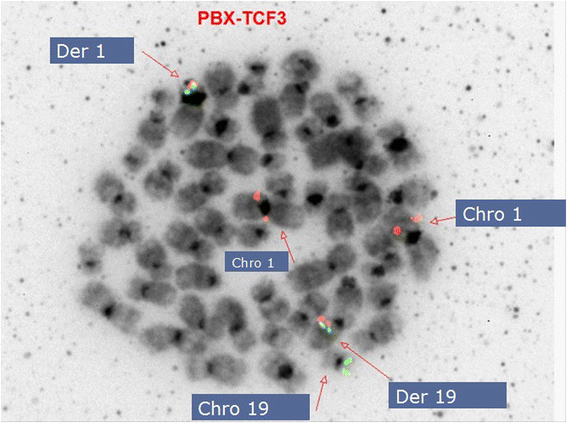
方法细节:对骨髓间期核细胞使用Abbott Molecular的Vysis MYC-IGH双融合探针、Vysis LSI BCR-ABL ES双易位探针、Vysis LSI MLL双断裂探针检测;对G显带后的metaphase细胞使用LSI TCF3/PBX1双融合探针(Abbott Molecular),绿色信号标记TCF3(19p13),红色信号标记PBX1(1q23),融合信号为黄色。
结果解读:间期核结果显示:73.8%核细胞(79/107)MYC拷贝数增加(MYCx5)、80%核细胞(44/55)BCR拷贝数增加(BCRx3)、4.7%核细胞(4/85)MLL拷贝数增加(MLLx3);metaphase结果显示2个TCF3-PBX1融合信号,且PBX1拷贝数增加(PBX1x4)、TCF3拷贝数增加(TCF3x3),确认融合基因存在,且超二倍体核型包含额外的染色体1。
产品关联:实验所用关键产品:Abbott Molecular的Vysis MYC-IGH双融合探针、Vysis LSI BCR-ABL ES双易位探针、Vysis LSI MLL双断裂探针、LSI TCF3/PBX1双融合探针。
3.4 结果整合与预后分析
实验目的:关联分子特征与预后,探讨病例的亚型归属。
方法细节:结合核型与荧光原位杂交结果,回顾Hunger、Paulsson等研究的TCF3-PBX1表达与核型的关系;查询Mitelman数据库中“超二倍体+ t(1;19)+TCF3-PBX1阳性”的成人病例,总结共同特征。
结果解读:患者为少见的成人TCF3-PBX1阳性超二倍体t(1;19) B-ALL病例,其额外染色体8(+8×3)与Mitelman数据库中4/6例类似病例一致;与Paulsson等研究中常见的额外染色体(21、4、6等)不同,提示TCF3-PBX1阳性病例可能有独特的染色体增益模式;患者复发后快速进展死亡,支持此类病例预后不良的结论。
4. Biomarker研究及发现成果解析
本研究的核心Biomarker为TCF3-PBX1融合基因,是超二倍体t(1;19) B-ALL的分子分类标志。
Biomarker定位与筛选逻辑
TCF3-PBX1融合基因是t(1;19)易位的分子产物,属于“结构变异类Biomarker”。筛选逻辑为:① 常规染色体核型分析发现t(1;19)易位;② 针对TCF3(19p13)与PBX1(1q23)设计双融合荧光原位杂交探针,在G显带metaphase细胞上验证融合——metaphase细胞可明确染色体位置,避免间期核检测的假阳性(如染色体重叠导致的信号误判)。
研究过程详述
Biomarker来源:患者复发时的骨髓metaphase细胞(有丝分裂期细胞,染色体形态清晰);
验证方法:荧光原位杂交(双融合探针,绿色信号标记TCF3,红色信号标记PBX1,融合信号为黄色);
特异性与敏感性:荧光原位杂交在metaphase细胞上的特异性高(可定位染色体1与19的易位位置),本研究中3个metaphase细胞均显示融合信号,确认存在融合;此外,间期核荧光原位杂交显示PBX1拷贝数增加(PBX1x4),支持超二倍体核型包含额外的染色体1。
核心成果提炼
功能关联:TCF3-PBX1融合蛋白通过持续激活PBX1靶基因(如HOX基因),导致B细胞分化阻滞,是B-ALL的驱动突变;在超二倍体核型背景下,该融合基因与预后不良相关——本研究患者复发后6个月内死亡,与现有研究中“TCF3-PBX1阳性超二倍体t(1;19)病例预后差于经典超二倍体病例”的结论一致(风险比未明确,因病例数少)。
创新性:补充了成人B-ALL中“超二倍体+平衡t(1;19)+TCF3-PBX1阳性”的少见病例数据,强调分子检测(如荧光原位杂交)对区分超二倍体t(1;19) B-ALL亚型的重要性——若仅依据超二倍体核型判断预后(认为良好),会忽视TCF3-PBX1融合带来的不良预后,导致治疗不足。
关键图片
图1:患者核型图(显示超二倍体与t(1;19)易位)
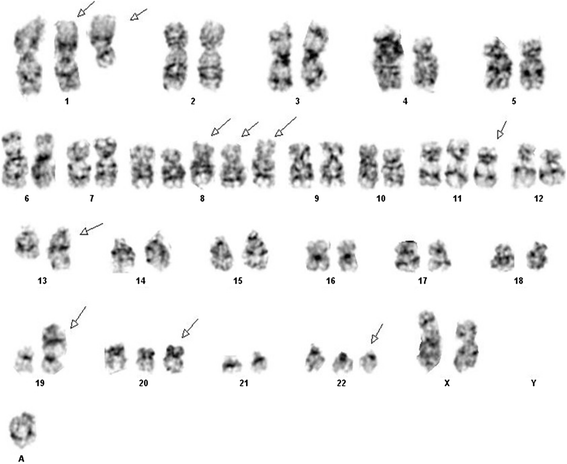
图2:间期核荧光原位杂交结果(显示MYC、BCR、MLL拷贝数增加)
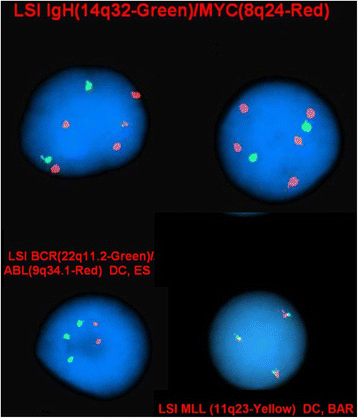
图3:metaphase荧光原位杂交结果(显示TCF3-PBX1融合信号)