1. 领域背景与文献引入
文献英文标题:5-Hydroxymethylcytosine modifications in circulating cell-free DNA: frontiers of cancer detection, monitoring, and prognostic evaluation;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤表观遗传学与液体活检。
癌症是全球范围内导致死亡的主要原因之一,2022年全球新发病例约2000万,预计2050年将增至3500万(文献1)。早期检测与精准监测是提高癌症患者生存率的关键——例如,早期肺癌患者的5年生存率可达50%以上,而晚期仅为5%(文献4)。然而,现有筛查方法(如低剂量CT、内镜、血清标志物)存在明显局限:低剂量CT的辐射风险与低特异性限制了广泛应用,内镜的侵入性导致患者依从性差,血清标志物(如CEA、AFP)的灵敏度与特异性不足(文献6-8)。
在精准肿瘤学背景下,循环游离DNA(cfDNA)中的表观遗传修饰因兼具“非侵入性”与“肿瘤特异性”,成为癌症 biomarker 研究的核心方向。其中,5-羟甲基胞嘧啶(5hmC)作为5-甲基胞嘧啶(5mC)经TET酶氧化的产物,不仅参与DNA去甲基化与基因调控,更在肿瘤中呈现“全局水平降低、局部关键基因富集”的特征(文献17-24)。cfDNA中的5hmC修饰(cfDNA-5hmC)因能反映肿瘤细胞的表观遗传重编程,被认为是潜在的癌症早期检测、监测与预后标志物。
本综述围绕cfDNA-5hmC的“生物学基础→检测技术→临床应用”展开,系统整合了其在肺癌、结直肠癌、肝癌等多癌种中的研究证据,分析了技术局限与临床转化挑战,为cfDNA-5hmC的临床应用提供了全面参考。
2. 文献综述解析
本综述以“5hmC的生物学→检测技术→临床应用”为核心逻辑,对现有研究进行分类总结。首先,在生物学层面,现有研究明确5hmC是TET1/2/3酶催化5mC氧化的中间产物,参与基因转录调控,肿瘤中5hmC的变化与细胞增殖、转移密切相关(如肺癌中关键抑癌基因的5hmC水平降低,癌基因的5hmC富集);其次,在检测技术层面,现有方法分为碱基分辨率(如TAB-seq、oxBS,精准但DNA降解严重)、富集-based(如5hmC-Seal,灵敏但分辨率低)、第三代测序(如SMRT,长读长但成本高)三类,各有优缺点(文献25-42);最后,在临床应用层面,多个研究证实cfDNA-5hmC在癌症检测(如肺癌AUC=0.93-0.96)、治疗监测(如免疫治疗反应预测)、预后评估(如肝癌复发风险预测)中的价值,但也存在“样本量小、技术标准化缺失、泛癌验证不足”等局限(文献43-134)。
本综述的创新在于:首次系统整合了cfDNA-5hmC从基础到临床的全链条研究,覆盖多癌种与多临床场景,同时强调“多组学整合”(如5hmC+ fragmentomics)与“技术标准化”对临床转化的重要性,弥补了现有研究中“单一癌种、单一技术”的局限。
3. 研究思路总结与详细解析
3.1 5hmC的生物学基础与代谢通路解析
实验目的:阐明5hmC的生成机制及其在肿瘤中的生物学意义。
方法细节:综述了TET酶家族催化5mC氧化的通路——TET1/2/3将5mC逐步氧化为5hmC、5-甲酰胞嘧啶(5fC)、5-羧基胞嘧啶(5caC),其中5hmC作为稳定中间产物,参与DNA去甲基化与基因表达调控(文献17)。同时,整合了肿瘤中5hmC的变化模式:全局5hmC水平降低(与TET酶失活相关),但局部关键基因(如肺癌的GATA4、肝癌的YAP1)的5hmC富集(文献23-24)。
结果解读:5hmC的变化并非随机,而是与肿瘤发生、发展的关键通路(如Wnt/β-catenin、PI3K/AKT)相关,为其作为癌症 biomarker 提供了生物学依据。
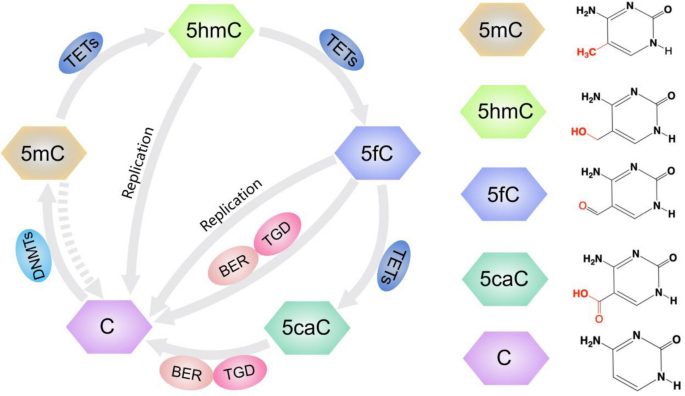
产品关联:文献未提及具体实验产品,领域常规使用TET酶试剂盒(如New England Biolabs的TET Enzyme)、β-葡萄糖基转移酶(βGT)试剂盒等。
3.2 5hmC检测技术的分类与性能比较
实验目的:比较不同5hmC检测技术的优缺点,为临床应用提供技术参考。
方法细节:将检测技术分为三类:(1)碱基分辨率方法(TAB-seq、oxBS):通过化学修饰区分5mC与5hmC,精准但需大量DNA,易降解;(2)富集-based方法(5hmC-Seal、hMe-Seal):通过抗体或化学标记富集5hmC片段,灵敏度高(可处理ng级cfDNA),但分辨率低;(3)第三代测序(SMRT、Nanopore):直接检测DNA修饰,无需PCR扩增,但误差率高(~10%)、成本高(文献25-42)。
结果解读:富集-based方法(如5hmC-Seal)因“低输入量、高灵敏度”,成为cfDNA-5hmC研究的主流技术;碱基分辨率方法适合机制研究,第三代测序仍处于科研阶段。
产品关联:文献未提及具体实验产品,领域常规使用DNA富集试剂盒(如Active Motif的5hmC DNA Enrichment Kit)、测序平台(如Illumina的NextSeq 500)等。
3.3 cfDNA-5hmC在癌症临床场景中的应用证据整合
实验目的:整合cfDNA-5hmC在癌症检测、监测、预后中的临床证据。
方法细节:综述了多癌种的临床研究,包括:(1)肺癌:基于2032例肺结节患者的研究显示,cfDNA-5hmC联合临床特征的模型AUC=0.923(文献46);(2)结直肠癌:2576例队列中,96基因模型区分CRC与健康人AUC=0.93(文献47);(3)肝癌:1204例HCC患者中,32基因模型区分早期HCC与肝硬化AUC=0.884(文献53);(4)胰腺癌:4334例队列中,5hmC模型检测早期胰腺癌灵敏度=68.3%(文献52)。
结果解读:cfDNA-5hmC在多癌种中表现出高检测性能,且能监测治疗反应(如肺癌免疫治疗的wp-score,AUC=0.93)、预测预后(如HCC复发风险,HR=2.1,P=0.00865)(文献111、54)。
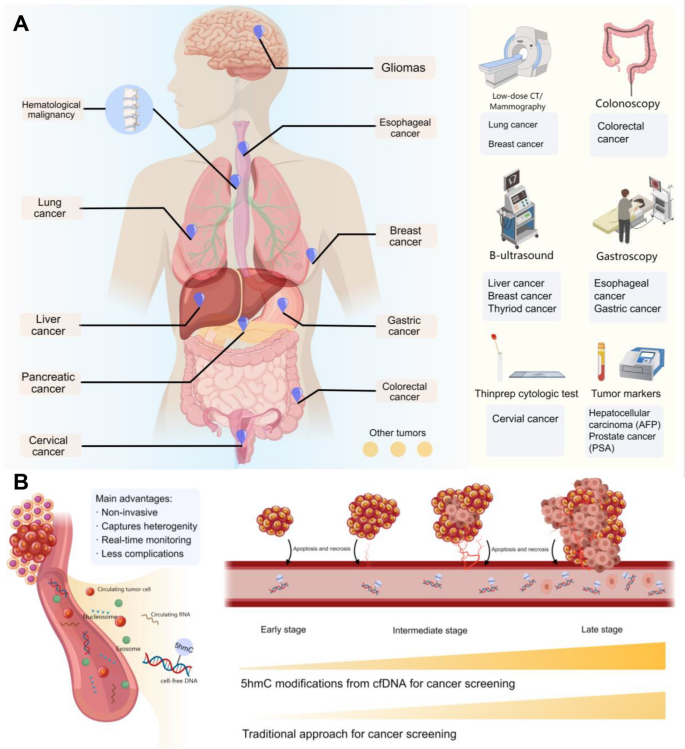
产品关联:文献未提及具体实验产品,领域常规使用cfDNA提取试剂盒(如Qiagen的QIAamp Circulating Nucleic Acid Kit)、PCR试剂盒(如Thermo Fisher的TaqMan Universal PCR Master Mix)等。
4. Biomarker 研究及发现成果解析
Biomarker 定位
本综述聚焦的 biomarker 是循环游离DNA中的5-羟甲基胞嘧啶修饰(cfDNA-5hmC),属于“表观遗传 biomarker”。其筛选与验证逻辑为:生物学基础(TET酶通路与肿瘤关联)→技术优化(富集-based方法适配cfDNA)→临床验证(多中心队列证实检测、监测、预后价值)。
研究过程详述
Biomarker 来源:血浆/血清中的循环游离DNA(cfDNA),来源于肿瘤细胞的凋亡或坏死。
验证方法:采用“富集-based测序(如5hmC-Seal)”或“碱基分辨率测序(如TAB-seq)”检测cfDNA中的5hmC分布,结合机器学习模型(如弹性网络、随机森林)构建诊断/预后模型。
特异性与敏感性数据:(1)肺癌:训练集AUC=0.93,验证集AUC=0.96(灵敏度=87.5%,特异性=90.3%,n=2032);(2)结直肠癌:内部验证AUC=0.93,外部验证AUC=0.87(灵敏度=78.6%,特异性=96.6%,n=2576);(3)肝癌:区分早期HCC与肝硬化AUC=0.846(灵敏度=51.32%,特异性=77.61%,n=1204);(4)泛癌检测:6癌种队列中,5hmC模型灵敏度=68.6%,特异性=96.6%(n=605)。
核心成果提炼
cfDNA-5hmC的功能关联包括:(1)癌症早期检测:能区分早期肺癌(I期)与健康人(AUC=0.93),预测结直肠癌前病变(高级别腺瘤)(AUC=0.87);(2)治疗监测:预测肺癌免疫治疗反应(wp-score,低分值患者客观缓解率更高,P=0.00059);(3)预后评估:预测肝癌术后复发风险(HR=2.1,P=0.00865),AML患者生存期(高wp-score患者生存期更短,P=0.00719)。
创新性在于:首次系统证实cfDNA-5hmC作为“泛癌 biomarker”的潜力,覆盖多临床场景,且性能优于传统标志物(如CEA、AFP)——例如,肝癌中cfDNA-5hmC模型的AUC(0.884)显著高于AFP(0.826,P<0.01)(文献53、55)。
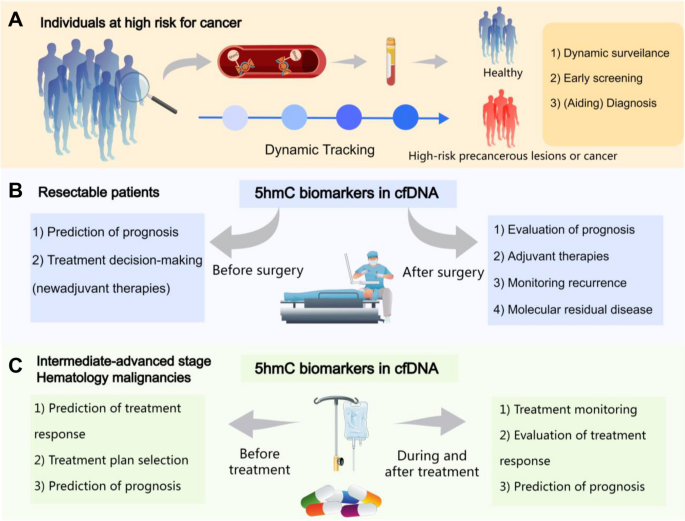
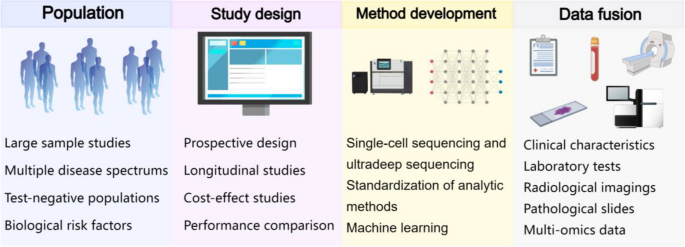
本综述表明,cfDNA-5hmC是极具潜力的癌症 biomarker,但临床转化仍需解决“技术标准化、大样本验证、多组学整合”等问题。未来研究需聚焦“泛癌模型构建”与“临床指南制定”,推动cfDNA-5hmC进入 routine 临床实践。
