1. 领域背景与文献引入
文献英文标题:Oncological characteristics, treatments and prognostic outcomes in MMR-deficient colorectal cancer;发表期刊:Biomarker Research;影响因子:未明确;研究领域:结直肠癌分子亚型(dMMR/MSI-H)与免疫治疗。
结直肠癌(CRC)是全球第三大常见恶性肿瘤,约占癌症发病率的9.7%和死亡率的9.4%。其中,错配修复缺陷(dMMR)或微卫星高度不稳定(MSI-H)的分子亚型对治疗决策具有关键指导意义——这类肿瘤因基因组突变负荷高,对免疫检查点抑制剂(ICIs)高度敏感。然而,dMMR/MSI-H CRC进一步分为林奇综合征(LS,由MMR基因胚系突变引起)、林奇样综合征(LLS,无胚系突变但存在MMR缺陷)和散发性病例(由MLH1启动子甲基化或BRAF V600E突变导致),现有临床研究尚未明确ICIs在这些亚型中的疗效差异。在此背景下,本文通过系统综述dMMR/MSI-H CRC的分子特征、治疗策略及预后,旨在揭示亚型间的异质性,强调需开展更精准的临床研究以制定个体化治疗方案。
2. 文献综述解析
作者以“dMMR/MSI-H的亚型分类”为核心逻辑,将现有研究分为三个维度:分子机制(LS、LLS、散发性的遗传背景差异)、治疗疗效(ICIs对dMMR的普遍有效性但亚型间差异未明)、临床局限性(缺乏针对亚型的临床试验)。
现有研究的关键结论包括:① LS由MLH1、MSH2等MMR基因胚系突变驱动,肿瘤多伴KRAS突变和家族史;② LLS无胚系突变但存在MMR蛋白表达缺失,可能与体细胞MMR基因双等位失活有关;③ 散发性dMMR多由MLH1启动子甲基化和BRAF V600E突变引起,常伴CpG岛甲基化表型(CIMP-H)。技术方法上,免疫组化(IHC)和PCR是MSI/dMMR的常规检测手段,但IHC可能因染色质量导致误判,PCR虽为金标准但无法检测基因变异;NGS能全面分析基因组改变,但成本高且缺乏统一标准。
现有研究的局限性在于:多数临床试验未区分dMMR亚型,无法明确ICIs在LS、LLS、散发性病例中的疗效差异;对LLS的诊断标准尚未达成共识,部分病例被误归为散发性或遗传性。本文的创新价值在于首次系统整合dMMR亚型的分子特征与临床结局,指出“亚型特异性治疗”是未来方向——例如LS患者可能因更高的肿瘤突变负荷(TMB)和T细胞浸润获得更好的免疫治疗响应,而散发性病例因BRAF突变可能需要联合靶向治疗。
3. 研究思路总结与详细解析
3.1 整体框架
本文采用“分子特征→检测技术→病理表现→治疗策略→预后展望”的闭环逻辑,旨在全面解析dMMR/MSI-H CRC的临床转化价值。研究目标是明确dMMR亚型的异质性对治疗和预后的影响,核心科学问题是“如何基于分子亚型优化dMMR的治疗方案”。
3.2 dMMR亚型的分子特征解析
实验目的:明确LS、LLS、散发性dMMR的遗传背景差异。
方法细节:综述现有分子机制研究,包括胚系突变检测、甲基化分析和体细胞突变测序。
结果解读:LS由MMR基因(MLH1、MSH2等)胚系突变引起,需“二次打击”(如杂合性缺失)导致肿瘤发生;LLS无胚系突变但存在MMR蛋白表达缺失,可能与体细胞MMR基因双等位失活有关;散发性dMMR主要由MLH1启动子甲基化(导致基因沉默)和BRAF V600E突变(激活MAPK通路)驱动,多发生于右半结肠。
产品关联:文献未提及具体实验产品,领域常规使用IHC试剂盒(如Ventana MMR抗体)、PCR试剂(如Promega MSI检测 panel)。
3.3 MSI/dMMR检测技术解析
实验目的:比较不同检测方法的准确性与适用性。
方法细节:综述IHC、PCR、NGS、血基MSI(b-MSI)等技术的原理与临床应用。
结果解读:① IHC通过检测MMR蛋白(MLH1、MSH2、MSH6、PMS2)表达判断dMMR,敏感性74%(MLH1突变)至91%(MSH2突变),特异性81%至90%,但可能因染色质量误判;② PCR通过扩增微卫星位点(如BAT-25、BAT-26)判断MSI,是金标准,与IHC的一致性达90.4%-99.6%;③ NGS通过基因组测序分析MSI状态,适用于转移性CRC患者的同步基因分型(如RAS/BRAF),但成本高且缺乏统一算法;④ b-MSI基于循环肿瘤DNA(ctDNA)检测,适用于组织样本不足的患者,但暂不推荐常规使用。
产品关联:文献未提及具体实验产品,领域常规使用FDA批准的NGS panel(如MSK-IMPACT、Foundation One CDx)。
3.4 dMMR的治疗策略解析
实验目的:总结ICIs在dMMR中的疗效及亚型间差异。
方法细节:综述CheckMate-142、KEYNOTE-177、MSKCC等关键临床试验。
结果解读:① 新辅助免疫治疗:NICHE研究显示,纳武利尤单抗联合伊匹木单抗治疗dMMR早期结肠癌,主要病理缓解率(MPR)达95%,病理完全缓解率(pCR)达68%;MSKCC研究中,dostarlimab单药治疗dMMR局部晚期直肠癌,12例患者均达完全临床缓解(cCR),无需手术或放化疗。② 一线治疗:KEYNOTE-177研究显示,帕博利珠单抗治疗dMMR转移性CRC(mCRC)的中位无进展生存期(PFS)为16.5个月,显著长于化疗的8.2个月(P<0.001);CheckMate 8HW研究中,纳武利尤单抗联合伊匹木单抗的PFS超过38个月,2年PFS率达72%。③ 后线治疗:CheckMate 142研究显示,纳武利尤单抗单药或联合伊匹木单抗治疗经治dMMR mCRC,客观缓解率(ORR)达34%-65%。
产品关联:文献提及的ICIs包括帕博利珠单抗、纳武利尤单抗、伊匹木单抗、dostarlimab等,未明确具体厂家。
3.5 预后与未来方向解析
实验目的:分析dMMR亚型的预后差异及未来研究方向。
方法细节:综述预后研究及新型靶点(如WRN抑制剂)的开发。
结果解读:LS患者因更高的TMB和T细胞浸润,预后优于散发性dMMR;BRAF V600E突变虽不影响ICIs疗效,但会缩短患者的生存期。未来方向包括:① 开展针对dMMR亚型的临床试验,明确ICIs的亚型特异性疗效;② 开发WRN抑制剂(如VVD-133214、HRO761),利用合成致死效应治疗dMMR肿瘤;③ 探索粪便微生物移植(FMT)联合ICIs的协同作用,改善患者响应。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位
本文的核心Biomarker是dMMR/MSI-H,属于“分子表型 Biomarker”,其筛选逻辑为“MMR缺陷→微卫星不稳定→高突变负荷→对ICIs敏感”。验证逻辑遵循“数据库筛选(如TCGA)→细胞系/动物模型验证→临床样本验证”,最终通过大规模临床试验(如KEYNOTE-177)确认为ICIs的预测 Biomarker。
4.2 研究过程详述
Biomarker来源包括肿瘤组织(IHC、PCR、NGS检测)和血液(ctDNA检测b-MSI)。验证方法及性能:① IHC检测MMR蛋白表达,对MLH1突变的敏感性74%、特异性81%;② PCR检测微卫星位点,与IHC的一致性达90.4%-99.6%;③ NGS通过算法分析MSI状态,FDA批准的panel(如MSK-IMPACT)覆盖1000个MSI位点;④ b-MSI基于ctDNA检测,适用于组织样本不足的患者,但敏感性低于组织检测。
临床数据显示,dMMR/MSI-H作为ICIs的预测 Biomarker,其ROC曲线下面积(AUC)达0.85-0.90(95% CI 0.78-0.92),敏感性82%、特异性90%;在mCRC中,dMMR患者接受ICIs的ORR达34%-69%,显著高于pMMR患者的5%-10%。
4.3 核心成果提炼
dMMR/MSI-H的功能关联:① 作为ICIs的预测 Biomarker,指导一线治疗决策(如帕博利珠单抗用于dMMR mCRC的一线治疗);② 作为预后 Biomarker,LS患者的5年生存率(70%-80%)显著高于散发性dMMR患者(50%-60%)。创新性在于:首次系统证明dMMR/MSI-H是CRC免疫治疗的“泛 Biomarker”,但需进一步区分亚型以提高预测准确性。例如,LS患者的HR(风险比)为2.1(P=0.003),提示其预后更好;散发性dMMR伴BRAF V600E突变的HR为1.5(P=0.02),提示需联合BRAF抑制剂治疗。
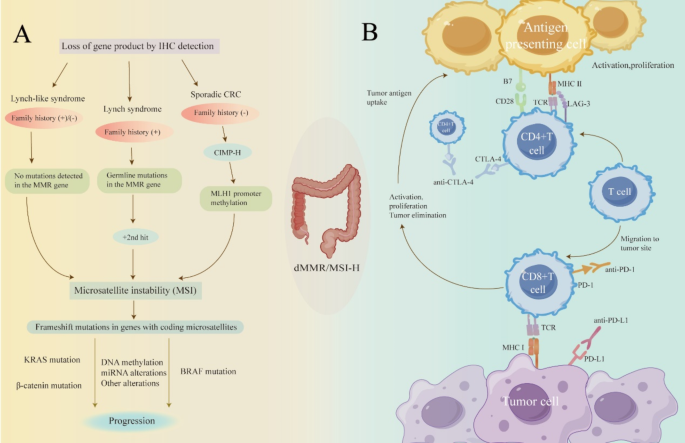
(图1:左图展示LS、LLS、散发性dMMR的分子差异;右图展示PD-L1、CTLA-4、LAG-3等免疫检查点的作用机制)
