1. 领域背景与文献引入
文献英文标题:Impact of NSCLC metabolic remodeling on immunotherapy effectiveness;发表期刊:Biomarker Research;影响因子:未公开;研究领域:非小细胞肺癌代谢重编程与免疫治疗。
非小细胞肺癌(NSCLC)是全球癌症相关死亡的首要原因,发病率呈上升趋势,晚期患者5年生存率不足20%,传统手术、化疗、放疗等治疗手段存在局限性。以PD-1/PD-L1抑制剂为代表的免疫治疗因改善生存期、副作用少等优势,推动了NSCLC治疗模式的转变——目前纳武利尤单抗、帕博利珠单抗等已获批用于一线或二线治疗。然而,免疫检查点阻断(ICB)治疗的响应率仅约20%-30%,多数患者存在原发性耐药,部分患者出现免疫相关不良反应(irAE)(如肠道、肺部炎症或内分泌器官损伤),限制了联合ICB的临床应用。领域共识:代谢重编程是肿瘤细胞适应微环境、维持高速增殖的核心机制,肿瘤微环境(TME)中的代谢变化(如葡萄糖剥夺、乳酸积累)会调控免疫细胞功能,直接影响免疫治疗疗效。现有研究对NSCLC代谢重编程与免疫治疗疗效的具体关联及机制探讨不足,因此本文旨在总结NSCLC代谢重编程的研究进展,分析其对免疫治疗的影响,并探讨靶向代谢通路提高免疫治疗效果的策略,为NSCLC的联合治疗提供理论依据。
2. 文献综述解析
文献综述以“NSCLC代谢重编程特征→TME代谢变化对免疫细胞的影响→现有免疫治疗的局限”为核心逻辑,系统评述NSCLC代谢重编程与免疫治疗的关联。现有研究的关键结论包括:NSCLC细胞通过Warburg效应(有氧糖酵解)进行代谢重编程,上调葡萄糖转运体(如GLUT1)和糖酵解酶(如HK-II、PFKFB3、PKM2、LDH),增加葡萄糖摄取和乳酸产生;TME中的葡萄糖剥夺抑制效应T细胞的有氧糖酵解和抗瘤活性,乳酸积累促进调节性T细胞(Treg)、髓源性抑制细胞(MDSC)、M2型肿瘤相关巨噬细胞(TAM)等抑制性免疫细胞的分化和功能,抑制树突状细胞(DC)的抗原呈递能力;ICB治疗的低响应率与TME的代谢抑制密切相关。技术方法的优势包括利用PET/CT检测NSCLC患者的葡萄糖摄取,通过基因编辑(如敲低PFKFB3、PKM2)研究代谢酶的功能,以及临床研究探讨代谢抑制剂与ICB的联合效果;局限性在于多数研究基于细胞或动物模型,临床转化数据有限,对代谢重编程与免疫细胞相互作用的具体信号通路阐释不够。
本文的创新价值在于整合糖代谢、氨基酸代谢等多个代谢通路,系统分析NSCLC代谢重编程对免疫治疗的影响,提出靶向代谢通路(如抑制糖酵解、调控氨基酸代谢)与ICB联合的治疗策略,弥补了现有研究对“代谢-免疫相互作用”整合分析的不足,为NSCLC免疫治疗的优化提供了新视角。
3. 研究思路总结与详细解析
整体框架:研究目标为总结NSCLC代谢重编程对免疫治疗效果的影响,核心科学问题是“NSCLC代谢重编程如何通过调控TME中的免疫细胞功能影响免疫治疗疗效”,技术路线为“综述NSCLC代谢重编程特征→分析代谢变化对免疫细胞的作用→探讨靶向代谢通路的联合治疗策略”。
3.1 NSCLC代谢重编程特征分析
实验目的是明确NSCLC细胞代谢重编程的主要通路及关键分子。方法细节包括回顾已发表研究中NSCLC细胞糖代谢(如GLUT1、HK-II、PFKFB3、PKM2、LDH的表达)和氨基酸代谢(如xCT、GSL1、IDO1的功能)的研究数据,结合PET/CT检测NSCLC患者的葡萄糖摄取情况。结果解读显示:NSCLC细胞通过Warburg效应增加葡萄糖摄取(18F-FDG PET/CT可检测到高葡萄糖摄取),上调糖酵解酶活性,产生大量乳酸(如图1所示)
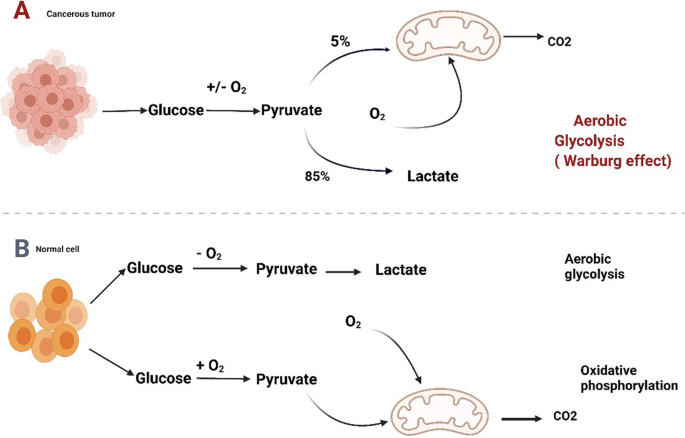
;氨基酸代谢异常表现为胱氨酸摄取增加(xCT高表达)、谷氨酰胺分解增强(GSL1激活)、色氨酸代谢产生犬尿氨酸(IDO1催化)。例如,NSCLC组织中GLUT1表达高于正常组织,且与放疗耐药相关;PKM2作为糖酵解关键酶,其敲低或激活均影响肿瘤生长。产品关联:文献未提及具体实验产品,领域常规使用葡萄糖分析仪检测细胞葡萄糖摄取,免疫印迹或免疫组化检测代谢酶表达,PET/CT用于临床患者的葡萄糖代谢评估。
3.2 代谢重编程对TME免疫细胞的影响
实验目的是探讨NSCLC代谢重编程如何调控TME中免疫细胞的功能。方法细节包括回顾TME中葡萄糖剥夺、乳酸积累对T细胞、MDSC、TAM、DC的作用机制研究(如通过流式细胞术检测免疫细胞表型,Western blot检测HIF-1α、PPARγ等信号分子的表达)。结果解读显示:TME中的葡萄糖剥夺抑制效应T细胞的有氧糖酵解,降低其增殖和细胞毒性;乳酸积累通过HIF-1α信号促进M2型TAM极化,通过抑制DC的抗原呈递功能削弱T细胞激活,同时促进Treg和MDSC的积累,增强免疫抑制(如图2所示)
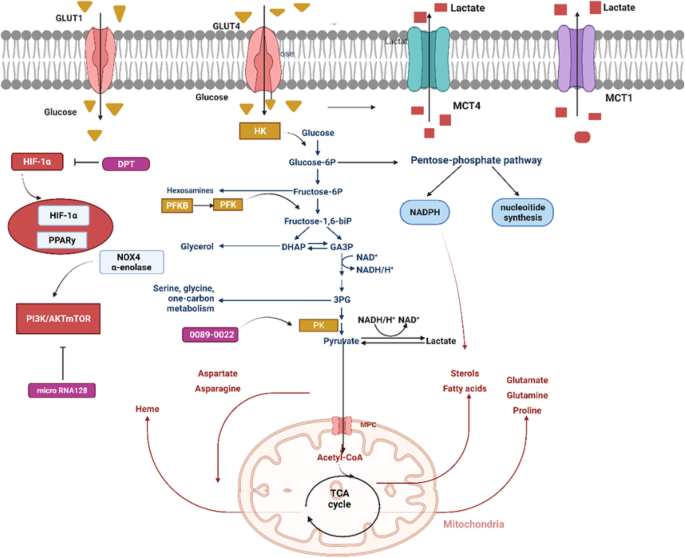
。例如,肿瘤细胞产生的乳酸可通过上调MDSC的抑制功能,抑制效应T细胞增殖;M2型TAM通过分泌IL-10、TGF-β等细胞因子促进肿瘤进展。产品关联:文献未提及具体实验产品,领域常规使用流式细胞仪检测免疫细胞表型(如CD3、CD8、Foxp3、CD11b、Gr-1等标志物),ELISA检测细胞因子水平。
3.3 靶向代谢通路增强免疫治疗的策略
实验目的是总结靶向NSCLC代谢通路提高免疫治疗效果的潜在策略。方法细节包括回顾已发表的临床前和临床研究(如使用糖酵解抑制剂、氨基酸代谢抑制剂与ICB联合的效果)。结果解读显示:靶向糖酵解(如抑制GLUT1、PFKFB3)可减少乳酸产生,改善TME的葡萄糖供应,增强效应T细胞功能(如图3所示)
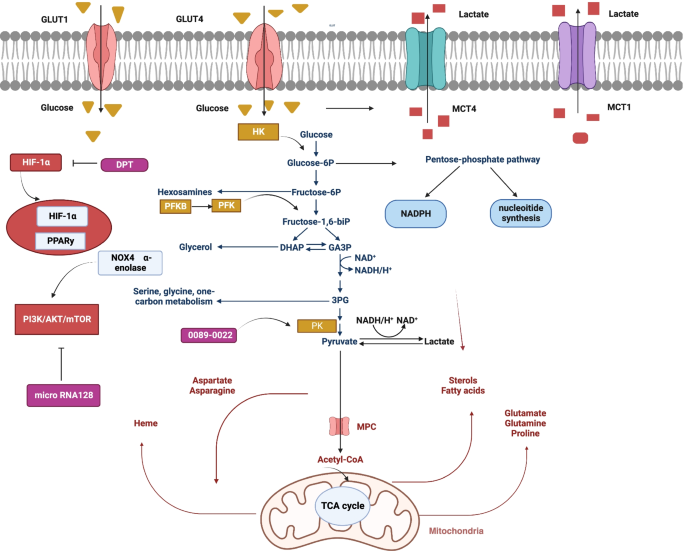
;调控氨基酸代谢(如SASP抑制xCT、CB-839抑制GSL1、Epacadostat抑制IDO1)可降低抑制性代谢物水平,减少抑制性免疫细胞积累,与ICB联合具有协同作用(如图4所示)
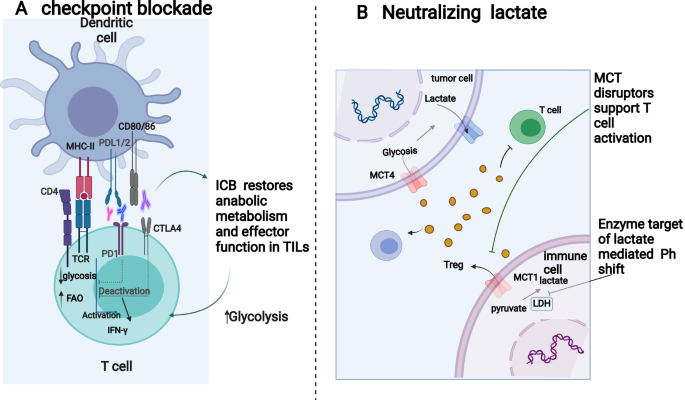
。例如,SASP与抗CTLA-4联合可增加效应T细胞频率和活性;CB-839与纳武利尤单抗联合可抑制NSCLC生长。产品关联:提到的关键产品包括FDA批准的SASP(抑制xCT)、临床阶段的CB-839(GSL1抑制剂)、Epacadostat(IDO1抑制剂),以及研究用糖酵解抑制剂2-DG。
4. Biomarker 研究及发现成果解析
Biomarker 定位与筛选逻辑
文献涉及的Biomarker分为两类:代谢相关分子(GLUT1、HK-II、PFKFB3、PKM2、LDH、xCT、GSL1、IDO1)和免疫细胞表型(Treg比例、MDSC比例、M2型TAM比例、DC成熟度)。筛选/验证逻辑为“细胞/动物模型筛选→临床样本验证→关联免疫治疗疗效”:首先通过细胞实验(如敲低GLUT1、PKM2)验证代谢分子与NSCLC代谢重编程的关联,再通过临床样本(肿瘤组织、血液)检测代谢分子的表达,分析其与患者生存率、免疫治疗响应率的相关性。
研究过程详述
Biomarker来源包括NSCLC细胞系(如A549、H1299)、裸鼠异种移植模型的肿瘤组织,以及临床患者的肿瘤组织和血液样本。验证方法包括:免疫组化或免疫印迹检测肿瘤组织中代谢分子(如GLUT1、HK-II)的表达;qRT-PCR检测代谢酶(如PFKFB3、PKM2)的mRNA水平;流式细胞术检测血液或肿瘤组织中免疫细胞表型(如CD4+Foxp3+Treg、CD11b+Gr-1+MDSC、CD68+CD206+M2型TAM);PET/CT检测患者的葡萄糖摄取(反映GLUT1功能)。特异性与敏感性数据:18F-FDG PET/CT检测NSCLC葡萄糖摄取的敏感性较高(高葡萄糖摄取可通过PET/CT精准识别);GLUT1高表达与NSCLC患者的放疗耐药和生存期缩短相关(van Baardwijk等研究显示GLUT1高表达患者的生存期显著缩短,P<0.05,文献未明确样本量);IDO1高表达与ICB治疗耐药相关(KEYNOTE-037研究显示Epacadostat与帕博利珠单抗联合在IDO1高表达患者中疗效更好)。
核心成果提炼
代谢相关Biomarker(如GLUT1、IDO1)可作为NSCLC代谢重编程的标志,预测免疫治疗疗效——例如IDO1高表达提示ICB耐药,GLUT1高表达提示放疗联合免疫治疗的响应率低;免疫细胞表型Biomarker(如Treg/MDSC比例、M2型TAM比例)可反映TME的免疫抑制状态,指导治疗方案选择——Treg比例高的患者更适合联合代谢抑制剂降低免疫抑制。创新性在于首次系统总结了代谢Biomarker与免疫治疗疗效的直接关联,为NSCLC患者的免疫治疗分层提供了依据。统计学结果:van Baardwijk等研究中GLUT1高表达患者的生存期显著缩短(P<0.05,文献未明确样本量);KEYNOTE-037研究中Epacadostat联合帕博利珠单抗治疗IDO1高表达患者的客观缓解率(ORR)较IDO1低表达患者高(文献未明确具体数值)。
