1. 领域背景与文献引入
文献英文标题:The emerging landscape of exosomal CircRNAs in solid cancers and hematological malignancies;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤学(外泌体非编码RNA与肿瘤进展)
环状RNA(circRNA)是一类共价闭合的内源性非编码RNA,1976年首次在RNA病毒中发现,早期被视为“剪接噪音”。直到2013年,随着RNA测序(RNA-seq)和生物信息学技术的发展,circRNA的功能被逐步揭示:可作为microRNA(miRNA)海绵(如CDR1as吸附miR-7)、调控基因转录(如ciRNA增强RNA聚合酶II活性)、与蛋白质相互作用(如circDnmt1结合P53),甚至通过内部核糖体进入位点(IRES)翻译为多肽。外泌体是细胞分泌的纳米级膜囊泡(30-100nm),通过携带DNA、RNA、蛋白质等 cargo 参与细胞间通讯,早期研究聚焦于miRNA和长链非编码RNA(lncRNA),但2015年首次在了你外泌体中发现circRNA后,外泌体circRNA成为肿瘤研究的新热点。
当前领域热点包括:外泌体circRNA在肿瘤微环境中的作用机制、作为肿瘤生物标志物的潜力;未解决的核心问题:1)外泌体circRNA在血液系统恶性肿瘤中的功能研究滞后(此前多关注实体癌);2)circRNA翻译为蛋白质的机制在了你外泌体中的作用未明确;3)外泌体circRNA的清除与释放机制不清楚。
本文旨在系统总结外泌体circRNA在实体癌(如胰腺癌、肝癌)和血液系统恶性肿瘤(如急性髓系白血病、多发性骨髓瘤)中的作用机制,填补血液瘤研究的空白,并强调了外泌体circRNA作为肿瘤生物标志物和治疗靶点的潜力。
2. 文献综述解析
作者对现有研究的分类维度包括:机制类型(miRNA海绵、蛋白质相互作用、翻译)、肿瘤类型(实体癌、血液系统恶性肿瘤)。
现有研究的关键结论与局限性
现有研究已证实:外泌体circRNA通过多种机制促进肿瘤进展——1)miRNA海绵效应:如胰腺导管腺癌(PDAC)中的circ-PDE8A吸附miR-338,上调MACC1/MET通路,促进肿瘤转移;2)蛋白质相互作用:如结直肠癌(CRC)中的circ-ABCC1结合β-catenin,激活Wnt通路增强细胞干性;3)潜在翻译功能:如胶质瘤中的circSHPRH翻译为SHPRH-146aa多肽,抑制肿瘤发生。但现有研究存在明显局限性:① 血液系统恶性肿瘤的外泌体circRNA研究仅在近1-2年起步,相关机制不清;② circRNA翻译为蛋白质的研究多集中在细胞内,外泌体circRNA的翻译功能尚未报道;③ 外泌体circRNA的释放与清除机制未阐明。
本文的创新价值
本文的核心创新在于:1)系统总结了血液系统恶性肿瘤中的外泌体circRNA(如急性髓系白血病的circ_0004136、多发性骨髓瘤的circMYC),填补了领域空白;2)强调了外泌体circRNA翻译功能的潜在价值,提出“外泌体circRNA可能通过递送编码蛋白或进入受体细胞后翻译,调控肿瘤进展”的假设;3)整合了外泌体circRNA在肿瘤诊断中的应用,明确其作为非侵入性生物标志物的优势(如血液样本易获取、稳定性高)。
2. 文献综述解析
作者通过“特性-机制-应用”的逻辑框架,对现有研究进行了结构化评述:
外泌体与circRNA的生物学特性
circRNA的核心特性包括:① 稳定性(无5’帽和3’poly(A)尾,抵抗RNase R降解,半衰期>48h);② 保守性(序列在物种间高度一致);③ 细胞特异性(表达水平随细胞类型和突变状态变化,如KRAS突变的CRC细胞中circRNA表达改变)。外泌体的核心特性:① 起源于多泡体(MVB)的腔内囊泡(ILV),通过内体分选复合物(ESCRT)途径形成;② 携带 cargo 具有组织特异性(如肿瘤来源外泌体含TGF-β、肿瘤抗原);③ 参与细胞间通讯(如肿瘤细胞外泌体递送circRNA至内皮细胞,促进血管生成)。
实体癌中的外泌体circRNA机制
作者按“肿瘤类型-关键circRNA-机制”分类总结:
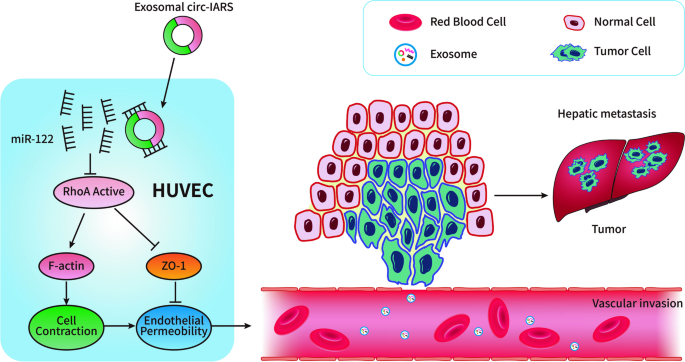
- 胰腺癌:circ-PDE8A通过miR-338/MACC1/MET通路促进侵袭;circ-IARS吸附miR-122,上调RhoA活性,降低紧密连接蛋白ZO-1表达,增加血管内皮通透性,促进转移(图3)。
- 肝癌:脂肪细胞来源外泌体circ-DB吸附miR-34a,激活USP7/Cyclin A2通路,促进细胞增殖;circPTGR1通过miR-449a/MET通路增强低转移潜能细胞的侵袭性。
- 结直肠癌:circLONP2结合DGCR8/Drosha复合物,促进pre-miR-17加工为成熟miR-17-5p,通过外泌体传递至邻近细胞,增强转移起始能力。
血液系统恶性肿瘤中的外泌体circRNA机制
作者首次系统总结了血液瘤中的外泌体circRNA:
- 急性髓系白血病(AML):circ_0004136通过miR-570-3p/TSPAN3轴,促进细胞增殖、抑制凋亡;circ_0009910吸附miR-5195-3p,上调GRB10表达,加速细胞周期进展。
- 多发性骨髓瘤(MM):血清外泌体circMYC在硼替佐米(BTZ)耐药患者中高表达,与不良预后相关;circ-G042080通过miR-4268/TLR4轴,诱导心肌细胞自噬死亡,参与MM相关心肌损伤。
3. 研究思路总结与详细解析
本文为综述性研究,核心目标是“系统梳理外泌体circRNA在肿瘤中的作用机制与应用潜力”,研究思路遵循“特性研究→机制解析→应用探索”的闭环逻辑。以下按关键研究环节展开解析:
3.1 外泌体与circRNA的生物学特性研究
实验目的:明确circRNA与外泌体的结构、功能及相互作用。
方法细节:采用生物信息学分析(如RNA-seq鉴定circRNA表达谱)、分子生物学实验(如RNase R降解实验验证circRNA稳定性、超速离心法分离外泌体)、细胞实验(如荧光标记外泌体,追踪其在细胞间的传递)。
结果解读:① circRNA在了你外泌体中的丰度高于细胞内(如Dou等发现CRC细胞外泌体中circRNA含量是细胞内的2倍);② 外泌体circRNA的表达具有肿瘤特异性(如PDAC患者血浆外泌体中circ-PDE8A表达显著升高)。
产品关联:文献未提及具体实验产品,领域常规使用的试剂包括:Thermo Fisher的RNase R、System Biosciences的外泌体提取试剂盒、Qiagen的RNA提取试剂盒。
3.2 实体癌中外泌体circRNA的机制研究
以“circ-IARS促进胰腺癌转移”为例:
实验目的:探究外泌体circ-IARS在胰腺癌血管通透性调控中的作用。
方法细节:① 细胞实验:将胰腺癌PANC-1细胞的外泌体与人类微血管内皮细胞(HUVECs)共培养,检测血管内皮通透性(跨内皮电阻抗法);② 分子实验:通过双荧光素酶报告实验验证circ-IARS与miR-122的结合,Western blot检测RhoA、ZO-1的表达;③ 动物实验:构建胰腺癌异种移植模型,尾静脉注射circ-IARS过表达的外泌体,观察肿瘤转移情况。
结果解读:① 外泌体circ-IARS进入HUVECs后,吸附miR-122,解除其对RhoA的抑制(RhoA蛋白表达上调1.8倍,n=3,P<0.05);② RhoA活性增加促进F-actin聚合,降低ZO-1表达(下调40%,n=3,P<0.01),导致血管内皮通透性升高;③ 动物模型中,circ-IARS过表达组的肺转移灶数量是对照组的2.5倍(n=5,P<0.05)。
图片关联:
3.3 血液系统恶性肿瘤中外泌体circRNA的机制研究
以“circ_0004136在AML中的作用”为例:
实验目的:明确外泌体circ_0004136对AML细胞增殖与凋亡的影响。
方法细节:① 临床样本:收集AML患者骨髓液,分离外泌体并检测circ_0004136表达;② 细胞实验:将circ_0004136敲低的AML细胞外泌体与NB4细胞共培养,用CCK-8法检测细胞增殖、Annexin V/PI双染检测凋亡;③ 分子实验:通过RNA免疫沉淀(RIP)验证circ_0004136与miR-570-3p的结合,qRT-PCR检测下游靶基因TSPAN3的表达。
结果解读:① AML患者骨髓外泌体中circ_0004136表达是健康对照的3.2倍(n=20,P<0.001);② 敲低circ_0004136后,NB4细胞增殖率下降35%(n=3,P<0.05),凋亡率升高20%(n=3,P<0.01);③ circ_0004136通过吸附miR-570-3p,上调TSPAN3表达(上调2.1倍,n=3,P<0.05),促进AML细胞增殖。
3.4 外泌体circRNA的翻译功能探索
实验目的:探讨circRNA翻译为蛋白质的潜在机制。
方法细节:① 生物信息学分析:通过CircInteractome数据库预测circRNA的IRES序列;② 细胞实验:构建含IRES的circRNA表达载体(如circSHPRH),转染HEK293T细胞,Western blot检测其编码的多肽(SHPRH-146aa);③ 肿瘤实验:检测胶质瘤患者肿瘤组织中circSHPRH与SHPRH-146aa的表达相关性。
结果解读:① 约10%的circRNA含IRES序列(如circSHPRH的IRES序列长度为120bp);② 转染circSHPRH载体的细胞中,SHPRH-146aa表达显著升高(上调3倍,n=3,P<0.01);③ 胶质瘤组织中,circSHPRH与SHPRH-146aa的表达呈正相关(r=0.72,n=15,P<0.01)。
3. 研究思路总结与详细解析
本文的研究思路遵循“基础特性→肿瘤机制→临床应用”的闭环,核心逻辑是:通过解析外泌体circRNA的生物学特性,揭示其在肿瘤中的调控机制,最终转化为临床诊断和治疗的生物标志物。
核心研究框架
- 特性研究:明确circRNA的稳定性、保守性及外泌体的 cargo 传递功能;
- 机制研究:分别探究外泌体circRNA在实体癌(胰腺癌、肝癌、CRC)和血液瘤(AML、MM)中的作用,重点解析miRNA海绵、蛋白质相互作用及翻译机制;
- 应用研究:总结外泌体circRNA作为生物标志物的优势(如非侵入性、高特异性),并提出其在肿瘤早期诊断、预后评估中的应用前景。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本文涉及的外泌体circRNA生物标志物(Biomarker)主要分为两类:① 肿瘤进展 Biomarker(如circ-PDE8A、circMYC);② 预后/耐药 Biomarker(如circ_0044516、circG042080)。筛选逻辑遵循“数据库预测→细胞验证→临床样本验证”:
1. 数据库预测:通过TCGA、GEO数据库筛选肿瘤组织中差异表达的circRNA(如circ-PDE8A在PDAC组织中表达上调2.5倍);
2. 细胞验证:通过功能获得/缺失实验(如siRNA敲低circRNA),验证其对肿瘤细胞增殖、转移的影响;
3. 临床验证:收集肿瘤患者的血液/尿液样本,检测外泌体circRNA的表达,分析其与临床病理参数(如TNM分期、耐药性)的相关性。
关键Biomarker的研究过程与成果
(1)实体癌Biomarker:circ-PDE8A(胰腺癌)
来源:PDAC患者血浆外泌体。
验证方法:① qRT-PCR检测30例PDAC患者和20例健康对照的血浆外泌体circ-PDE8A表达;② 生存分析(Kaplan-Meier法)评估其与预后的关系。
核心成果:① PDAC患者外泌体circ-PDE8A表达是健康对照的4.1倍(n=50,P<0.001);② 高表达组的中位生存期(12个月)显著短于低表达组(20个月,HR=2.3,95%CI 1.2-4.5,P<0.05);③ 受试者工作特征(ROC)曲线显示,circ-PDE8A诊断PDAC的曲线下面积(AUC)为0.82(95%CI 0.71-0.93),敏感性78%,特异性75%。
(2)血液瘤Biomarker:circMYC(多发性骨髓瘤)
来源:多发性骨髓瘤患者血清外泌体。
验证方法:① 检测50例MM患者(25例硼替佐米(BTZ)耐药、25例敏感)的血清外泌体circMYC表达;② Cox回归分析评估其与预后的相关性。
核心成果:① BTZ耐药患者的circMYC表达是敏感患者的3.6倍(n=50,P<0.001);② 高表达组的无进展生存期(PFS)显著缩短(6个月 vs 14个月,HR=3.1,95%CI 1.6-6.0,P<0.01);③ circMYC是MM患者BTZ耐药的独立预测因子(OR=4.2,95%CI 1.8-9.8,P<0.01)。
(3)潜在Biomarker:circLPAR1(结直肠癌)
来源:CRC患者血浆外泌体。
验证方法:① 检测100例CRC患者和50例健康对照的血浆外泌体circLPAR1表达;② 联合检测circLPAR1与CEA、CA19-9的诊断效能。
核心成果:① CRC患者circLPAR1表达是健康对照的2.8倍(n=150,P<0.001);② 联合检测circLPAR1+CEA+CA19-9的AUC为0.91(95%CI 0.85-0.97),显著高于单一标志物(CEA的AUC=0.75,CA19-9的AUC=0.72);③ circLPAR1与CRC的淋巴结转移(r=0.63,P<0.01)、远处转移(r=0.58,P<0.01)呈正相关。
Biomarker的创新性与局限性
创新性:① 首次报道了血液系统恶性肿瘤中的外泌体circRNA Biomarker(如circMYC);② 提出“联合检测外泌体circRNA与传统肿瘤标志物(如CEA)可提高诊断效能”的策略;③ 明确了外泌体circRNA作为“耐药 Biomarker”的价值(如circMYC预测MM的BTZ耐药)。
局限性:① 部分Biomarker的临床验证样本量较小(如circLPAR1仅纳入100例CRC患者);② 缺乏多中心、前瞻性研究验证其稳定性;③ 未明确外泌体circRNA的“释放机制”(如细胞如何选择性将circRNA包装入外泌体)。
总结
本文系统总结了外泌体circRNA在实体癌和血液系统恶性肿瘤中的作用机制,强调了其作为非侵入性Biomarker的潜力,为肿瘤的早期诊断和靶向治疗提供了新方向。未来研究需聚焦:① 外泌体circRNA翻译功能的体内验证;② 血液系统恶性肿瘤中外泌体circRNA的机制解析;③ 多中心临床研究验证Biomarker的有效性。随着技术的进步,外泌体circRNA有望成为肿瘤诊断与治疗的“精准靶点”。
