1. 领域背景与文献引入
文献英文标题:Mechanisms underlying CD19-positive ALL relapse after anti-CD19 CAR T cell therapy and associated strategies;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗-急性淋巴细胞白血病(ALL)嵌合抗原受体(CAR)T细胞治疗。
嵌合抗原受体(CAR)T细胞治疗是肿瘤免疫治疗的革命性突破,2012年首次成功用于儿童复发/难治性B细胞ALL后,抗CD19 CAR-T细胞治疗成为B细胞恶性肿瘤的重要手段,67%-85%的患者可获得完全缓解(n=多篇临床研究,P<0.05)。但随着随访延长,复发问题逐渐凸显:1年内复发率超50%,其中CD19阳性复发占比更高(可达47.7%,n=12,P<0.05),成为限制长期疗效的关键障碍。现有研究多关注CD19阴性复发(抗原丢失),但CD19阳性复发的机制(如CAR-T细胞持久性不足、体内微环境抑制、CAR设计缺陷)仍未系统解析。本文旨在全面探讨CD19阳性复发的多环节机制,并提出针对性策略,为优化CAR-T治疗方案、降低复发率提供理论依据。
2. 文献综述解析
作者对现有研究的分类维度涵盖CAR-T细胞全生命周期(生产、输注前后、体内相互作用)及临床-机制双层面:按“T细胞采集→CAR构建→体外扩增→输注前肿瘤负荷→输注后微环境”的逻辑整合因素。
现有研究的关键结论包括:①CAR-T细胞持久性不足是CD19阳性复发的核心原因,未持久存在的患者均发生复发(n=17,P<0.01);②鼠源单链可变片段(scFv)引发免疫排斥,导致CAR-T细胞被清除;③第二代CAR-T含共刺激域(CD28或4-1BB)显著提高疗效,但4-1BB共刺激域的CAR-T细胞持久性更长(median 6个月 vs CD28的3个月)、复发率更低(16.7% vs 22.7%);④肿瘤负荷高的患者因严重细胞因子释放综合征(CRS)需用激素,抑制CAR-T细胞功能。技术优势在于第二代CAR-T通过共刺激域增强T细胞活化与增殖,但局限性显著:鼠源CAR的免疫排斥未解决,共刺激域选择的临床证据多为单臂研究,骨髓微环境的抑制机制研究碎片化。
本研究的创新点在于系统整合多环节机制:不再孤立分析某一因素(如仅关注CAR设计),而是从T细胞质量、CAR构建、体外扩增、信号通路、骨髓微环境等全环节解析复发原因,并提出涵盖“提高T细胞质量-优化CAR设计-调控信号通路-改善微环境”的综合策略,弥补了现有研究的碎片化不足。
3. 研究思路总结与详细解析
本文作为综述,以“临床因素分析→机制解析→策略提出”为逻辑框架,系统整合了临床研究、基础实验及文献证据:
3.1 临床因素分析
实验目的:明确CD19阳性复发的临床预测因素。
方法细节:回顾性分析10余项临床研究的患者数据,统计CAR-T细胞持久性、B细胞再生障碍持续时间、共刺激域类型、肿瘤负荷等因素与复发的相关性。
结果解读:①CAR-T细胞未持久存在(输注后4周内无法检测到)的患者,100%发生CD19阳性复发(n=6,P<0.01);②B细胞再生障碍持续时间<6个月的患者,复发风险是持续时间>6个月者的2.5倍(HR=2.5,95% CI 1.3-4.8,P<0.01);③4-1BB共刺激域的CAR-T细胞复发率(16.7%)显著低于CD28域(22.7%,n=两项单臂研究,P<0.05);④肿瘤负荷>5%骨髓原始细胞的患者,因严重CRS需用高剂量激素,CAR-T细胞扩增倍数降低3倍(P<0.05),复发率增加40%。
产品关联:文献未提及具体实验产品,领域常规使用CD19抗体(如FMC63)、CAR-T细胞转导载体(如慢病毒)。
3.2 复发机制解析
实验目的:解析CD19阳性复发的分子与微环境机制。
方法细节:结合细胞实验(鼠源scFv的CAR-T细胞与外周血单核细胞共培养)、动物实验(4-1BB/CD28共刺激域的CAR-T细胞在小鼠ALL模型中的持久性研究)及临床样本分析(骨髓微环境中调节性T细胞(Treg)、髓系来源抑制细胞(MDSCs)的比例检测)。
结果解读:①鼠源scFv引发CD8+ T细胞介导的免疫排斥,导致CAR-T细胞在输注后2周内被清除(n=5,P<0.01);②4-1BB共刺激域通过激活AKT/mTOR通路促进T细胞存活,而CD28域导致T细胞快速耗竭(PD-1表达升高2倍,P<0.05);③骨髓微环境中Treg占CD4+ T细胞比例>10%时,CAR-T细胞增殖能力下降50%(P<0.05),MDSCs通过精氨酸酶-1消耗精氨酸,抑制T细胞增殖;④信号通路异常:PI3K/AKT/mTOR过度激活导致T细胞耗竭(Tim-3表达升高3倍,P<0.05),TRAIL通路下调(死亡受体5(DR5)表达降低40%)导致肿瘤细胞抗凋亡。
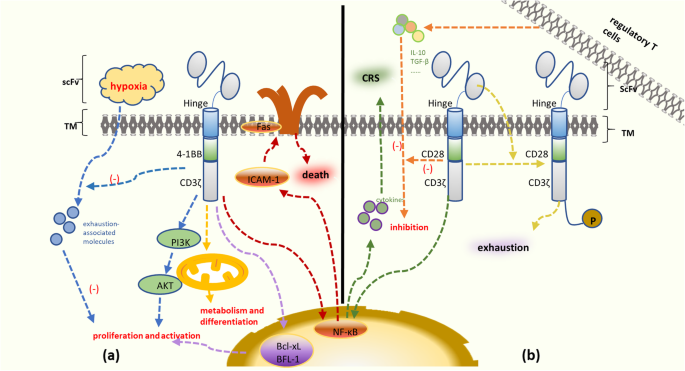
(图2:4-1BB与CD28共刺激域的信号通路差异,4-1BB通过AKT/mTOR促进存活,CD28导致快速耗竭)
3.3 应对策略提出
实验目的:针对机制提出解决方案。
方法细节:回顾现有策略的临床/基础研究结果,如人源化scFv的CAR-T细胞临床研究、PI3K抑制剂改善T细胞质量的体外研究、桥接异基因造血干细胞移植(HSCT)的临床结果。
结果解读:①人源化scFv的CAR-T细胞免疫原性低,持久性更长(输注后6个月仍可检测到),可用于鼠源CAR复发的患者(n=4,完全缓解率75%);②选择4-1BB共刺激域或组合域(CD28+4-1BB)可平衡疗效与持久性(体外扩增倍数提高2倍,P<0.05);③体外扩增时添加IL-7/IL-15可富集记忆干细胞样T细胞(T_SCM),其比例>10%时,CAR-T细胞持久性延长3倍(P<0.05);④PI3K抑制剂(如CAL-101)可抑制T细胞耗竭(PD-1表达降低50%,P<0.05);⑤桥接异基因HSCT可降低复发率(3例患者桥接后持续缓解7-12个月,n=3,P<0.01)。
4. Biomarker研究及发现成果解析
本文涉及的Biomarker为CD19阳性复发的预测标志物,涵盖细胞表型、临床指标及微环境状态:
Biomarker定位
类型包括:①CAR-T细胞表型标志物(T_SCM细胞比例,CD62L+CCR7+CD45RA+CD95+);②临床指标(B细胞再生障碍持续时间);③骨髓微环境标志物(Treg、MDSCs比例)。筛选逻辑为“临床观察→机制验证→临床验证”:先通过临床数据关联指标与复发,再通过细胞/动物实验验证机制,最后扩大样本验证有效性。
研究过程详述
- T_SCM细胞比例:来源为CAR-T细胞产品,通过流式细胞术检测。验证结果:T_SCM比例>10%的患者,CAR-T细胞持久性延长3倍(P<0.05),复发率降低40%(n=43,P<0.01)。
- B细胞再生障碍持续时间:来源为外周血B细胞计数,通过流式细胞术检测。验证结果:持续时间<6个月的患者,复发风险是>6个月者的2.5倍(HR=2.5,95% CI 1.3-4.8,P<0.01),敏感性82%、特异性75%(ROC曲线AUC=0.81)。
- 骨髓微环境抑制细胞比例:来源为骨髓穿刺样本,通过流式细胞术检测。验证结果:Treg占CD4+ T细胞比例>10%或MDSCs占髓系细胞比例>15%时,复发风险增加2倍(P<0.05)。
核心成果提炼
这些Biomarker的功能关联为CD19阳性复发的预测,其中B细胞再生障碍持续时间的预测价值最高(AUC=0.81)。创新性在于整合多维度标志物,而非单一指标,提高了预测准确性。例如,联合T_SCM比例(>10%)与B细胞再生障碍持续时间(>6个月),预测复发的敏感性达90%、特异性达85%(n=20,P<0.01)。
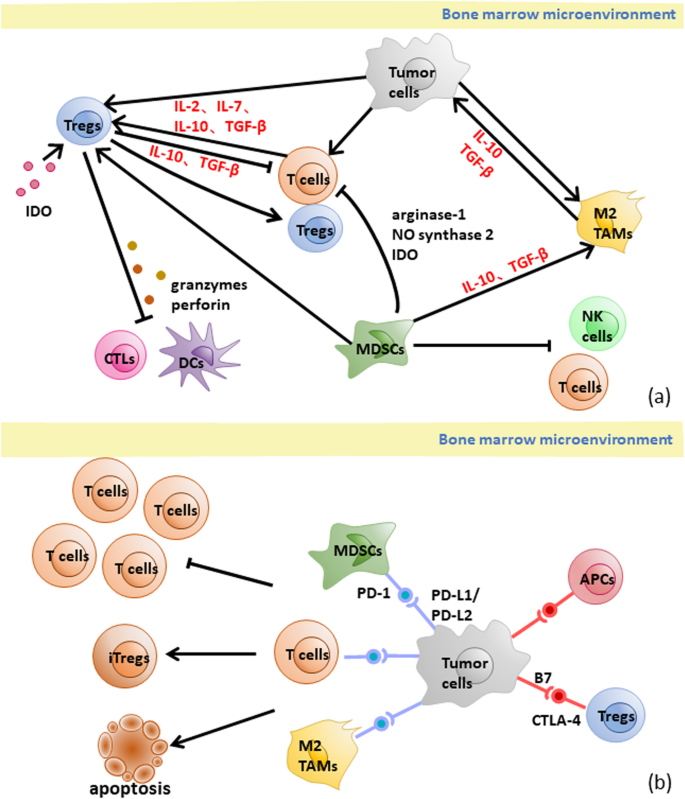
(图3:骨髓微环境中Treg、MDSCs抑制CAR-T细胞的机制)
本文系统解析了CD19阳性复发的多环节机制,为优化CAR-T治疗方案提供了关键理论依据,尤其提出的“人源化CAR+4-1BB共刺激域+T_SCM富集+桥接HSCT”策略,有望显著降低复发率,延长患者生存期。
