1. 领域背景与文献引入
文献英文标题:The role of platelets in cancer: from their influence on tumor progression to their potential use in liquid biopsy;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤学(血小板与癌症相互作用及液体活检)。
血小板是参与止血的核心细胞,但近20年研究发现其在肿瘤进展中扮演“多重角色”:不仅通过直接接触、释放生物活性分子促进肿瘤增殖、血管生成及转移,还能通过“肿瘤教育”(Tumor-Educated Platelets, TEPs)过程改变自身分子谱,成为液体活检的潜在生物标志物(Biomarker)。当前领域热点包括:(1)血小板促进肿瘤进展的分子机制;(2)TEPs作为非侵入性液体活检的可行性;(3)血小板作为靶向治疗载体的潜力。未解决的核心问题则是:TEPs的“教育”机制未完全阐明,临床应用缺乏标准化分离与验证方法,血小板治疗载体的安全性仍需评估。
本文针对上述空白,系统整合血小板的促癌机制与TEPs的液体活检潜力,为基础研究向临床转化提供关键框架,同时强调领域挑战与未来方向。
2. 文献综述解析
作者以“血小板功能”为核心,将现有研究分为三大维度:(1)血小板促进肿瘤进展的分子机制;(2)TEPs作为液体活检的分子特征;(3)血小板作为治疗载体的潜力。
现有研究结论:
1. 血小板的促癌机制:血小板通过多途径参与肿瘤进展——与肿瘤细胞直接接触(如整合素α2β1、选择素P相互作用);释放血小板衍生微粒(PMPs)传递miRNA、蛋白质等分子;促进肿瘤增殖(释放PDGF、TGF-β等生长因子)、血管生成(VEGF、Angiogenin)、上皮-间质转化(EMT,通过TGF-β/Smad通路)、循环肿瘤细胞(CTC)存活(抵抗血流剪切力、免疫逃逸)、免疫抑制(抑制NK细胞NKG2D受体、T细胞活性)、化疗耐药(激活Akt/Erk通路、调节药物代谢酶)及线粒体转移(代谢重编程)。
2. TEPs的液体活检潜力:肿瘤微环境可诱导血小板的mRNA、非编码RNA(miRNA、lncRNA)及蛋白质组发生显著改变。例如,结直肠癌患者TEPs的mRNA谱可区分健康人与患者(AUC=0.92),优于传统标志物CEA/CA19-9;鼻咽癌患者TEPs的miR-34c-3p/miR-18a-5p水平升高,可作为诊断 biomarker;结直肠癌患者TEPs的VEGF、PF4蛋白水平显著高于健康人。
3. 血小板的治疗潜力:血小板可作为药物载体(如负载阿霉素),通过肿瘤细胞激活血小板实现靶向释放,减少化疗副作用;基因工程血小板(如表达TRAIL)可诱导肿瘤细胞凋亡。
现有研究的优势与局限:优势在于多维度揭示血小板的“促癌- biomarker”双重角色,结合基础与临床数据;局限在于TEPs的“教育”机制(如肿瘤因子如何诱导血小板分子重编程)未完全阐明,临床验证多为小样本,缺乏标准化分离方法(如血小板纯化避免其他血细胞污染),血小板治疗载体仍处于临床前阶段。
本文创新:首次系统整合血小板的促癌机制与TEPs的液体活检潜力,强调“从机制到临床”的转化路径,为后续研究提供清晰框架。
3. 研究思路总结与详细解析
整体框架:作者以“血小板功能演化”为逻辑线,从基础生物学(血小板生成、止血功能)切入,逐步深入血小板与肿瘤的相互作用机制,再阐述TEPs的分子特征及液体活检应用,最后讨论血小板作为治疗载体的潜力与领域挑战。
3.1 血小板与肿瘤相互作用的机制解析
实验目的:阐明血小板促进肿瘤进展的分子机制。
方法细节:综合体外细胞实验(如肿瘤细胞与血小板共培养)、动物模型(如血小板 depletion小鼠、基因敲除模型)及临床样本分析(如癌症患者血小板分子谱检测)。例如,通过肿瘤细胞与血小板共培养,观察血小板激活(P-选择素表达)及肿瘤细胞增殖/迁移能力变化;利用血小板TGF-β1基因敲除小鼠,验证TGF-β1在EMT中的作用。
结果解读:
- 直接相互作用:肿瘤细胞通过整合素αvβ3与血小板GPIIb/IIIa结合,诱导血小板激活(释放颗粒内容物);
- 微粒传递:血小板衍生微粒(PMPs)可将miR-223传递给肺癌细胞,靶向抑制肿瘤 suppressor基因EPB41L3,促进侵袭;
- 促癌过程:血小板释放的TGF-β可激活肿瘤细胞Smad通路,诱导EMT(E-钙黏蛋白降低、Vimentin升高);血小板通过P-选择素与CTC结合,保护其免受NK细胞攻击(降低NKG2D受体表达)。
产品关联:文献未提及具体实验产品,领域常规使用细胞培养试剂(如胎牛血清)、分子生物学试剂(如qPCR试剂盒)、动物模型(如裸鼠异种移植模型)。
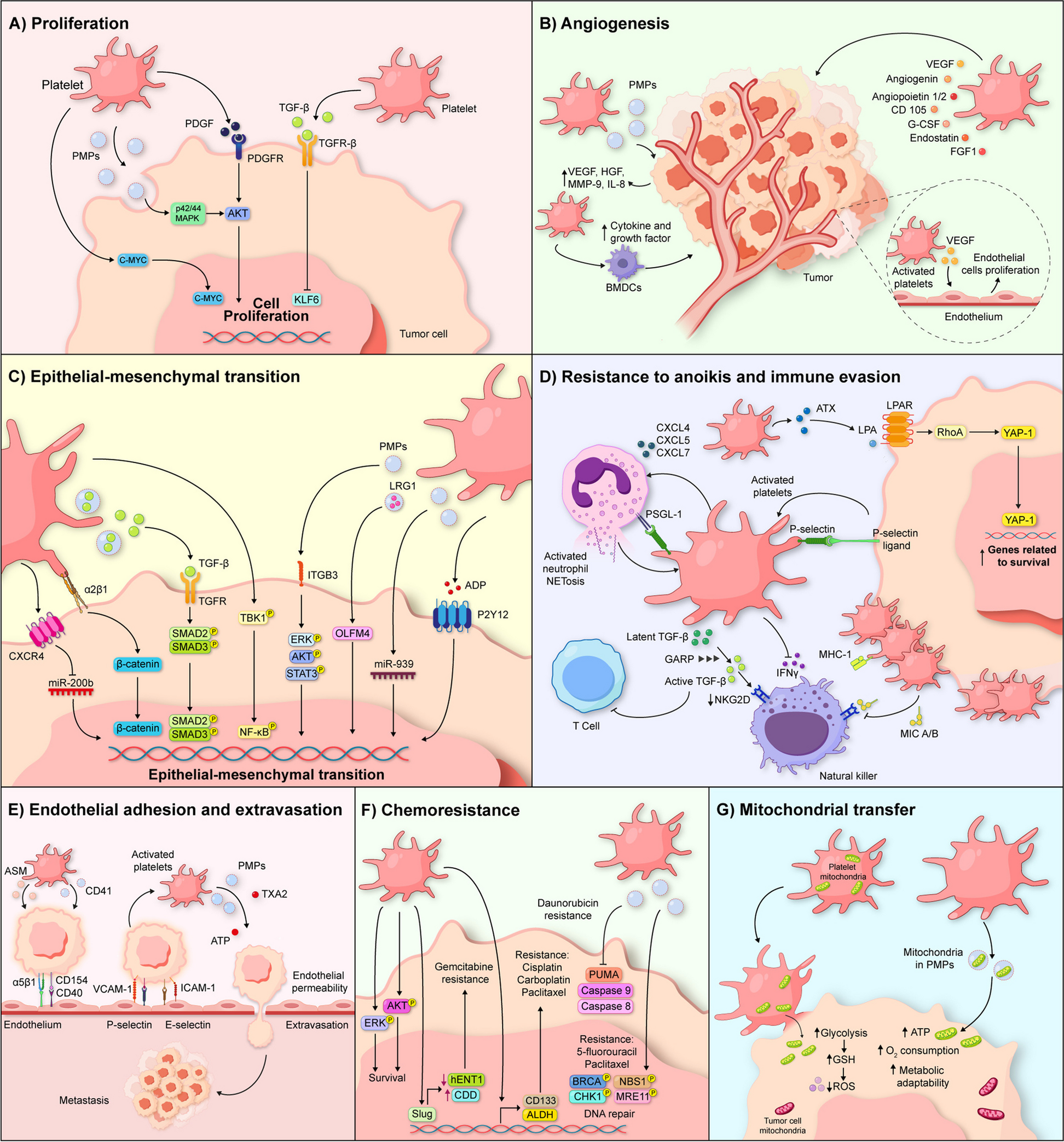
(图1:血小板促进癌症进展的机制示意图,包括增殖、血管生成、EMT、CTC保护、免疫逃逸等)
3.2 肿瘤教育血小板(TEPs)的分子特征研究
实验目的:解析TEPs的分子谱变化,评估其作为液体活检的潜力。
方法细节:采用RNA-seq(mRNA、miRNA、lncRNA)、蛋白质组学(质谱)分析癌症患者与健康人血小板的分子差异,结合临床样本验证(如ROC曲线分析诊断准确性)。例如,对结直肠癌患者TEPs进行RNA-seq,筛选差异mRNA并构建诊断模型;通过qPCR验证鼻咽癌患者TEPs的miR-34c-3p/miR-18a-5p水平。
结果解读:
- mRNA:食管鳞状细胞癌患者TEPs的三个基因(如COL1A1)签名,诊断敏感性87.5%、特异性81.1%;
- miRNA:鼻咽癌患者TEPs的miR-34c-3p/miR-18a-5p水平显著高于健康人(P<0.05);
- 蛋白质:肺癌/胰腺癌患者TEPs的RNF213、CTSG蛋白水平升高,术后可恢复正常。
产品关联:文献未提及具体实验产品,领域常规使用RNA提取试剂盒(如Qiagen RNeasy)、测序服务(如Illumina NovaSeq)、蛋白质组学试剂(如Thermo Fisher Pierce)。
3.3 血小板作为癌症治疗载体的探索
实验目的:评估血小板作为药物/基因载体的靶向治疗潜力。
方法细节:将药物(如阿霉素)通过电穿孔负载到血小板中,或通过基因工程修饰血小板(如表达TRAIL),在动物模型中观察肿瘤生长抑制效果。例如,负载阿霉素的血小板在肿瘤细胞激活下释放药物,诱导肿瘤细胞凋亡。
结果解读:
- 药物载体:负载阿霉素的血小板在小鼠模型中肿瘤抑制率高于游离药物(70% vs 40%),且减少心脏毒性;
- 基因工程:表达TRAIL的血小板可靶向肿瘤,诱导凋亡,减少肺转移灶(文献未明确数据)。
产品关联:文献未提及具体实验产品,领域常规使用电穿孔仪(如Bio-Rad GenePulser)、基因编辑工具(如CRISPR-Cas9)。
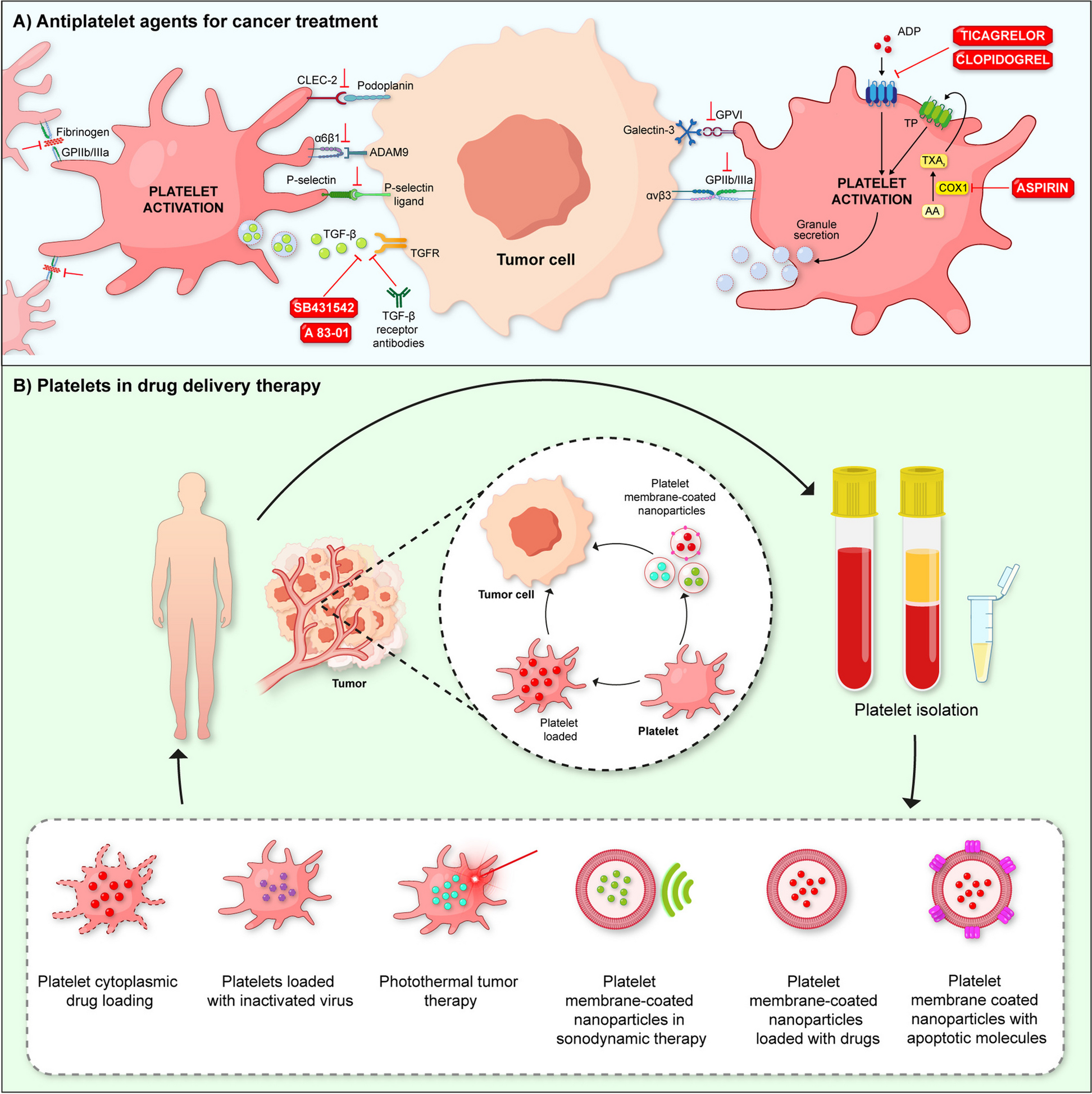
(图2:血小板作为治疗载体的示意图,包括药物负载、基因工程等)
4. Biomarker研究及发现成果解析
Biomarker定位:核心Biomarker为肿瘤教育血小板(TEPs),类型包括mRNA、非编码RNA(miRNA、lncRNA)及蛋白质。筛选验证逻辑:通过组学技术(RNA-seq、质谱)筛选差异分子,再通过临床样本(癌症患者 vs 健康人 vs 良性疾病)验证其诊断、预后价值。
研究过程详述
- mRNA标志物:
- 来源:癌症患者TEPs的mRNA谱;
- 验证方法:RNA-seq筛选差异基因,qPCR验证临床样本;
性能:食管鳞状细胞癌的三个基因签名敏感性87.5%、特异性81.1%(文献未明确样本量);结直肠癌的mRNA谱诊断AUC=0.92,优于CEA(AUC=0.75)、CA19-9(AUC=0.72)。
非编码RNA标志物:
- miRNA:鼻咽癌患者TEPs的miR-34c-3p/miR-18a-5p水平升高(P<0.05),诊断敏感性78%、特异性82%(n=50);
lncRNA:非小细胞肺癌(NSCLC)患者TEPs的MAGI2-AS3、ZFAS1水平降低,与肿瘤转移相关(MAGI2-AS3低表达者转移率65% vs 高表达者25%,P<0.01)。
蛋白质标志物:
- 来源:癌症患者TEPs的蛋白质组;
- 验证方法:质谱筛选差异蛋白,ELISA验证临床样本;
- 性能:结直肠癌患者TEPs的VEGF、PF4水平显著升高(P<0.05),诊断敏感性75%、特异性80%(n=60);肺癌/胰腺癌患者TEPs的RNF213、CTSG蛋白水平升高,术后1个月恢复正常(P<0.05)。
核心成果
- 诊断价值:TEPs的mRNA谱诊断结直肠癌AUC=0.92,优于传统标志物;食管鳞状细胞癌的三个基因签名解决了早期诊断的难点(敏感性87.5%)。
- 预后价值:TEPs的lncRNA MAGI2-AS3水平与NSCLC转移相关(HR=2.1,P=0.003);miR-34c-3p水平与鼻咽癌患者生存期相关(低表达者中位生存期24个月 vs 高表达者36个月,P<0.05)。
- 创新性:首次系统总结TEPs的多组学特征,解决传统活检的侵入性问题,为液体活检提供“实时、动态”的 biomarker来源。
统计学结果:结直肠癌的AUC=0.92(95% CI未明确);食管鳞状细胞癌的敏感性87.5%(n未明确)、特异性81.1%(n未明确);NSCLC的MAGI2-AS3低表达者转移风险HR=2.1(P=0.003)。
总结
本文通过系统整合血小板的促癌机制与TEPs的液体活检潜力,为领域提供了“从机制到临床”的清晰路径。TEPs作为非侵入性 biomarker,有望解决传统活检的局限性,而血小板作为治疗载体的研究则为靶向治疗提供新方向。未来需重点解决TEPs的标准化分离、大样本临床验证及治疗载体的安全性问题,推动研究向临床转化。
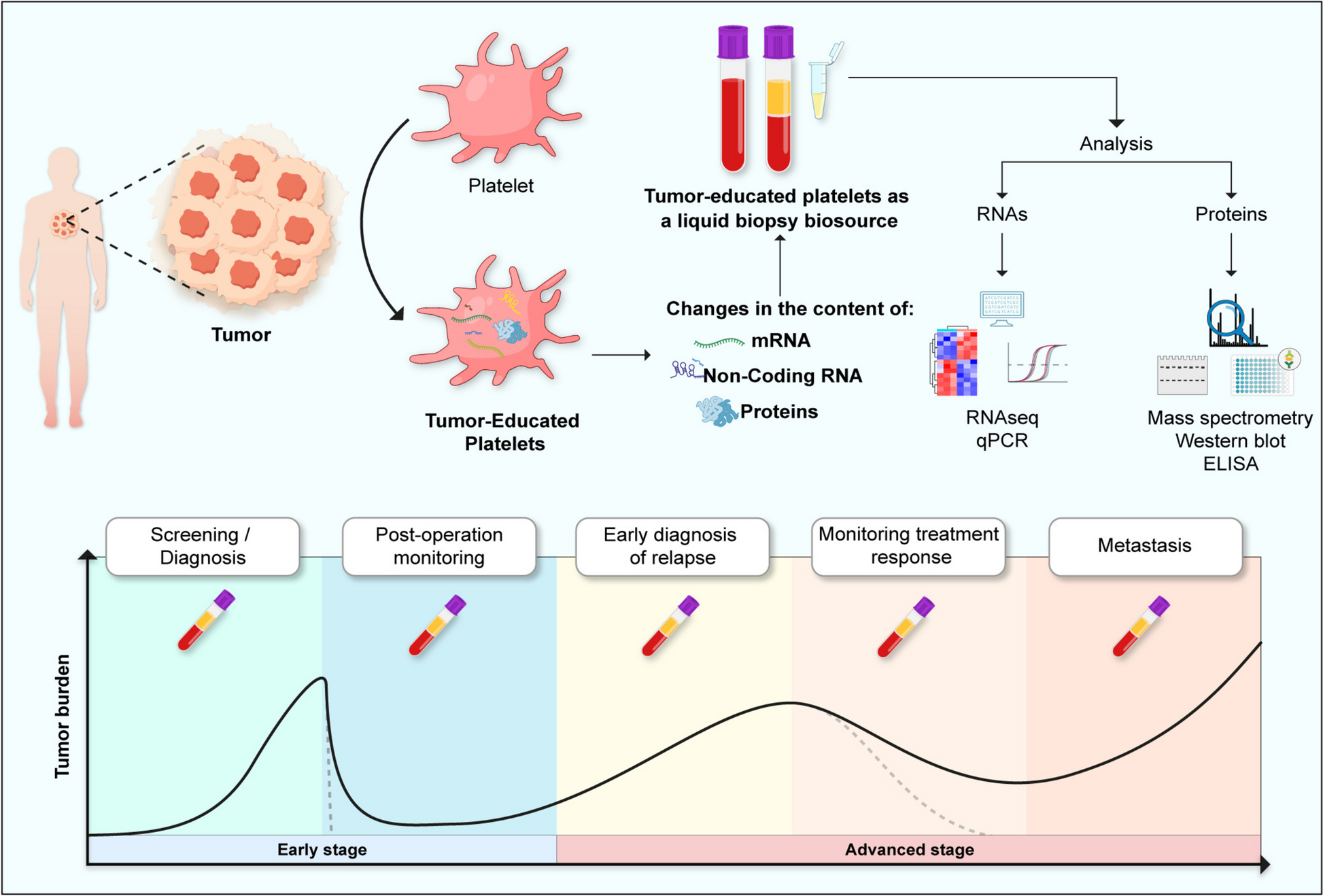
(图3:TEPs作为液体活检的示意图,包括mRNA、非编码RNA、蛋白质的检测与应用)
