1. 领域背景与文献引入
文献英文标题:Pediatric chronic myeloid leukemia with inv(3)(q21q26.2) and T lymphoblastic transformation: a case report;发表期刊:Biomarker Research;影响因子:未公开;研究领域:儿童慢性粒细胞白血病(CML)诊疗与分子标志物研究。
慢性粒细胞白血病(CML)是一类以骨髓粒系过度增殖为特征的髓系增殖性肿瘤,核心遗传学标志为t(9;22)(q34;q11)易位形成的BCR-ABL1融合基因。在成人白血病中,CML占比15%~20%,但儿童发病率极低,仅占所有儿童白血病的2%~3%。CML自然病程通常从慢性期(CP)进展至加速期(AP)或blast期(BP),儿童患者初诊时处于AP/BP的比例仅约5%,显著低于成人的15%。Blast期CML可呈现髓系或淋系分化特征,其中T淋巴母细胞转化(T淋系BP)尤为罕见。
额外染色体异常(ACAs)是CML疾病进展的重要遗传标志,如trisomy 8、isochromosome 17q等“major-route”异常已被证实与高危预后相关。近年来,3q26.2区域的MECOM基因重排(如inv(3)(q21q26.2))逐渐引起关注——在成人CML中,此类异常与酪氨酸激酶抑制剂(TKI)耐药及髓系BP密切相关,但从未在儿童CML中报道,也未发现其与T淋巴母细胞转化存在关联。
针对儿童CML中3q26.2异常的研究空白,以及inv(3)与T淋系转化的未知关系,本研究报道1例初诊时即存在inv(3)(q21q26.2)亚克隆及T淋巴母细胞转化的11岁男性CML患者,解析其临床特征、分子遗传学改变及TKI治疗反应,填补儿童CML中3q26.2异常的研究空缺,为儿童高危CML诊疗提供新线索。
2. 文献综述解析
作者对CML领域现有研究的评述逻辑围绕“人群差异(成人vs儿童)、染色体异常类型(major-route vs minor-route)、分子标志物(MECOM)临床意义”三个维度展开。现有研究的关键结论包括:①儿童CML发病率远低于成人,且初诊进展期比例更低;②“major-route” ACAs(如+8、i(17q))是CML高危预后的重要标志;③成人CML中,3q26.2区域MECOM基因重排(如inv(3))可导致MECOM过表达,与TKI耐药、髓系BP密切相关;④T淋巴母细胞转化在CML中极为罕见,且从未与3q26.2异常关联。
现有研究的局限性体现在:儿童CML中3q26.2异常的临床特征尚未明确,其与T淋巴母细胞转化的关系未知,且儿童患者对TKI的反应是否与成人存在差异缺乏数据支持。
本研究的创新价值在于:首次报道儿童CML患者中存在inv(3)(q21q26.2)异常,且首次发现该核型与T淋巴母细胞转化相关;同时观察到儿童患者对TKI单药治疗呈现早期强反应,与成人中inv(3)相关的TKI耐药特征形成对比,提示儿童CML的3q26.2异常可能具有独特生物学特征。
3. 研究思路总结与详细解析
本研究的整体框架为“病例临床特征收集→分子与细胞遗传学检测→MECOM与T淋母细胞共定位分析→TKI治疗反应监测→结果总结”,核心科学问题是“儿童CML中inv(3)(q21q26.2)的临床意义及与T淋巴母细胞转化的关系”,技术路线遵循“临床诊断→分子验证→功能关联→疗效评估”的闭环逻辑。
3.1 临床诊断与初始分子遗传学检测
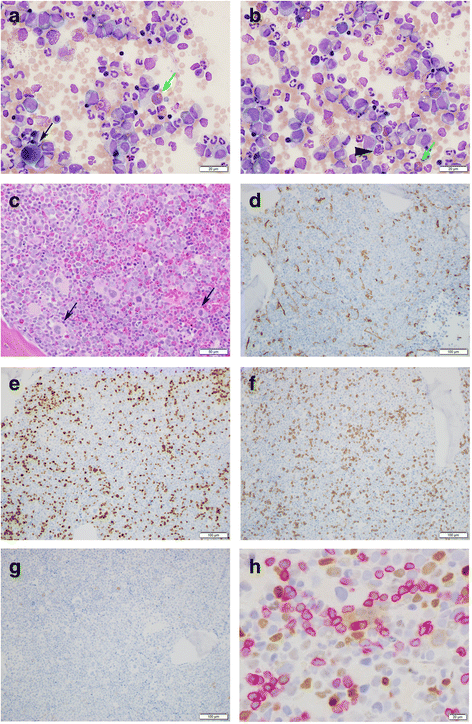
实验目的是明确患者的CML诊断及分子遗传学特征。方法细节为:收集11岁男性患者的临床资料(体重下降、颈部淋巴结肿大等症状,及白细胞升高、LDH增高等实验室指标);通过骨髓穿刺获取标本,进行形态学分析(Wright-Giemsa染色、HE染色)、流式细胞术(检测T淋巴母细胞标志物CD3、MPO、TDT)、外周血RT-PCR(检测BCR-ABL1 p210转录本)及骨髓细胞遗传学分析(常规染色体显带技术)。结果解读:骨髓形态学显示粒系各阶段细胞增多,eosinophils、basophils及dwarf巨核细胞增多;流式细胞术检测到9%的CD3+ MPO- TDT+ T淋巴母细胞;RT-PCR阳性提示BCR-ABL1 p210融合基因存在;细胞遗传学分析显示核型为46,XY,t(6;9;22)(p22;q34;q11.2)[9]/46,sl,inv(3)(q21q26.2)[11],即存在t(6;9;22)变体易位形成BCR-ABL1,且11/20的细胞携带inv(3)(q21q26.2)亚克隆。
产品关联:文献未提及具体实验产品,领域常规使用RT-PCR试剂盒(如QIAGEN的OneStep RT-PCR Kit)、细胞遗传学分析用Giemsa显带试剂盒。
3.2 MECOM与CD3的免疫组化共定位分析
实验目的是明确MECOM过表达细胞与T淋巴母细胞(CD3+)的关系。方法细节为:采用新型MECOM抗体(核染色)和CD3抗体(膜染色)对骨髓活检标本进行免疫组化双染。结果解读:双染结果显示MECOM阳性细胞(核棕褐色染色)与CD3+细胞(膜红色染色)无重叠(图1h),提示T淋巴母细胞转化与inv(3)(q21q26.2)亚克隆独立,即T淋母细胞未携带inv(3)异常。产品关联:文献提及“新型MECOM抗体”,但未明确品牌,领域常规使用免疫组化检测系统(如DAKO的EnVision™ Plus System)。
3.3 TKI治疗反应监测
实验目的是评估患者对TKI单药治疗的早期疗效。方法细节为:患者初始接受伊马替尼(500mg/d)治疗,后因口腔溃疡换用达沙替尼(100mg/d);分别在治疗第25天、第54天复查骨髓形态学和流式细胞术,第3个月时检测外周血BCR-ABL1转录本水平(qRT-PCR)。结果解读:第25天骨髓恢复三系造血,T淋巴母细胞比例降至1%;第54天T淋巴母细胞进一步降至0.02%;第3个月时BCR-ABL1转录本水平为4.3%(国际标准单位,IS),较基线下降1.4 log。产品关联:文献未提及具体实验产品,领域常规使用qRT-PCR试剂盒(如Thermo Fisher的TaqMan® Gene Expression Assays)。
4. Biomarker研究及发现成果解析
本研究涉及的Biomarker包括染色体异常inv(3)(q21q26.2)和分子标志物MECOM蛋白,筛选与验证逻辑为“细胞遗传学分析发现inv(3)→免疫组化验证MECOM表达→双染实验明确与T淋母细胞的独立性”。
研究过程详述:inv(3)(q21q26.2)来源于骨髓细胞的细胞遗传学分析,共检测20个细胞,其中11个细胞携带该异常(亚克隆比例55%);MECOM蛋白的验证采用免疫组化方法,核染色显示其在部分细胞中过表达;双染实验进一步证实MECOM阳性细胞与CD3+ T淋巴母细胞无重叠,说明二者属于独立亚克隆。特异性数据方面,inv(3)亚克隆仅存在于部分骨髓细胞中,而MECOM过表达细胞与T淋巴母细胞无交叉,提示inv(3)与T淋系转化无直接关联。
核心成果提炼:①首次在儿童CML患者中发现inv(3)(q21q26.2)异常,扩展了儿童CML额外染色体异常的谱库;②首次证实inv(3)(q21q26.2)相关的MECOM过表达与T淋巴母细胞转化独立,说明T淋系转化可能由其他机制驱动;③尽管成人CML中inv(3)与TKI耐药密切相关,但本患者接受TKI单药治疗3个月后,BCR-ABL1转录本水平降至4.3% IS(符合早期分子反应标准,EMR),提示儿童CML的inv(3)异常可能具有更优的TKI反应性。创新性方面,本研究填补了儿童CML中3q26.2异常的研究空白,为儿童高危CML的精准诊疗提供了新的分子标志物(inv(3)、MECOM)及治疗参考。统计学结果:inv(3)亚克隆比例为11/20(n=20);3个月时BCR-ABL1 IS值为4.3%(n=1,患者单次检测结果)。
