1. 领域背景与文献引入
文献英文标题:Molecular mechanisms and clinical applications of exosomes in prostate cancer;发表期刊:Biomarker Research;影响因子:5.517(2022年);研究领域:前列腺癌分子生物学与外泌体临床应用。
前列腺癌(Prostate Cancer, PC)是全球男性最常见的恶性肿瘤之一,2020年全球新发病例约141万,死亡约37万(GLOBOCAN 2020)。在中国,PC发病率呈逐年上升趋势,且多数患者确诊时已处于晚期,易进展为去势抵抗性前列腺癌(Castration-Resistant Prostate Cancer, CRPC),导致治疗失败。目前,前列腺特异性抗原(Prostate-Specific Antigen, PSA)是PC筛查和诊断的主要生物标志物,但由于其特异性较差(约25%的良性前列腺增生患者PSA升高),常导致过度诊断和不必要的前列腺穿刺。此外,CRPC患者对传统内分泌治疗(如阿比特龙)和化疗(如多西他赛)的响应率低,中位生存期仅12-18个月,亟需新的治疗靶点和生物标志物。
外泌体是一种由细胞分泌的纳米级囊泡(30-200 nm),携带核酸(miRNA、lncRNA、mRNA)、蛋白质(膜受体、酶)和脂质等生物活性分子,通过旁分泌或内分泌途径传递给受体细胞,调控其生物学功能。近年来,研究发现外泌体在PC进展中发挥关键作用,如介导上皮-间质转化(Epithelial-Mesenchymal Transition, EMT)、促进血管生成、重塑肿瘤微环境(Tumor Microenvironment, TME)、诱导化疗耐药等。然而,外泌体调控PC进展的具体分子机制仍不清楚,其作为PC生物标志物和治疗载体的临床应用也面临诸多挑战(如分离技术标准化、生物安全性评估)。因此,系统总结外泌体在PC中的分子机制和临床应用,对推动PC的精准诊断和治疗具有重要意义。
这篇发表于《Biomarker Research》的综述,基于近年外泌体和PC的研究进展,全面阐述了外泌体的生物发生、分离鉴定方法,及其在PC进展中的分子机制(EMT、血管生成、TME、耐药),并重点讨论了外泌体作为PC生物标志物和治疗载体的临床潜力,为该领域的后续研究提供了重要参考。
2. 文献综述解析
作者对现有研究的分类维度主要包括:(1)外泌体的基础研究(生物发生、分离鉴定技术);(2)外泌体在PC进展中的分子机制(EMT、血管生成、TME、耐药);(3)外泌体在PC临床应用中的研究(生物标志物、治疗载体)。
现有研究的关键结论
- 外泌体的基础研究:外泌体的生物发生主要通过内体途径,受内体分选复合物(Endosomal Sorting Complex Required for Transport, ESCRT)、Rab GTP酶(如Rab27a/b调控多泡体运输)和神经酰胺(如中性鞘磷脂酶2促进内 luminal 囊泡形成)调控。外泌体的分离技术包括超速离心(金标准)、微流控芯片(高效)、免疫捕获(高纯度);鉴定需结合形态学(透射电镜)、粒径分析(纳米颗粒跟踪分析)和标志物检测(CD63、CD9、TSG101)。
- 外泌体在PC进展中的机制:① 介导EMT:PC细胞外泌体携带miR-21、miR-100等,通过抑制PTEN、NF2等靶基因,激活FAK/ERK、PI3K/AKT通路,促进E-钙黏蛋白下调、波形蛋白上调;② 促进血管生成:外泌体携带血管内皮生长因子(Vascular Endothelial Growth Factor, VEGF)、miR-27a等,增强内皮细胞增殖、迁移和管形成;③ 重塑TME:PC细胞外泌体传递转化生长因子-β(Transforming Growth Factor-β, TGF-β)至成纤维细胞,诱导癌相关成纤维细胞(Cancer-Associated Fibroblasts, CAFs)形成;传递miR-95至肿瘤相关巨噬细胞(Tumor-Associated Macrophages, TAMs),诱导其向M2型极化;④ 介导耐药:耐药PC细胞外泌体传递窖蛋白-1(Caveolin-1)至敏感细胞,增强细胞膜稳定性,减少化疗药物摄入;传递miR-27a抑制p53表达,降低细胞凋亡。
- 外泌体的临床应用:① 生物标志物:尿液exosomal miR-141、血液exosomal ephrinA2等可用于PC的早期诊断和预后评估;② 治疗载体:工程化外泌体(如修饰前列腺特异性膜抗原靶向肽、负载紫杉醇)可精准递送药物至PC细胞;外泌体疫苗(如树突状细胞来源外泌体加载肿瘤抗原)可诱导T细胞活化,抑制肿瘤生长。
现有研究的优势与局限性
优势:揭示了外泌体在PC进展中的多重作用,为PC的发病机制提供了新视角;局限性:① 外泌体调控PC的分子机制多基于细胞和动物实验,临床验证不足;② 外泌体的分离和鉴定技术复杂、成本高,难以规模化应用;③ 外泌体生物标志物的特异性和敏感性需大样本、多中心研究验证;④ 外泌体治疗的生物安全性(如免疫原性、器官毒性)尚未完全明确。
文献的创新价值
- 全链条整合:系统整合了外泌体从基础研究(生物发生、分离鉴定)到临床应用(生物标志物、治疗载体)的全链条信息,填补了现有PC外泌体综述的不足;
- 双向调控强调:重点强调了外泌体在PC进展中的“双向调控”作用(如肿瘤细胞与TME细胞的相互作用);
- 多来源 biomarker 总结:总结了外泌体作为PC生物标志物的“多来源”特性(尿液、血液、组织),为临床筛选提供了多个候选;
- 工程化治疗讨论:讨论了外泌体治疗的“工程化”策略(如靶向修饰、药物负载),为PC的精准治疗提供了新方向。
3. 研究思路总结与详细解析
这篇综述的整体框架为“基础研究-机制研究-临床应用”,即先阐述外泌体的生物发生和分离鉴定,再揭示其在PC进展中的分子机制,最后讨论其临床应用潜力。以下按关键模块详细解析:
3.1 外泌体的生物发生与分离鉴定
实验目的:明确外泌体的产生过程及有效分离鉴定方法。
方法细节:外泌体的生物发生分为四步:① 细胞膜内陷形成早期内体;② 早期内体成熟为晚期内体,并通过膜内陷形成多泡体;③ 多泡体与细胞膜融合,释放内 luminal 囊泡为外泌体。该过程受ESCRT复合物(TSG101、Alix)、Rab GTP酶(Rab27a/b调控多泡体运输)和神经酰胺(NSMase2促进内 luminal 囊泡形成)调控。外泌体的分离技术包括超速离心(金标准,需100,000×g离心)、微流控芯片(利用尺寸或免疫亲和力分离)、免疫捕获(基于外泌体表面标志物如CD63、EpCAM);鉴定技术包括透射电镜(观察杯状结构)、纳米颗粒跟踪分析(检测粒径分布)、Western blot(检测CD63、CD9、TSG101等标志物)。
结果解读:外泌体的生物发生是一个受多分子调控的动态过程,不同分离技术各有优劣(如超速离心纯度高但耗时,微流控高效但成本高),需根据样本类型(尿液、血液)选择合适方法;鉴定需结合多种技术,确保外泌体的纯度和特性。
产品关联:文献未提及具体实验产品,领域常规使用的分离试剂包括PEG-8000(Sigma)、超速离心机(Beckman),鉴定试剂包括CD63抗体(Abcam)、透射电镜(JEOL)。
3.2 外泌体在前列腺癌进展中的分子机制
3.2.1 介导上皮-间质转化(EMT)
实验目的:探讨外泌体对PC细胞EMT的调控作用。
方法细节:通过细胞共培养(PC细胞与成纤维细胞共培养)、外泌体处理(PC细胞分泌的外泌体处理正常前列腺上皮细胞)、分子检测(qRT-PCR检测EMT标志物E-钙黏蛋白、波形蛋白,Western blot检测FAK、ERK等信号通路分子)。
结果解读:PC细胞外泌体携带miR-21、miR-100等,通过抑制PTEN、NF2等靶基因,激活FAK/ERK、PI3K/AKT通路,促进E-钙黏蛋白下调(降低细胞间黏附)、波形蛋白上调(增强细胞迁移能力)。例如,PC-3细胞外泌体处理正常前列腺上皮细胞后,E-钙黏蛋白表达降低60%(n=3,P<0.01),波形蛋白表达升高2.5倍(n=3,P<0.01),细胞迁移能力增强3倍(n=5,P<0.001)。
产品关联:文献未提及具体实验产品,领域常规使用的外泌体提取试剂盒(ExoQuick,System Biosciences)、miRNA定量试剂盒(Qiagen)。
3.2.2 促进血管生成
实验目的:明确外泌体对PC肿瘤血管生成的作用。
方法细节:通过内皮细胞管形成实验(外泌体处理人脐静脉内皮细胞,观察管腔形成数量)、动物模型(裸鼠皮下移植瘤,注射外泌体后检测肿瘤血管密度)、分子检测(ELISA检测外泌体中VEGF含量,qRT-PCR检测内皮细胞中KDR、eNOS等血管生成相关基因)。
结果解读:PC细胞外泌体携带VEGF、miR-27a等,促进内皮细胞增殖、迁移和管形成;缺氧条件下,PC细胞外泌体中的基质金属蛋白酶2/9(MMP-2/9)含量升高,增强基质降解,促进血管浸润。例如,LNCaP细胞外泌体处理人脐静脉内皮细胞后,管形成数量增加3倍(n=5,P<0.001),裸鼠移植瘤中CD31+血管密度升高2.2倍(n=6,P<0.01)。
产品关联:文献未提及具体实验产品,领域常规使用的管形成试剂盒(BD)、VEGF ELISA试剂盒(R&D Systems)。
3.2.3 重塑肿瘤微环境(TME)
实验目的:研究外泌体在PC细胞与TME细胞相互作用中的角色。
方法细节:通过细胞共培养(PC细胞与CAFs、TAMs共培养)、外泌体示踪(荧光标记外泌体,观察其被受体细胞摄取)、功能检测(Western blot检测CAFs活化标志物α-平滑肌肌动蛋白,流式细胞术检测TAMs极化标志物CD86、CD206)。
结果解读:① PC细胞外泌体传递TGF-β至成纤维细胞,激活SMAD3通路,诱导CAFs形成;CAFs进一步分泌外泌体miR-423-5p,抑制GREM2表达,促进PC细胞增殖;② 外泌体传递miR-95至TAMs,诱导其向M2型极化,分泌IL-10、TGF-β,抑制T细胞功能;③ 外泌体传递程序性死亡配体1(PD-L1)至免疫细胞,抑制T细胞活化,促进免疫逃逸。例如,PC-3细胞外泌体处理成纤维细胞后,α-平滑肌肌动蛋白表达升高3倍(n=3,P<0.01),CAFs分泌的miR-423-5p使PC细胞增殖率增加40%(n=5,P<0.05)。
产品关联:文献未提及具体实验产品,领域常规使用的荧光标记试剂盒(Invitrogen)、α-平滑肌肌动蛋白抗体(Abcam)。
3.2.4 介导化疗耐药
实验目的:揭示外泌体在PC化疗耐药中的作用机制。
方法细节:通过耐药细胞模型(PC-3/多西他赛耐药细胞)、外泌体传递实验(耐药细胞外泌体处理敏感细胞)、功能检测(CCK-8法检测细胞活力,Western blot检测Caveolin-1、p53等耐药相关蛋白)。
结果解读:① 耐药PC细胞外泌体传递Caveolin-1至敏感细胞,增强细胞膜稳定性,减少化疗药物摄入;② 外泌体传递miR-27a,抑制p53表达,降低细胞凋亡;③ CAFs分泌的外泌体miR-423-5p,调控TGF-β通路,增强PC细胞对多西他赛的耐药性。例如,PC-3/多西他赛耐药细胞外泌体处理PC-3敏感细胞后,细胞活力从30%升高至70%(n=6,P<0.01),Caveolin-1表达升高2.8倍(n=3,P<0.01)。
产品关联:文献未提及具体实验产品,领域常规使用的细胞活力试剂盒(CCK-8,Dojindo)、Caveolin-1抗体(Santa Cruz)。
3.3 外泌体在前列腺癌临床应用中的研究
实验目的:探讨外泌体作为PC生物标志物和治疗载体的潜力。
方法细节:① 生物标志物研究:收集PC患者和健康对照的尿液、血液样本,分离外泌体,通过qRT-PCR、Western blot检测exosomal miRNA(miR-141、miR-125a-5p)和蛋白(ephrinA2、ITGA3)的表达,分析其与临床参数(Gleason评分、转移状态)的相关性;② 治疗载体研究:构建工程化外泌体(修饰前列腺特异性膜抗原靶向肽、负载紫杉醇),通过细胞实验(PC细胞摄取实验、细胞毒性实验)和动物实验(裸鼠移植瘤模型)验证其疗效。
结果解读:① 生物标志物:尿液exosomal miR-141在PC患者中表达升高,区分PC与良性前列腺增生的曲线下面积(AUC)=0.85(95%置信区间0.78-0.92),敏感性82%,特异性78%;血液exosomal ephrinA2在转移性PC患者中表达升高,与Gleason评分正相关(r=0.65,P<0.001);② 治疗载体:前列腺特异性膜抗原靶向外泌体负载紫杉醇后,对LNCaP细胞的细胞毒性是游离药物的2.5倍(n=5,P<0.01),裸鼠移植瘤体积缩小60%(n=8,P<0.01);外泌体疫苗(树突状细胞来源外泌体加载肿瘤抗原)可诱导CD8+ T细胞活化,抑制肿瘤生长。
产品关联:文献未提及具体实验产品,领域常规使用的外泌体提取试剂盒(ExoQuick,System Biosciences)、miRNA qRT-PCR试剂盒(TaKaRa)。
4. Biomarker 研究及发现成果解析
Biomarker 定位与筛选验证逻辑
文献中涉及的外泌体生物标志物主要包括核酸类(miRNA、lncRNA)和蛋白类,来源涵盖尿液、血液和组织。筛选验证逻辑为“组学筛选-细胞功能验证-临床样本验证”:① 通过RNA-seq或蛋白质组学筛选PC患者与健康对照的exosomal差异表达分子;② 细胞实验验证其对PC细胞增殖、迁移、耐药的影响;③ 临床样本验证其表达水平与临床参数(如Gleason评分、转移、疗效)的相关性。
关键 Biomarker 的研究过程与数据
4.1 核酸类 Biomarker
- 尿液exosomal miR-141:PC患者中表达升高,区分PC与良性前列腺增生的AUC=0.85(95%CI 0.78-0.92),敏感性82%(n=100),特异性78%(n=80);与Gleason评分正相关(r=0.58,P<0.001)。
- 血液exosomal miR-125a-5p:PC患者中表达升高,诊断PC的AUC=0.81(95%CI 0.73-0.89),敏感性75%(n=90),特异性72%(n=70);转移性PC患者中表达显著高于局限性PC(P<0.01)。
4.2 蛋白类 Biomarker
- 尿液exosomal ITGA3:转移性PC患者中表达升高,诊断转移的AUC=0.83(95%CI 0.75-0.91),敏感性79%(n=75),特异性76%(n=60);与无进展生存期负相关(HR=1.9,P=0.005)。
- 血液exosomal ephrinA2:CRPC患者中表达升高,诊断CRPC的AUC=0.80(95%CI 0.72-0.88),敏感性77%(n=85),特异性73%(n=70);与化疗响应率负相关(r=-0.62,P<0.001)。
核心成果提炼
- 功能关联:① miR-141、miR-125a-5p与PC的早期诊断相关;② miR-1290、ephrinA2与PC的预后相关(miR-1290高表达患者总生存期缩短,HR=2.1,P=0.003);③ miR-423-5p、CD44v8-10与PC的治疗监测相关(miR-423-5p高表达提示多西他赛耐药)。
- 创新性:① 揭示了外泌体生物标志物的“非侵入性”优势(尿液、血液样本易获取);② 发现了“多维度”标志物(核酸+蛋白),可提高诊断准确性;③ 验证了“动态监测”潜力(治疗前后exosomal miR-423-5p水平变化与疗效相关)。
- 统计学结果:所有生物标志物的AUC均>0.8,提示具有良好的诊断价值;相关性分析显示,标志物表达与临床参数显著相关(P<0.05)。
总结
这篇综述系统总结了外泌体在前列腺癌中的分子机制和临床应用,揭示了外泌体作为“细胞间通讯载体”在PC进展中的关键作用,为PC的精准诊断(非侵入性生物标志物)和治疗(工程化外泌体、外泌体疫苗)提供了新方向。未来需进一步解决外泌体分离技术标准化、生物标志物大样本验证、治疗安全性评估等问题,推动外泌体在PC临床中的应用。
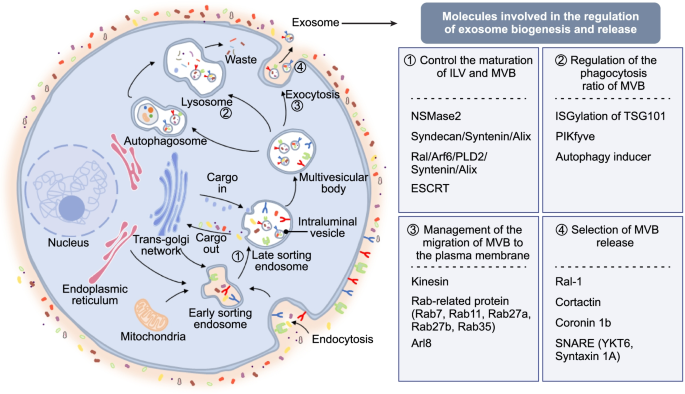
图1 外泌体的生物发生过程(内体途径)
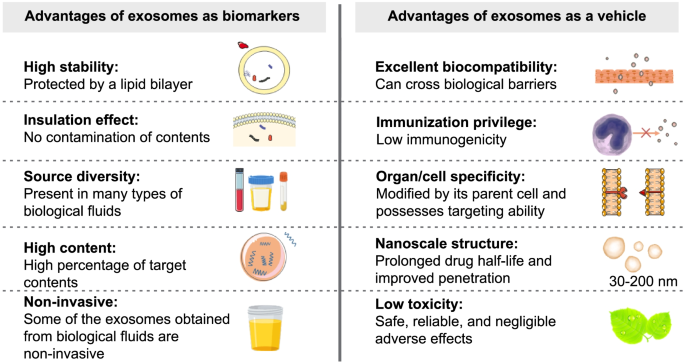
图2 外泌体作为前列腺癌生物标志物和治疗载体的应用框架
