1. 领域背景与文献引入
文献英文标题:Long noncoding RNA LIPH-4 promotes esophageal squamous cell carcinoma progression by regulating the miR-216b/IGF2BP2 axis;发表期刊:Biomarker Research;影响因子:未公开;研究领域:食管鳞状细胞癌(ESCC)中的长链非编码RNA(lncRNA)调控机制。
食管鳞状细胞癌是全球第七大常见恶性肿瘤(2020年新发病例60.41万),也是第六大癌症相关死亡原因(死亡54.41万)。在中国,ESCC占食管癌的90%以上,是第四大癌症相关死亡原因,尽管治疗手段进步,但其5年生存率仍低于20%,主要归因于晚期诊断、频繁转移及快速进展,且精确的遗传和分子机制尚未完全阐明。长链非编码RNA(lncRNA)是一类长度超过200核苷酸、缺乏明显蛋白编码能力的RNA分子,通过多种机制(如招募染色质修饰复合物、结合微小RNA(miRNA)或蛋白质、编码小肽)调控发育、分化及 carcinogenesis等过程。例如,lncRNA CASC9在ESCC中高表达,通过与CREB结合蛋白相互作用上调LAMC2表达促进转移;lncRNA HOXB-AS3编码的53氨基酸小肽可抑制结直肠癌细胞增殖。然而,多数lncRNA在ESCC中的功能及机制仍不明确。
作者团队此前通过lncRNA芯片分析5对ESCC及癌旁组织,鉴定出LIPH-4(定位于人染色体3q27.2的472bp转录本)是上调最显著的lncRNA之一。本研究旨在系统探讨LIPH-4在ESCC中的表达特征、生物学功能及分子机制,为ESCC的预后评估和靶向治疗提供新的生物标志物和理论依据。
2. 文献综述解析
文献综述部分,作者首先梳理ESCC的临床现状及分子机制研究需求,强调lncRNA作为关键调控因子在肿瘤中的作用,随后分类总结lncRNA的功能机制:一是通过染色质修饰调控基因表达(如CASC9结合CREB调控LAMC2);二是作为miRNA海绵(ceRNA)调控靶基因表达;三是编码小肽发挥功能(如HOXB-AS3编码肿瘤抑制肽)。现有研究的关键结论为“lncRNA在ESCC中扮演癌基因或抑癌基因角色,部分lncRNA可作为潜在生物标志物”,优势在于“为ESCC的分子诊断提供了新方向”,但局限性为“多数lncRNA的功能及机制未被解析”。
本研究的创新价值在于:首次报道lncRNA LIPH-4在ESCC中的异常高表达及致癌功能,揭示其通过ceRNA机制海绵吸附miR-216b、上调靶基因IGF2BP2的新机制,填补了LIPH-4在ESCC中功能研究的空白,为ESCC的分子靶向治疗提供了新候选靶点。
3. 研究思路总结与详细解析
本研究的整体框架为“筛选异常表达lncRNA→临床样本验证表达及预后关联→细胞及动物实验验证功能→机制解析(亚细胞定位→miRNA靶点筛选→靶基因验证→rescue实验)”,围绕“LIPH-4在ESCC中的表达、功能及机制”核心科学问题,形成“假设-验证-结论”的闭环。
3.1 临床样本中LIPH-4的表达及预后关联分析
实验目的:验证LIPH-4在ESCC临床样本中的表达水平,分析其与临床病理特征及患者预后的关系。
方法细节:收集53对ESCC及癌旁正常组织样本,采用实时荧光定量逆转录聚合酶链反应(qRT-PCR)检测LIPH-4的相对表达量;通过Pearson卡方检验分析LIPH-4表达与肿瘤大小、年龄等临床病理参数的关联;采用Kaplan-Meier曲线及log-rank检验分析LIPH-4表达与患者总生存期(OS)的关系。
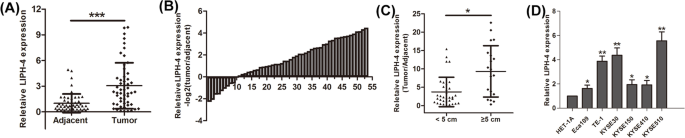
结果解读:81.13%(43/53)的ESCC组织中LIPH-4表达显著高于癌旁组织(P<0.001,图1);LIPH-4表达与肿瘤大小正相关(肿瘤大小>5cm者表达更高,P<0.05),与年龄、组织学分级等无显著关联;高表达LIPH-4的患者OS显著短于低表达患者(P<0.01)。
实验所用关键产品:Takara的SYBR Green PCR Kit、RiboBio的miDETECT A Track Kit;qRT-PCR引物序列见补充表2。
3.2 细胞模型中LIPH-4的功能验证
实验目的:探讨LIPH-4对ESCC细胞增殖、细胞周期及凋亡的影响。
方法细节:通过qRT-PCR检测6株ESCC细胞(TE-1、Eca109等)及正常食管上皮细胞HET-1A的LIPH-4表达,筛选高表达的KYSE510细胞(敲低实验)和低表达的KYSE150细胞(过表达实验);构建LIPH-4过表达质粒及敲低siRNA,慢病毒转染建立稳定细胞系;采用细胞计数试剂盒-8(CCK-8)、5-乙炔基-2"-脱氧尿苷(EdU)、集落形成实验检测增殖能力;流式细胞术分析细胞周期及凋亡率。
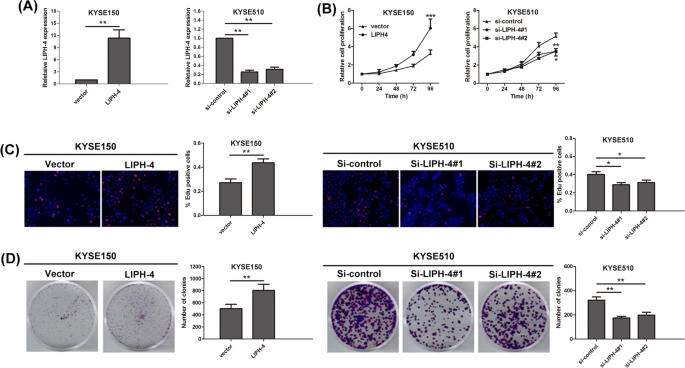
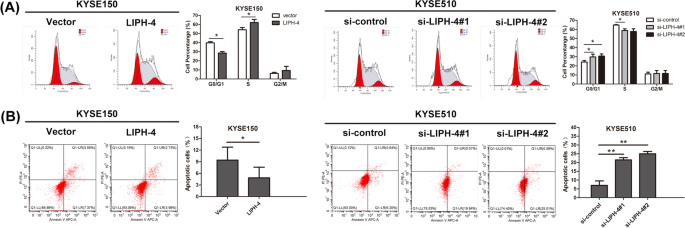
结果解读:ESCC细胞中LIPH-4表达均显著高于HET-1A细胞(P<0.05,图1D);过表达LIPH-4促进KYSE150细胞增殖(CCK-8、EdU及集落形成实验均显示增殖增强,P<0.05),敲低LIPH-4抑制KYSE510细胞增殖(P<0.05,图2);过表达LIPH-4促进细胞从G1期向S期transition,敲低则增加G0/G1期比例(P<0.05,图3A);过表达LIPH-4降低凋亡率,敲低则增加(P<0.05,图3B)。
实验所用关键产品:Genechem的慢病毒载体、Epizyme的EdU Cell Proliferation Kit、Beyotime的Cell Cycle and Apoptosis Analysis Kit、BD Biosciences的Annexin-V FITC凋亡检测试剂盒。
3.3 动物模型中LIPH-4的致癌作用验证
实验目的:验证LIPH-4在体内对ESCC肿瘤生长的影响。
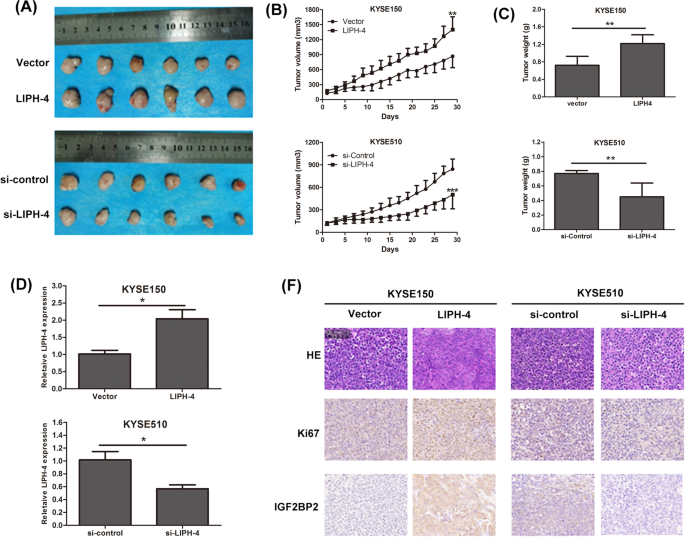
方法细节:将稳定过表达/敲低LIPH-4的ESCC细胞(5×10^6细胞/只)皮下注射到BALB/c裸鼠腋窝(每组6只);每3天测量肿瘤体积(长度×宽度²/2),4周后处死小鼠称取肿瘤重量;qRT-PCR检测肿瘤组织中LIPH-4的表达,免疫组化检测Ki67(增殖标志物)和IGF2BP2的表达。
结果解读:过表达LIPH-4显著促进肿瘤生长,肿瘤体积及重量均大于对照组(P<0.05,图7A-C);敲低LIPH-4显著抑制肿瘤生长(P<0.05);qRT-PCR验证肿瘤组织中LIPH-4的表达与转染状态一致(图7D);免疫组化显示,过表达LIPH-4的肿瘤组织中Ki67和IGF2BP2阳性率显著升高,敲低则降低(图7E)。
实验所用关键产品:BD Biosciences的Matrigel、ZENbio的GAPDH抗体、Abcam的IGF2BP2抗体;动物实验经Hunan Cancer Hospital动物伦理委员会批准。
3.4 LIPH-4的亚细胞定位及miRNA靶点筛选
实验目的:明确LIPH-4在ESCC细胞中的亚细胞定位,筛选其潜在结合的miRNA。
方法细节:采用PARIS Kit分离KYSE510细胞的细胞质和细胞核组分,qRT-PCR检测LIPH-4的分布(U6为核内对照,GAPDH为胞质对照);利用Starbase v2.0等生物信息学工具预测可能与LIPH-4结合的miRNA,重点关注抑癌miR-216b-5p。
结果解读:LIPH-4主要定位于ESCC细胞的细胞质中(图4A);生物信息学预测显示miR-216b-5p与LIPH-4存在潜在结合位点(图4B),且miR-216b已被报道在多种肿瘤中作为抑癌miRNA发挥作用。
实验所用关键产品:Invitrogen的PARIS Kit;生物信息学工具包括Starbase v2.0、RegRNA2.0。
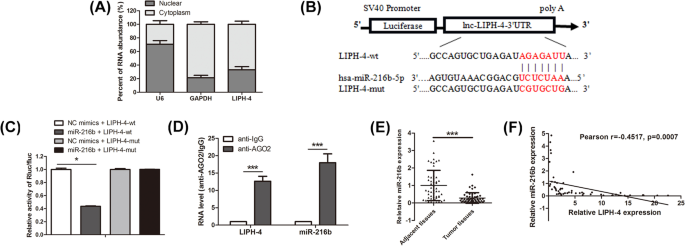
3.5 LIPH-4与miR-216b的相互作用验证
实验目的:验证LIPH-4与miR-216b的直接相互作用。
方法细节:构建含LIPH-4野生型(wt)及突变型(mut)的荧光素酶报告载体,与miR-216b模拟物共转染293T细胞,双荧光素酶报告系统检测活性;采用RNA免疫沉淀(RIP)实验,用Ago2抗体沉淀KYSE510细胞中的RNA-蛋白复合物,qRT-PCR检测LIPH-4和miR-216b的富集量;qRT-PCR检测53对ESCC组织中miR-216b的表达,分析其与LIPH-4的相关性。
结果解读:miR-216b模拟物显著降低LIPH-4-wt载体的荧光素酶活性(P<0.05,图4C);RIP实验显示LIPH-4和miR-216b均在Ago2沉淀中显著富集(P<0.05,图4D);ESCC组织中miR-216b表达显著低于癌旁组织(P<0.001,图4E),且与LIPH-4表达呈负相关(r=-0.4517,P=0.0007,图4F)。
实验所用关键产品:Promega的Dual-Luciferase Reporter Assay System、Millipore的EZ Magna RNA Immunoprecipitation Kit、Millipore的抗Ago2抗体。
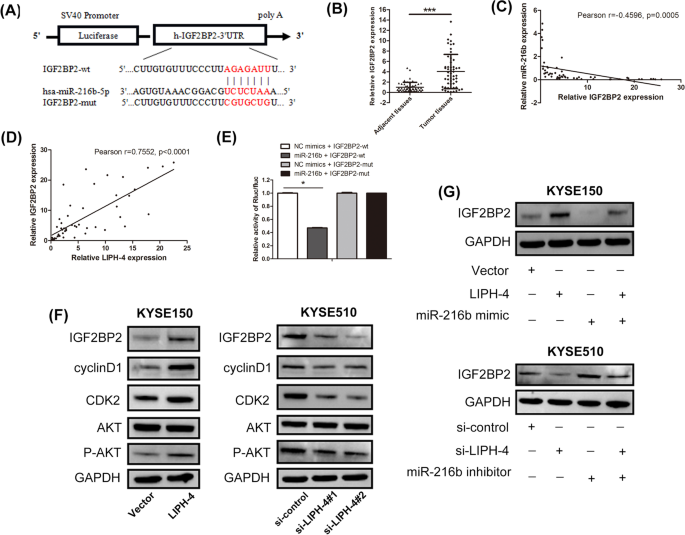
3.6 LIPH-4调控IGF2BP2的机制验证
实验目的:验证LIPH-4是否通过海绵吸附miR-216b调控靶基因IGF2BP2的表达。
方法细节:生物信息学预测miR-216b的靶基因IGF2BP2(胰岛素样生长因子2 mRNA结合蛋白2);构建IGF2BP2 3"UTR野生型及突变型荧光素酶报告载体,验证miR-216b与IGF2BP2的直接结合;qRT-PCR及蛋白质印迹法(Western blot)检测ESCC组织及细胞中IGF2BP2的表达,分析其与LIPH-4、miR-216b的相关性;过表达或敲低LIPH-4,检测IGF2BP2及下游蛋白(cyclinD1、p-AKT)的表达变化;共转染miR-216b mimic/inhibitor与LIPH-4过表达/敲低质粒,验证IGF2BP2的表达变化是否依赖miR-216b。
结果解读:生物信息学预测显示miR-216b与IGF2BP2 3"UTR存在结合位点(图5A);双荧光素酶报告实验验证miR-216b直接结合IGF2BP2(P<0.05,图5E);ESCC组织中IGF2BP2表达显著高于癌旁组织(P<0.05,图5B),与LIPH-4呈正相关(r=0.7552,P<0.0001,图5D),与miR-216b呈负相关(r=-0.4596,P=0.0005,图5C);过表达LIPH-4上调IGF2BP2、cyclinD1及p-AKT的表达,敲低则下调(图5F);共转染miR-216b模拟物可逆转LIPH-4过表达引起的IGF2BP2上调,共转染miR-216b抑制剂可逆转LIPH-4敲低引起的IGF2BP2下调(图5G)。
实验所用关键产品:Abcam的IGF2BP2抗体、Abways的cyclinD1及p-AKT抗体、Millipore的ECL-Plus试剂。
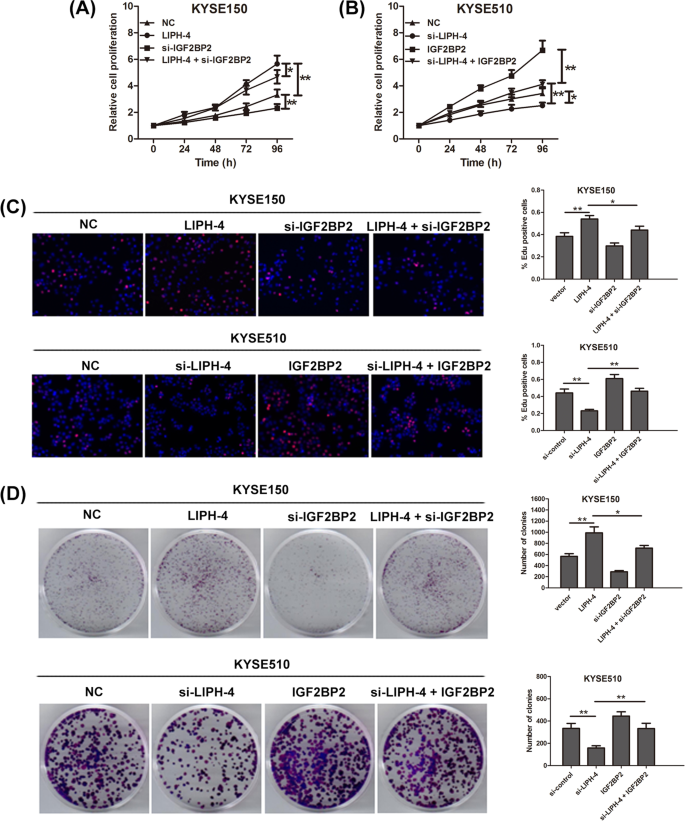
3.7 IGF2BP2介导LIPH-4致癌作用的rescue实验
实验目的:验证IGF2BP2是否介导LIPH-4的致癌功能。
方法细节:在KYSE150细胞中过表达LIPH-4的同时敲低IGF2BP2,在KYSE510细胞中敲低LIPH-4的同时过表达IGF2BP2;采用CCK-8、EdU及集落形成实验检测细胞增殖能力的变化。
结果解读:敲低IGF2BP2可部分逆转LIPH-4过表达引起的KYSE150细胞增殖增强(图6A-C);过表达IGF2BP2可部分恢复LIPH-4敲低引起的KYSE510细胞增殖抑制(图6A-C),表明IGF2BP2是LIPH-4发挥致癌作用的关键下游效应分子。
实验所用关键产品:Genechem的IGF2BP2过表达及敲低质粒;细胞功能实验所用试剂同3.2部分。
4. Biomarker研究及发现成果解析
Biomarker定位:本研究涉及的Biomarker为长链非编码RNA LIPH-4,作为ESCC的预后Biomarker,筛选及验证逻辑为“芯片筛选异常表达lncRNA→临床样本qRT-PCR验证→预后关联分析→细胞及动物实验验证功能→机制解析”,形成完整的“筛选-验证-功能-机制”链条。
研究过程详述:Biomarker来源为53对ESCC临床组织样本;验证方法包括qRT-PCR检测表达水平、Pearson卡方检验分析与临床病理特征的关联、Kaplan-Meier曲线分析预后价值;特异性方面,LIPH-4在81.13%的ESCC样本中高表达,与肿瘤大小正相关(P<0.05);敏感性方面,高表达LIPH-4的患者总生存期显著缩短(log-rank test P<0.01),提示其对预后的预测敏感性较高。
核心成果提炼:LIPH-4是ESCC的新型不良预后Biomarker,其高表达与肿瘤大小增大、总生存期缩短显著相关(肿瘤大小>5cm者表达更高,P<0.05;高表达者OS更短,P<0.01);机制上,LIPH-4通过ceRNA机制海绵吸附miR-216b,上调靶基因IGF2BP2的表达,进而促进ESCC细胞增殖、细胞周期进展及抑制凋亡;首次揭示LIPH-4/miR-216b/IGF2BP2轴在ESCC中的致癌作用,为ESCC的预后评估和靶向治疗提供了新的生物标志物和潜在靶点。
