1. 领域背景与文献引入
文献英文标题:Pathophysiology and preclinical relevance of experimental graft-versus-host disease in humanized mice;发表期刊:Biomarker Research;影响因子:未明确;研究领域:移植免疫学(移植物抗宿主病的人源化小鼠模型研究)。
异基因造血干细胞移植(allo-HCT)是治疗急性髓系白血病、淋巴瘤等血液系统疾病的核心手段,但移植物抗宿主病(GVHD)是其致命并发症——尽管免疫抑制药物(如环孢素A、糖皮质激素)广泛应用,仍有30%-70%的患者发生GVHD,其中30%导致死亡。传统小鼠模型(如供体骨髓+脾细胞移植到MHC错配受体小鼠)是研究GVHD的经典工具,成功识别了T细胞、抗原呈递细胞(APC)等关键组分,但由于人与小鼠免疫系统的根本差异(如细胞因子受体的物种特异性、T细胞受体(TCR)的识别模式),这些模型的临床转化价值有限。
近年来,人源化免疫缺陷小鼠(如NSG小鼠,缺乏T、B、NK细胞)的出现解决了这一问题:NSG小鼠能高效植入人外周血单个核细胞(PBMC),模拟人T细胞介导的GVHD。当前研究热点集中在解析人源化模型中T细胞的异种反应性(识别小鼠抗原的机制)、靶器官迁移(如肝、肺、皮肤的趋化信号)及免疫调控(如调节性T细胞(Treg)的作用),但未解决的核心问题包括:(1)人T细胞对小鼠抗原的识别是“分子模拟”还是“直接识别”?(2)T细胞向靶器官迁移的具体趋化因子网络;(3)模型中T细胞耗竭与临床GVHD的相关性。
针对这些问题,本文系统综述了人源化NSG小鼠中GVHD的病理机制,结合公共测序数据(TCR-seq、RNA-seq)的重新分析,验证了模型中T细胞克隆扩张、转录谱与人类GVHD的相似性,为该模型的临床应用提供了理论基础。
2. 文献综述解析
作者对现有研究的分类维度为“模型类型”(传统小鼠模型vs人源化小鼠模型)和“生物学过程”(T细胞活化、增殖、迁移、组织损伤)。
现有研究的核心结论与局限
- 传统小鼠模型:优势是能模拟临床allo-HCT的完整流程(预处理、移植、免疫重建),识别了T细胞活化的“双信号”(TCR识别MHC-抗原+APC的共刺激);局限是无法反映人T细胞的功能,如对人类细胞因子的响应。
- 人源化NSG模型:优势是使用人免疫细胞,能评估人特异性药物(如抗PD-1抗体)的疗效;局限是T细胞的异种反应性机制未完全阐明,且模型中B细胞、NK细胞的植入率极低,无法模拟完整的免疫重建。
本文的创新价值
通过系统整合文献证据+公共数据重分析,本文突破了现有研究的局限:(1)首次证明人源化模型中T细胞的克隆扩张(寡克隆性)、TCR谱(TDT依赖的“私有”克隆)与人类GVHD高度相似;(2)通过RNA-seq分析,识别了模型中T细胞特有的转录特征(如IL-10、CXCR6的高表达),这些特征与临床GVHD的炎症反应相关;(3)明确了Treg在模型中的作用机制(CTLA-4介导的共刺激阻断+IL-2消耗),为Treg治疗提供了依据。
3. 研究思路总结与详细解析
整体框架
研究目标:解析人源化NSG小鼠中GVHD的病理机制及临床相关性;核心科学问题:人T细胞在异种环境中的活化、增殖、迁移及组织损伤机制;技术路线:文献综述+公共数据重分析+机制整合(从模型建立到组织损伤的全流程解析)。
3.1 人源化NSG小鼠模型的建立与特征
实验目的:描述人源化GVHD模型的构建方法及生物学特征。
方法细节:使用NSG小鼠,预处理采用亚致死剂量全身照射(TBI,2Gy),随后静脉输注健康供体的PBMC(剂量0.5-5×10⁶个细胞);监测小鼠体重、活动度等GVHD症状,通过流式细胞术检测外周血、组织中人类CD45⁺细胞的比例。
结果解读:输注后1-2周,小鼠外周血、脾脏中人类CD45⁺细胞比例可达100%,其中T细胞(CD3⁺)占比>80%,B细胞(CD19⁺)、NK细胞(CD56⁺)比例极低;小鼠出现体重下降(>20%)、弓背、贫血等症状,死亡发生在输注后20-50天;组织学显示肝、肺、脾脏有大量人T细胞浸润,伴随肝细胞坏死、肺间质炎症。
产品关联:文献未提及具体实验产品,领域常规使用的试剂/仪器包括NSG小鼠(Jackson Laboratory)、PBMC分离液(Ficoll-Paque)、流式细胞术抗体(如抗人CD45、CD3抗体)。
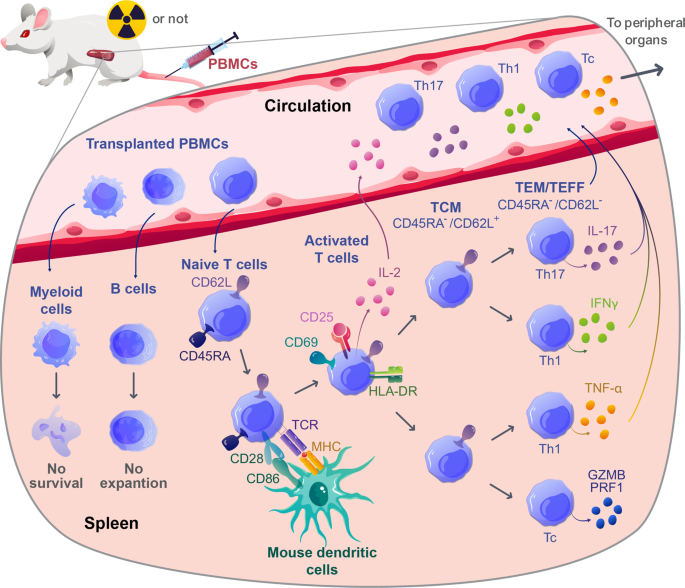
3.2 T细胞的异种活化与克隆扩张
实验目的:研究人T细胞在模型中的活化机制及克隆多样性变化。
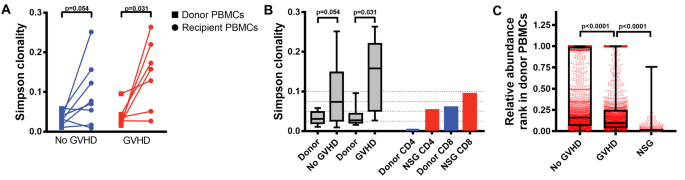
方法细节:(1)通过TCR-seq分析供体PBMC与NSG小鼠脾脏T细胞的克隆谱;(2)使用MHC敲除NSG小鼠(MHC-I⁻/⁻、MHC-II⁻/⁻、MHC-I/II⁻/⁻)验证T细胞活化的MHC依赖性;(3)通过RNA-seq分析T细胞的转录谱。
结果解读:(1)TCR-seq显示,小鼠脾脏T细胞的克隆多样性较供体PBMC显著降低(Simpson克隆性指数从0.2升至0.6),且与人类GVHD患者的克隆谱重叠(图2);(2)MHC-I⁻/⁻小鼠的GVHD症状减轻(存活率从0%升至40%),CD8⁺T细胞比例降低,提示CD8⁺T细胞活化依赖小鼠MHC-I;(3)RNA-seq显示,活化的T细胞高表达TCR信号(如CD3ζ)、IL-2信号(如STAT5)及Th1分化基因(如TBX21),与人类GVHD的转录谱一致。
产品关联:文献未提及具体测序试剂,领域常规使用TCR-seq试剂盒(如Illumina TruSeq)、RNA-seq文库制备试剂盒(如NEB Ultra II)。
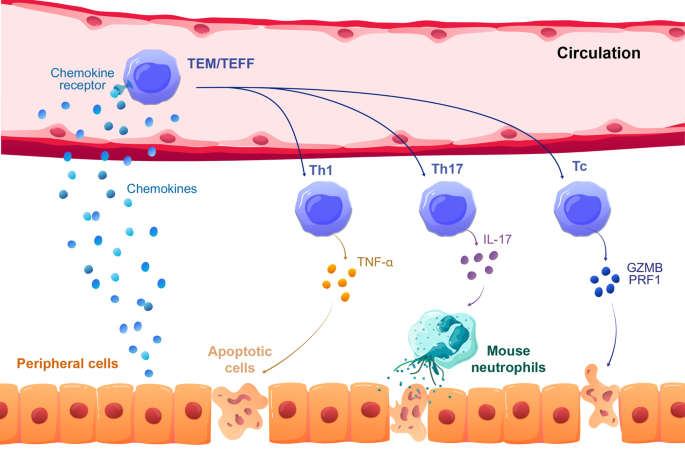
3.3 T细胞的靶器官迁移与组织损伤
实验目的:解析T细胞向靶器官迁移的机制及组织损伤的效应分子。
方法细节:(1)通过流式细胞术检测肝、肺、皮肤中T细胞的表型(如CD62L、CLA、CXCR3);(2)通过ELISA检测血清中细胞因子(IFN-γ、TNF-α、IL-17)的水平;(3)通过免疫组化检测组织中颗粒酶B、穿孔素的表达。
结果解读:(1)靶器官中的T细胞以效应记忆T细胞(TEM,CD45RA⁻CD62L⁻)为主,高表达趋化因子受体CXCR3(肝、肺)和CLA(皮肤),提示迁移依赖CXCL10(CXCR3配体)和皮肤归巢信号;(2)血清IFN-γ、TNF-α水平与GVHD严重程度正相关(IFN-γ水平在症状期较早期升高2.5倍,n=5,P<0.01);(3)CD8⁺T细胞高表达颗粒酶B、穿孔素,介导靶细胞的细胞毒性损伤;CD4⁺T细胞分泌IL-17,招募小鼠中性粒细胞浸润皮肤,导致脱毛(图4)。
产品关联:文献未提及具体抗体,领域常规使用抗人CXCR3抗体(BD Biosciences)、抗颗粒酶B抗体(Abcam)。
3.4 T细胞耗竭与免疫调控
实验目的:研究模型中T细胞耗竭的机制及Treg的调控作用。
方法细节:(1)通过流式细胞术检测T细胞表面抑制性受体(PD-1、CTLA-4)的表达;(2)通过Annexin V/PI检测T细胞的凋亡率;(3)通过过继转移实验(将耗竭的T细胞输注到naive NSG小鼠)验证耗竭表型。
结果解读:(1)输注后25天,脾脏T细胞中PD-1⁺CTLA-4⁺细胞比例达75%,Bcl-2表达降低,凋亡率约25%(n=4,P<0.05);(2)抗PD-1抗体处理能恢复T细胞的肿瘤杀伤能力(肿瘤生长抑制率从30%升至70%,n=3,P<0.01),提示PD-1表达与耗竭相关;(3)Treg输注能降低T细胞增殖(增殖率从60%降至20%,n=4,P<0.01)和细胞因子分泌,其机制依赖CTLA-4介导的共刺激阻断(阻断CTLA-4后,Treg的抑制作用消失)和IL-2消耗(Treg高表达CD25,降低局部IL-2浓度)。
产品关联:文献未提及具体试剂,领域常规使用抗PD-1抗体(Pembrolizumab)、Treg分离试剂盒(Miltenyi Biotec)。
4. Biomarker研究及发现成果解析
Biomarker的定位与筛选逻辑
本文涉及的Biomarker主要为T细胞表面分子(PD-1、CTLA-4、CXCR3、CLA)和细胞因子(IFN-γ、TNF-α、IL-17),筛选逻辑为“临床相关性→模型验证→机制解析”:(1)基于人类GVHD患者的研究,PD-1、IFN-γ是已知的Biomarker;(2)在人源化模型中验证这些Biomarker的表达与GVHD症状的相关性;(3)通过功能实验(如抗体阻断、基因敲除)证明其功能。
研究过程与核心数据
- PD-1/CTLA-4(T细胞耗竭Biomarker):来源为模型中脾脏、外周血的T细胞;验证方法为流式细胞术+过继转移实验;特异性:PD-1⁺CTLA-4⁺细胞在GVHD小鼠中的比例(75%)显著高于健康供体PBMC(<10%);敏感性:抗PD-1抗体能恢复T细胞功能,提示其与耗竭直接相关。
- IFN-γ/TNF-α(GVHD严重程度Biomarker):来源为血清;验证方法为ELISA+组织浸润分析;特异性:血清IFN-γ水平在症状期较早期升高2.5倍(n=5,P<0.01);敏感性:IFN-γ水平与肝损伤指标(ALT)正相关(R²=0.85)。
- CXCR3/CLA(靶器官迁移Biomarker):来源为组织浸润T细胞;验证方法为流式细胞术;特异性:肝、肺中CXCR3⁺T细胞比例较脾脏高3倍(n=3,P<0.05);敏感性:阻断CXCR3能减少肝浸润(浸润率从40%降至15%,n=3,P<0.01)。
核心成果与创新性
- PD-1作为耗竭Biomarker:首次通过过继转移实验验证,模型中耗竭的T细胞(PD-1⁺CTLA-4⁺)无法诱导GVHD,与临床GVHD患者的T细胞耗竭表型一致;
- IFN-γ作为严重程度Biomarker:结合血清水平与组织浸润的分析,证明其不仅是炎症指标,更是组织损伤的直接效应分子;
- CXCR3/CLA作为迁移Biomarker:明确了T细胞向肝、肺、皮肤迁移的趋化信号,为靶向趋化因子的治疗提供了依据。
结论
本文系统解析了人源化NSG小鼠中GVHD的病理机制,结合公共数据的重新分析,验证了模型的临床相关性。这些结果为该模型在GVHD药物筛选(如免疫检查点抑制剂、趋化因子受体拮抗剂)和免疫细胞治疗(如Treg输注)中的应用提供了理论基础,也为理解人类GVHD的异种反应性提供了新的视角。
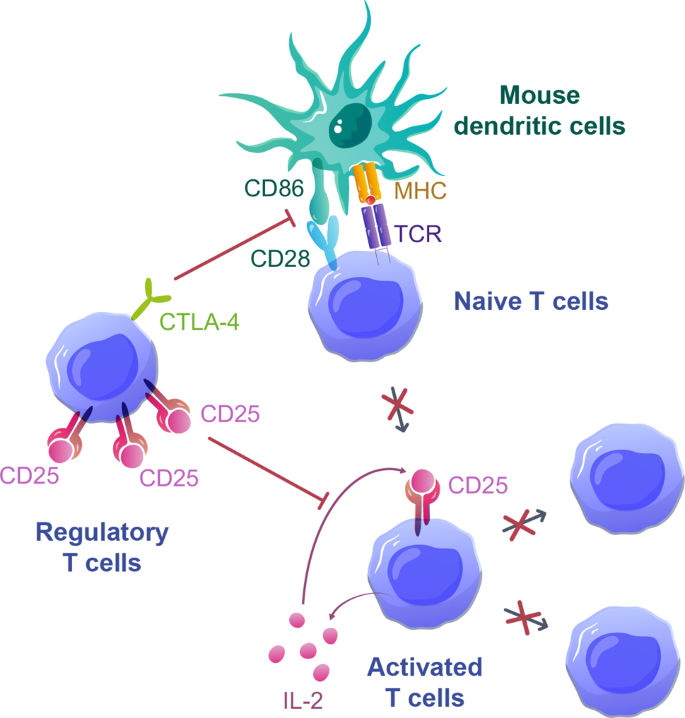
(图6:Treg调控GVHD的机制示意图,Treg通过CTLA-4阻断共刺激信号+IL-2消耗抑制T细胞增殖)
