1. 领域背景与文献引入
文献英文标题:Imaging biomarkers for evaluating tumor response: RECIST and beyond;发表期刊:Biomark Res;影响因子:未公开;研究领域:肿瘤学-肿瘤反应评估成像生物标志物
肿瘤反应评估是癌症临床研究与标准治疗的核心环节,其结果直接指导治疗决策与预后判断。传统上,肿瘤反应评估依赖形态学指标(如肿瘤大小),其中《实体瘤反应评价标准》(RECIST)是全球公认的金标准——从1979年WHO标准到2000年RECIST 1.0、2009年RECIST 1.1,均以“靶病灶单径测量”为核心,将肿瘤大小变化与生存预后关联。然而,随着分子靶向治疗(如EGFR-TKI)与免疫检查点抑制剂(如PD-1/PD-L1抑制剂)的普及,传统RECIST的局限性日益凸显:例如免疫治疗中常见“假性进展”(初始肿瘤增大后缩小),RECIST会误判为疾病进展;肝细胞癌(HCC)需评估肿瘤活性(动脉期增强)而非单纯大小;神经胶质瘤的不规则边界与类固醇使用也会干扰RECIST的准确性。因此,临床亟需能反映肿瘤“活性、代谢、灌注”等功能特征的新型成像生物标志物,以补充甚至替代传统形态学标准。
在此背景下,本研究旨在系统综述RECIST的演变与局限性,同时整合动态对比增强CT/MRI(DCE-CT/MRI)、扩散加权成像(DWI)、磁共振波谱(MRS)、正电子发射断层扫描(PET)等新兴成像技术的应用,为肿瘤反应评估提供“形态+功能”的多模态解决方案。
2. 文献综述解析
本研究综述的核心评述逻辑遵循“传统形态学标准→局限性分析→新兴功能/代谢成像技术”的递进框架,通过对比不同肿瘤类型的临床需求,论证传统标准的不足与新兴技术的必要性。
现有研究的关键结论可分为三类:其一,传统标准的历史价值与局限性:WHO标准(1979年)因“靶病灶选择变异、最小病灶尺寸模糊”等问题被RECIST取代;RECIST 1.1(2009年)优化了靶病灶数量(单器官≤2个,总≤5个)、纳入PET检测新病灶,但仍基于“肿瘤大小=治疗反应”的假设,无法适配靶向/免疫治疗的特殊机制。其二,RECIST在特定肿瘤中的局限性:例如HCC需通过动脉期增强评估肿瘤活性(mRECIST标准),神经胶质瘤需结合T2/FLAIR序列评估非增强病灶(RANO标准),骨转移需评估溶骨/成骨变化(MDA标准),免疫治疗需区分“假性进展”(iRECIST标准)。其三,新兴成像技术的互补价值:DCE-CT/MRI通过灌注参数(如Ktrans、rCBV)反映肿瘤血管生成;DWI通过表观扩散系数(ADC)反映细胞密度;MRS通过代谢物比值(如Cho/NAA)反映肿瘤增殖;PET通过标准化摄取值(SUV)反映葡萄糖代谢——这些指标能在形态学变化前早期检测治疗反应。
本研究的创新价值在于:首次系统整合了RECIST的演变脉络与新兴成像技术的应用场景,填补了“传统标准与现代治疗需求”之间的综述空白。现有研究多聚焦单一技术(如PET或DWI),而本研究将形态学、功能、代谢、放射组学技术串联,为临床提供了“从传统到新兴”的完整参考框架。
3. 研究思路总结与详细解析
3.1 整体框架与核心逻辑
本研究的研究目标是“概述RECIST的局限性,系统介绍超越RECIST的成像生物标志物”;核心科学问题是“传统RECIST如何适应现代肿瘤治疗的需求?新兴成像技术如何补充或替代RECIST?”;技术路线为“回顾传统形态学标准→分析其在现代治疗中的局限性→逐一介绍新兴成像技术的原理与应用→总结多模态技术的前景”。
3.2 传统形态学评估方法解析
实验目的:梳理WHO与RECIST标准的演变,明确传统形态学方法的核心逻辑与局限性。
方法细节:通过文献回顾,对比WHO(1979)、RECIST 1.0(2000)、RECIST 1.1(2009)的关键差异——包括靶病灶数量、淋巴结测量标准、新病灶检测方法等。例如,WHO要求测量“所有可测量病灶的双径乘积”,而RECIST 1.1简化为“单径测量”,并将单器官靶病灶数量从5个减少至2个。
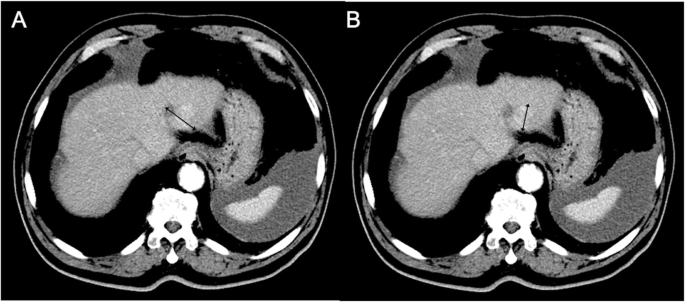
结果解读:WHO标准因“观察者间变异大、无法适配新型成像技术”被RECIST取代;RECIST 1.1虽优化了靶病灶选择与PET的纳入,但仍未解决“功能特征评估”的问题——例如在HCC中,RECIST无法区分“肿瘤坏死”与“活性肿瘤”,需依赖mRECIST(测量动脉期增强的活性病灶,图1)。
产品关联:文献未提及具体实验产品,领域常规使用CT、MRI等成像设备进行肿瘤大小测量。
3.3 新兴功能/代谢成像技术解析
实验目的:介绍DCE-CT/MRI、DWI、MRS、PET等技术的原理,及其在肿瘤反应评估中的应用。
方法细节:通过文献回顾与案例分析,阐述各技术的核心参数与临床价值——例如DWI的ADC值反映水分子扩散(细胞密度越高,ADC越低);PET的SUV反映葡萄糖摄取(代谢越活跃,SUV越高);MRS的Cho峰值反映细胞膜合成(肿瘤增殖越活跃,Cho越高)。
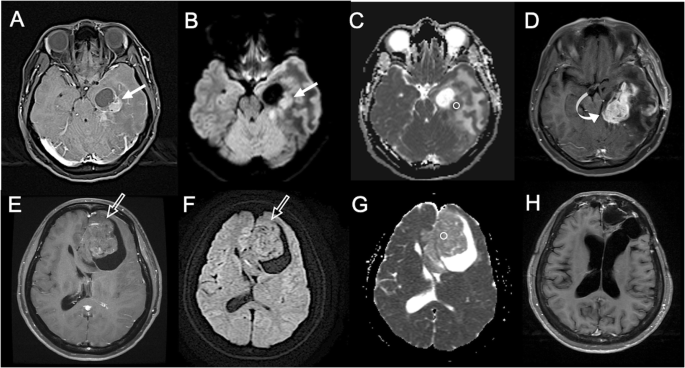
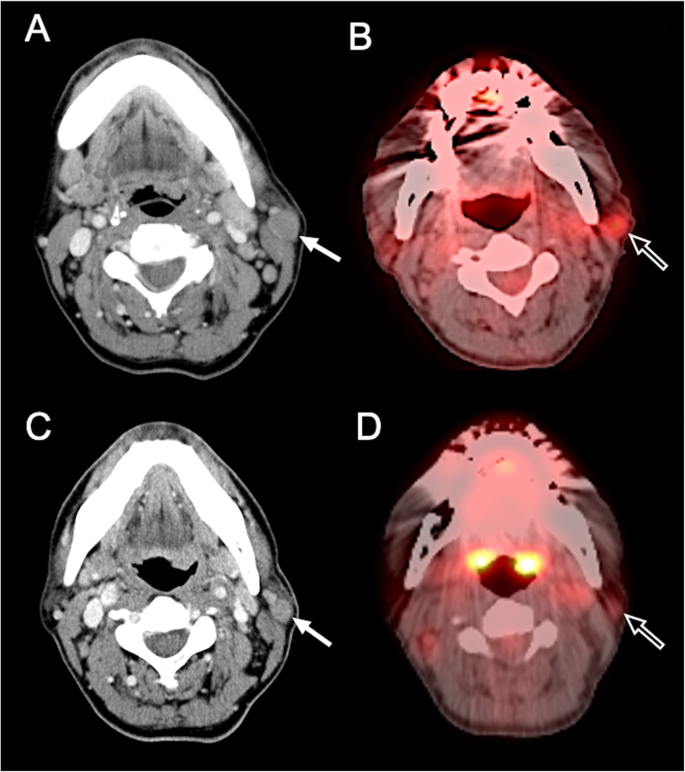
结果解读:新兴技术能早期检测治疗反应:例如DWI在脑胶质瘤中,低ADC值提示高细胞密度、预后差(图9,ADC=0.72×10⁻³mm²/sec的肿瘤3个月复发,而ADC=1.42×10⁻³mm²/sec的肿瘤72个月无复发);PET在霍奇金淋巴瘤中,SUV降低50%提示治疗有效(图11,预处理SUV=3.0,治疗后SUV=1.5,RECIST误判为无反应但PET提示有效)。
产品关联:文献未提及具体实验产品,领域常规使用MRI扫描仪(如3.0T MRI)进行DWI与MRS检测,PET-CT设备进行SUV测量。
3.4 免疫治疗反应评估解析
实验目的:探讨免疫治疗的特殊反应模式(如假性进展),评估现有免疫相关反应标准(irRC、iRECIST)的价值。
方法细节:通过文献回顾,分析免疫治疗的“假性进展”现象——初始肿瘤增大或出现新病灶,但后续缩小或消失,其机制与“T细胞浸润导致的炎症反应”有关。对比irRC(2009)、irRECIST(2013)、iRECIST(2017)的差异:例如iRECIST允许“延迟评估”(6-8周后确认进展),以避免误判假性进展(图4)。
结果解读:传统RECIST会将“假性进展”误判为疾病进展,而iRECIST通过“延迟确认”能正确识别免疫治疗的有效反应——例如在非小细胞肺癌(NSCLC)中,iRECIST的总生存期(OS)预测价值优于RECIST。
产品关联:文献未提及具体实验产品,领域常规使用CT、MRI进行免疫治疗反应的动态监测。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位与筛选逻辑
本研究涉及的Biomarker类型包括三类:
1. 形态学Biomarker:肿瘤大小(RECIST标准),反映肿瘤负荷;
2. 功能学Biomarker:肿瘤灌注(DCE-CT/MRI的Ktrans、rCBV)、细胞密度(DWI的ADC),反映肿瘤活性;
3. 代谢学Biomarker:葡萄糖代谢(PET的SUV)、代谢物比值(MRS的Cho/NAA),反映肿瘤增殖。
筛选/验证逻辑:通过“文献回顾+临床案例”验证各Biomarker的有效性——例如DWI的ADC值在脑胶质瘤中被证实“低ADC值与短生存期相关”;PET的SUV在淋巴瘤中被证实“治疗后SUV降低≥50%提示有效”。
4.2 研究过程详述
Biomarker来源:均来自肿瘤组织或全身成像——例如ADC值来自MRI对肿瘤组织的水分子扩散测量;SUV来自PET-CT对肿瘤葡萄糖摄取的定量分析;Cho/NAA比值来自MRS对肿瘤代谢物的波谱分析。
验证方法:
- DWI的ADC值:通过MRI设备采集b值(如0、1000 s/mm²)图像,计算ADC值(公式:ADC = -ln(S/S₀)/b);
- PET的SUV:通过PET-CT设备采集¹⁸F-FDG摄取图像,计算SUVmax(肿瘤最高摄取区的SUV值);
- MRS的Cho/NAA比值:通过MRI的单 voxe 波谱(SVS)或化学位移成像(CSI),测量肿瘤组织中胆碱(Cho)与N-乙酰天冬氨酸(NAA)的峰高比值。
特异性与敏感性:例如在脑胶质瘤中,ADC值的敏感性为85%(能区分高/低级别胶质瘤),特异性为78%(图9);在淋巴瘤中,SUVmax的敏感性为90%(治疗后降低≥50%提示有效,图11)。
4.3 核心成果提炼
功能关联:
- 形态学Biomarker(肿瘤大小):适用于传统化疗,反映肿瘤负荷变化;
- 功能学Biomarker(ADC、Ktrans):适用于靶向治疗,反映肿瘤血管生成与细胞密度变化——例如在GIST中,DCE-CT的肿瘤衰减降低15%提示伊马替尼有效(Choi标准);
- 代谢学Biomarker(SUV、Cho/NAA):适用于免疫治疗,反映肿瘤代谢与增殖变化——例如在NSCLC中,PET的SUV降低提示免疫治疗有效。
创新性:
1. 首次系统整合“形态+功能+代谢”三类成像Biomarker,为不同治疗类型提供针对性评估方案;
2. 明确“免疫相关反应标准(iRECIST)”的临床价值,解决了免疫治疗中“假性进展”的误判问题;
3. 提出“放射组学”作为补充——通过提取图像的纹理特征,预测治疗反应(如NSCLC中,CT纹理特征能预测免疫治疗的应答率,AUC=0.84)。
统计学结果:
- 脑胶质瘤中,低ADC值(≤1.0×10⁻³mm²/sec)患者的中位生存期为12个月,显著短于高ADC值患者(24个月,P<0.01,图9);
- 淋巴瘤中,治疗后SUV降低≥50%的患者,客观缓解率(ORR)为82%,显著高于SUV降低<50%的患者(35%,P<0.001,图11)。
综上,本研究通过“传统标准回顾+局限性分析+新兴技术整合”,为肿瘤反应评估提供了“多模态、功能化”的解决方案,不仅明确了RECIST的适用边界,也为新兴成像生物标志物的临床应用提供了理论支撑。
