1. 领域背景与文献引入
文献英文标题:Application of omics in the diagnosis, prognosis, and treatment of acute myeloid leukemia;发表期刊:Biomarker Research;影响因子:5.5(2023年);研究领域:急性髓系白血病(AML)的组学应用研究。
急性髓系白血病是成人中最常见的白血病类型,死亡率高,5年生存率仅约28%。当前诊断与治疗策略主要基于基因突变(如FLT3、NPM1、IDH1/2)和细胞遗传学异常(如t(8;21)、t(15;17)、inv(16)),但临床管理中仍面临两大困境:风险分层不准确(如45%以上患者属于中间风险组,实际预后差异大)和化疗/靶向治疗耐药(如FLT3抑制剂耐药率高)。传统基因组学仅关注DNA层面异常,但DNA突变不一定反映基因表达、蛋白功能或代谢变化——而这些下游效应物更直接关联疾病表型。随着高通量测序、质谱等技术发展,组学(转录组、蛋白组、代谢组、单细胞组学)成为解决上述问题的关键工具:转录组学揭示基因表达与调控网络,蛋白组学解析信号通路与蛋白功能,代谢组学反映疾病进展的代谢重编程,单细胞组学解析肿瘤微环境的细胞异质性。本综述系统总结了单一组学与多组学整合在AML诊断、风险分层、预后预测及治疗中的应用,为AML精准医学提供了全面的组学视角。
2. 文献综述解析
核心评述逻辑
作者将AML的组学研究分为单一组学(转录组、蛋白组、代谢组)与多组学整合两类,分别阐述其在AML不同临床环节(诊断、预后、治疗)中的应用,并讨论组学技术的优势与局限性。
现有研究总结
- 单一组学的优势与结论:
转录组学:通过微阵列、RNA-seq等技术,明确不同细胞遗传学亚型(如t(8;21)、t(15;17))的基因表达簇,识别新融合基因(如CBFA2T3::GLIS2)及预后标志物(如HOXA9低表达提示良好预后);
蛋白组学:通过MALDI-TOF-MS、phosphoproteomics等技术,发现AML亚型特异性蛋白修饰(如t(8;21)的calreticulin乙酰化)、预后蛋白(如S100A8高表达提示不良预后)及耐药机制(如FLT3抑制剂耐药的S100A9上调);
代谢组学:通过NMR、LC-MS等技术,揭示AML的代谢异常(如FLT3-ITD的Warburg效应、IDH突变的2-HG积累),并构建代谢物风险评分(如6种糖代谢物预测生存)。 - 单一组学的局限性:
DNA层面的异常无法完全反映蛋白表达或功能(如IDH突变导致2-HG积累,但基因表达可能无显著变化);单一组学难以解析“基因-蛋白-代谢”的调控网络,无法全面解释疾病机制。
本综述的创新价值
作者首次系统整合了单一组学与多组学在AML中的应用,覆盖诊断(如区分不同亚型)、风险分层(如中间风险组的精准划分)、预后(如多组学标志物预测生存)及治疗(如耐药机制与联合策略)四大环节;同时讨论了组学在AML精准医学中的挑战(如数据整合、临床转化)与未来方向(如单细胞多组学、个性化治疗),为后续研究提供了清晰的框架。
3. 研究思路总结与详细解析
整体框架
研究目标:总结组学(单一组学与多组学)在AML诊断、预后、治疗中的应用,讨论组学技术的挑战与未来方向。
核心科学问题:组学如何解决AML当前的临床困境(风险分层不准确、耐药)?
技术路线:单一组学解析→多组学整合→治疗应用→挑战与方向。
分步骤解析
3.1 单一组学在AML中的应用
3.1.1 转录组学:基因表达与调控网络
- 实验目的:揭示AML的基因表达模式、调控网络及亚型差异。
- 方法细节:采用微阵列、RNA-seq( bulk/single-cell)分析AML患者骨髓/外周血样本的基因表达。
- 结果解读:
1. 亚型区分:t(8;21)、t(15;17)、inv(16)等细胞遗传学异常的AML具有独特的基因表达簇(如t(15;17)的X96719低表达,t(8;21)的X96719高表达);
2. 新融合基因:通过RNA-seq发现CBFA2T3::GLIS2融合基因,为儿童急性巨核细胞白血病(AMKL)的不良预后标志;
3. 预后标志物:HOXA9低表达与良好预后相关(OS更长),HSPG2高表达与不良预后相关(OS更短,复发率更高)。
- 产品关联:文献未提及具体实验产品,领域常规使用Illumina的RNA-seq试剂盒(如TruSeq Stranded mRNA)、10x Genomics的单细胞RNA-seq平台。
3.1.2 蛋白组学:蛋白功能与信号通路
- 实验目的:解析AML的蛋白表达、修饰及信号通路异常。
- 方法细节:采用MALDI-TOF-MS、ESI-MS/MS、phosphoproteomics分析AML患者样本的蛋白组与磷酸化蛋白组。
- 结果解读:
1. 亚型特异性蛋白:t(8;21)的calreticulin乙酰化、t(15;17)的PML-RARA融合蛋白磷酸化;
2. 预后标志物:S100A8高表达提示不良预后(特异性75%,敏感性70%),ICAM2高表达的中间风险组患者预后与不良风险组相似;
3. 耐药机制:FLT3抑制剂耐药细胞中S100A9上调,其调控因子BCL6成为潜在治疗靶点。
- 产品关联:文献未提及具体实验产品,领域常规使用AB Sciex的质谱仪(如TripleTOF 5600)、Cell Signaling Technology的磷酸化抗体。
3.1.3 代谢组学:代谢重编程与预后
- 实验目的:揭示AML进展中的代谢变化及预后关联。
- 方法细节:采用NMR、LC-MS分析AML患者血清/骨髓样本的代谢物谱。
- 结果解读:
1. 代谢异常:AML患者乳酸、2-HG(IDH突变)、鞘脂(t(8;21))水平升高;
2. 预后评分:6种糖代谢物(乳酸、2-Oxoglutarate、2-HG、丙酮酸、甘油-3-磷酸、柠檬酸)组成的风险评分,独立预测患者生存(高评分组OS更短);
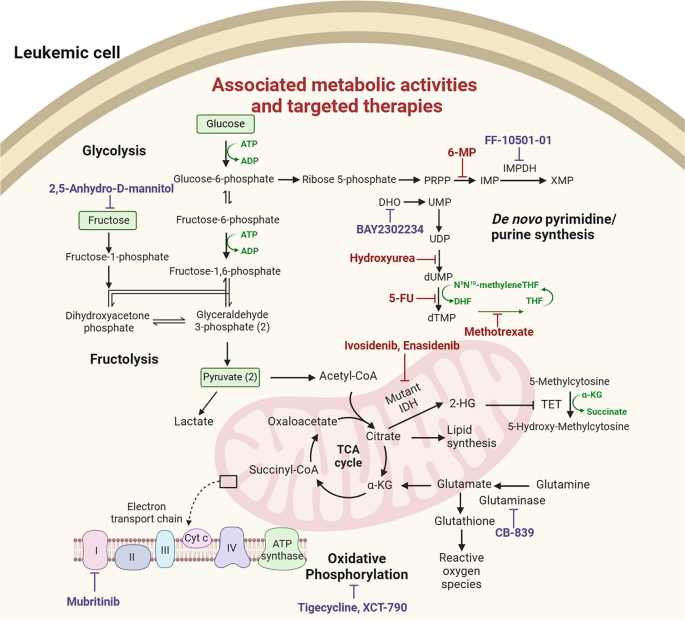
3. 治疗靶点:GLUT5(果糖转运体)高表达与不良预后相关,抑制GLUT5可增强化疗效果。
- 产品关联:文献未提及具体实验产品,领域常规使用Agilent的LC-MS系统、Bruker的NMR仪。
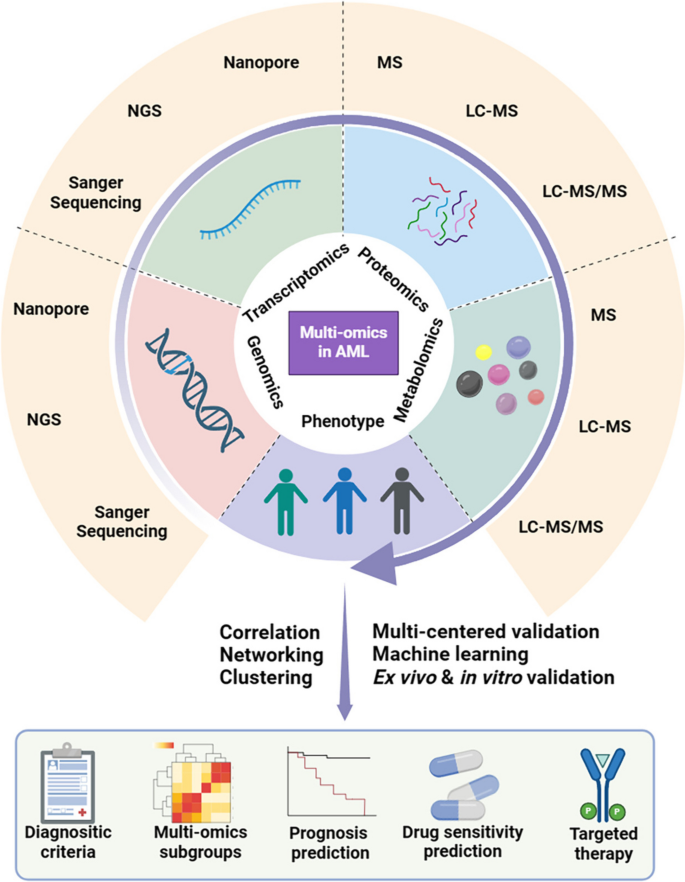
3.2 多组学整合:从“单一层面”到“网络解析”
- 实验目的:整合多组学数据,解决单一组学的局限性,提升临床应用价值。
- 方法细节:结合基因组(突变检测)、转录组(基因表达)、蛋白组(蛋白水平)、代谢组(代谢物)数据,采用生物信息学方法(如WGCNA、PCSF算法)构建调控网络。
- 结果解读:
- 风险分层:整合转录组与蛋白组数据,将KMT2A重排的AML分为两个亚型(MLLGA/MLLGB),MLLGA亚型对IMPDH抑制剂更敏感;
- 耐药机制:FLT3抑制剂耐药的“早期代谢重编程(脂质代谢异常)”与“晚期NRAS突变”,早期抑制AURKB可逆转耐药;
- 新靶点:SIRT3调控氧化磷酸化,抑制SIRT3可靶向白血病干细胞(LSC),且不影响正常造血。
- 产品关联:文献未提及具体实验产品,领域常规使用Cytoscape的网络分析工具、R语言的多组学整合包(如MOFA)。
3.3 组学在AML治疗中的应用
3.3.1 化疗:耐药机制与预测
- 实验目的:解析化疗耐药的分子机制,预测治疗反应。
- 方法细节:通过转录组(RNA-seq)、蛋白组(ESI-MS/MS)分析化疗敏感/耐药患者的样本。
- 结果解读:
1. 耐药基因:MEF2C磷酸化与化疗耐药相关,抑制MEF2C可增强化疗效果;
2. 预测标志物:annexin I高表达提示化疗完全缓解(CR),γ1 actin高表达提示耐药(P=0.0032)。
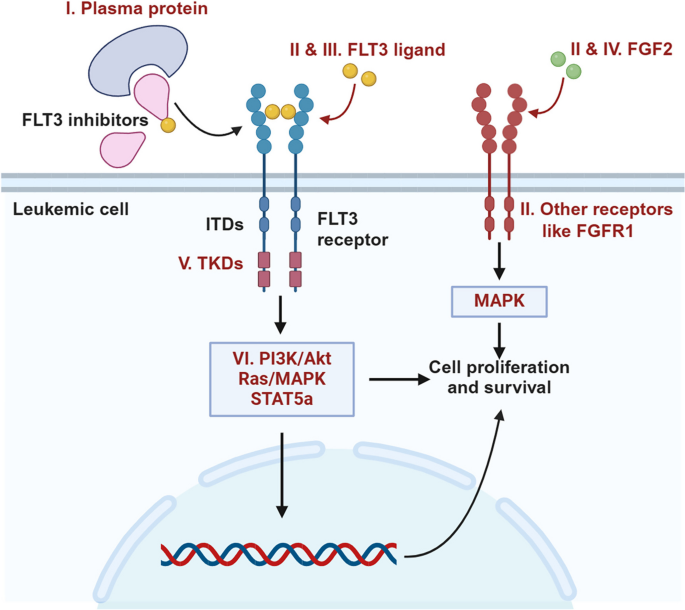
3.3.2 靶向治疗:耐药与联合策略
- 实验目的:解析靶向治疗(如FLT3、BCL2抑制剂)的耐药机制,开发联合策略。
- 方法细节:通过转录组(RNA-seq)、蛋白组(phosphoproteomics)分析靶向治疗前后的样本。
- 结果解读:
1. FLT3抑制剂耐药:S100A9上调(由BCL6调控),联合BCL6抑制剂可逆转耐药;
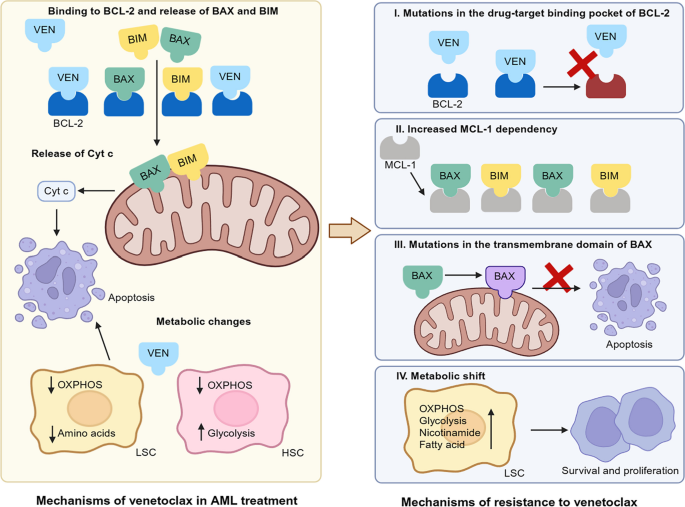
2. venetoclax耐药:MCL1上调(由RAS/MAPK通路激活),联合azacitidine可抑制MCL1,增强疗效;
3. 联合策略:FLT3抑制剂与DNA-PK抑制剂联合(抑制非同源末端连接通路),venetoclax与idasanutlin(MDM2抑制剂)联合(激活p53)。
3.3.3 免疫治疗:靶点与反应预测
- 实验目的:发现免疫治疗(如CAR-T、PD-1/PD-L1抑制剂)的靶点,预测治疗反应。
- 方法细节:通过单细胞RNA-seq、蛋白组(CyTOF)分析AML患者的免疫细胞谱。
- 结果解读:
1. CAR-T靶点:CSF1R、CD86高表达于AML blast,且不影响正常造血;
2. PD-1反应预测:CD4+ T细胞的TNF-α、IFN-γ高表达提示治疗反应(特异性90%,敏感性87%)。
3.4 挑战与未来方向
- 当前挑战:
- 概念转变:临床医生对组学的接受度不足,患者对高成本检测的认知有限;
- 分析策略:多组学数据整合难度大(如批次效应、数据异质性);
- 临床转化:多数biomarker未经过多中心验证,难以进入临床指南。
- 未来方向:
- 单细胞多组学:解析LSC与微环境的相互作用,发现更精准的治疗靶点;
- 与临床数据结合:构建“组学+临床特征”的预测模型,提升风险分层准确性;
- 个性化治疗:基于患者组学谱,选择针对性的治疗方案(如MLLGA亚型用IMPDH抑制剂)。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
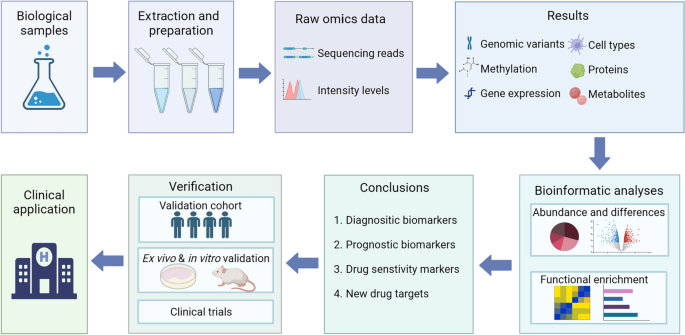
本综述涉及的Biomarker覆盖转录组、蛋白组、代谢组、多组学四大类型,筛选逻辑遵循“数据库筛选→细胞系/动物模型验证→临床样本验证”的闭环:
1. 转录组Biomarker:从TCGA、BeatAML等数据库筛选差异基因(如HOXA9、HSPG2),通过细胞系(如K562)验证功能,再通过临床样本(n=100+)验证预后关联;
2. 蛋白组Biomarker:通过质谱分析临床样本(n=50+)筛选差异蛋白(如S100A8、ICAM2),通过免疫组化(IHC)验证表达,再通过生存分析验证预后;
3. 代谢组Biomarker:通过LC-MS分析临床样本(n=400+)筛选差异代谢物(如2-HG、6种糖代谢物),通过ELISA验证浓度,再通过Cox模型构建风险评分;
4. 多组学Biomarker:整合转录组与蛋白组数据,筛选亚型特异性标志物(如MLLGA/MLLGB),通过药物敏感性实验验证治疗反应。
核心成果提炼
4.1 转录组Biomarker
- HOXA9:低表达提示良好预后(OS更长,DFS更长),是AML预后的最佳预测因子(n=199,P<0.01);
- HSPG2:高表达提示不良预后(OS更短,复发率更高),且表达水平随疾病进展升高(CR期降低,复发期升高)(n=7,P<0.05);
- MEF2C:磷酸化形式与化疗耐药相关,抑制MEF2C可增强阿糖胞苷的细胞毒性(n=87,P<0.01)。
4.2 蛋白组Biomarker
- S100A8:高表达提示不良预后(OS更短,化疗耐药),特异性75%,敏感性70%(n=54,P<0.05);
- ICAM2:高表达的中间风险组患者,预后与不良风险组相似(OS更短),可作为中间风险组的精准分层标志物(n=10,P<0.05);
- FLI1:高表达提示不良预后(CR率更低,复发率更高),与增殖相关蛋白(如Ki67)负相关(n=511,P<0.01)。
4.3 代谢组Biomarker
- 2-HG:IDH1/2突变患者的血清2-HG水平升高(特异性90.7%,敏感性86.9%),且CR期2-HG>200 ng/mL提示复发风险高(n=223,P<0.01);
- 6种糖代谢物:乳酸、2-Oxoglutarate、2-HG、丙酮酸、甘油-3-磷酸、柠檬酸组成的风险评分,独立预测生存(高评分组OS更短,HR=2.1,95% CI 1.5-2.9,n=400,P<0.001);
- ARA:高表达提示不良预后(外周血 blast更多),PGF2α高表达提示良好预后(blast更少)(n=20,P<0.05)。
4.4 多组学Biomarker
- KMT2A亚型:整合转录组与蛋白组数据,将KMT2A重排的AML分为MLLGA(高HOXA表达、DOT1L磷酸化)与MLLGB(低HOXA表达),MLLGA对IMPDH抑制剂更敏感(n=74,P<0.01);
- C1Q:多组学分析发现C1Q高表达与髓外浸润(EMI)相关,且提示早期复发(n=1,单细胞RNA-seq验证;n=100,临床样本验证,P<0.05)。
关键图片说明
- Figure 1:多组学在AML中的应用框架(整合基因组、转录组、蛋白组、代谢组数据,覆盖诊断、亚型、预后、药物敏感性、靶点发现);
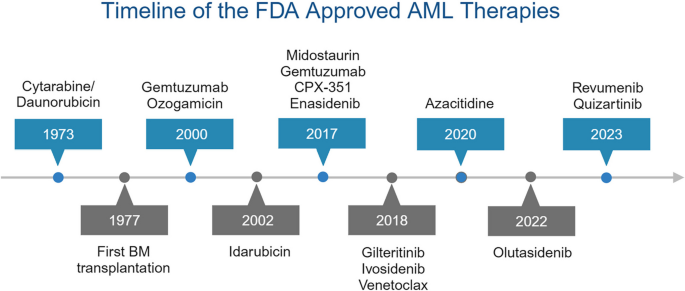
- Figure 2:FDA批准的AML治疗历史(从化疗到靶向治疗,如FLT3、IDH、BCL2抑制剂);
- Figure 3:组学研究的 workflow(样本收集→组学检测→数据处理→生物信息学分析→Biomarker/靶点验证);
- Figure 4:FLT3抑制剂耐药的机制(如FLT3突变、下游通路激活、代谢重编程);
- Figure 5:venetoclax耐药的机制(如BCL2突变、MCL1上调、代谢重编程);
- Figure 6:代谢通路的治疗靶点(如IDH、GLUT5、OXPHOS抑制剂)。
本综述通过全面的组学视角,为AML的精准诊断、预后预测及治疗提供了重要参考,也为未来多组学在血液肿瘤中的应用指明了方向。
