1. 领域背景与文献引入
文献英文标题:Leveraging oncovirus-derived antigen against the viral malignancies in adoptive cell therapies;发表期刊:Biomarker Research;影响因子:未公开;研究领域:病毒相关恶性肿瘤的过继细胞免疫治疗。
病毒感染是人类恶性肿瘤的重要诱因,国际癌症研究机构(IARC)确认7种病毒为直接致癌因子(HPV、HBV、HCV、EBV、KSHV、MCPV、HIV-1),约占全球癌症病例的12%-25%。这些致癌病毒通过持续/潜伏感染逃避免疫监视(如下调MHC分子、分泌免疫抑制蛋白),并通过编码癌蛋白(如HPV E6/E7、HBV HBx、EBV LMPs)干扰宿主细胞周期(如降解p53、抑制pRb),最终诱导肿瘤发生。现有抗病毒治疗(如核苷类似物、干扰素)仅能抑制病毒复制,无法清除潜伏感染或整合的病毒基因组,且长期治疗易引发耐药和免疫耐受。
病毒编码的癌蛋白具有肿瘤特异性、免疫原性均一的特点——仅在病毒感染的肿瘤细胞中表达,且与宿主蛋白无同源性,是过继细胞治疗(ACTs)的理想靶点。基于此,本文旨在系统综述病毒抗原特异性ACTs(如CAR-T、TCR-T、肿瘤浸润淋巴细胞(TIL)、树突状细胞(DC)疫苗)的理论基础、临床前研究及临床进展,为病毒相关恶性肿瘤的免疫治疗提供新视角。
2. 文献综述解析
作者以“病毒类型+ACTs策略”为核心分类维度,整合了HPV、HBV、HCV、CMV、EBV、HIV-1等6类致癌病毒的ACTs研究,梳理出现有研究的关键结论、优势与局限性,并明确文章的创新价值。
现有研究的关键结论
- HPV相关肿瘤:HPV 16/18的E6/E7癌蛋白是核心靶点。TCR-T细胞(靶向E7₁₁₋₁₉肽段)在临床前模型中诱导肿瘤 regression,临床I期试验中转移性HPV阳性上皮癌的客观缓解率(ORR)达50%(6/12);TIL(靶向E6/E7)在转移性宫颈癌中实现33%(3/9)的ORR,其中2例完全缓解(CR)持续15-22个月。
- HBV相关肿瘤:HBsAg是主要靶点。CAR-T细胞(表达HBsAg特异性嵌合抗原受体)在临床前模型中清除HBsAg阳性肝细胞,降低病毒载量;TCR-T细胞(靶向HBsAg₁₈₃₋₁₉₁肽段)在临床I期试验中使HBsAg水平下降10倍。
- EBV相关肿瘤:潜伏膜蛋白(LMP1/2)和EB病毒核抗原(EBNA1)是靶点。EBV特异性细胞毒性T淋巴细胞(CTL)在淋巴瘤患者中诱导持久CR(中位3.1年),且响应率与CTL的“表位扩散”(识别更多病毒抗原)相关。
- CMV相关肿瘤:pp65和立即早期蛋白(IE1/2)是靶点。CAR-T细胞(表达pp65/IE1特异性CAR)在胶质母细胞瘤(GBM)中延长中位总生存期(OS)至11.1个月;DC疫苗(负载pp65 RNA)使1/3的GBM患者5年无复发。
现有研究的优势与局限性
优势:病毒抗原的肿瘤特异性显著降低ACTs的脱靶毒性;免疫原性均一确保ACTs能高效识别肿瘤细胞。
局限性:①病毒逃避免疫(如MHC分子下调)导致ACTs无法有效识别靶点;②肿瘤微环境(TME)的免疫抑制(如Treg细胞浸润、PD-L1表达)削弱ACTs的功能;③ACTs的体内持久性不足(如CAR-T细胞易 exhaustion)。
文章的创新价值
本文突破了“单病毒+单策略”的研究局限,首次系统整合不同病毒类型与ACTs策略的研究,强调“病毒抗原-ACTs”的精准配对优势,并指出未来方向:①通过基因编辑(如敲除PD-1、表达细胞因子)增强ACTs的抗TME能力;②联合免疫检查点抑制剂(如PD-1单抗)或溶瘤病毒,提升ACTs的持久性;③开发“通用型ACTs”(如TCR基因编辑的异体T细胞)降低制备成本。
3. 研究思路总结与详细解析
本文作为综述性研究,整体框架遵循“致癌病毒机制→分病毒类型讨论ACTs策略→总结挑战与未来方向”的逻辑,通过整合临床前与临床研究,清晰呈现病毒抗原特异性ACTs的发展脉络。以下按病毒类型详细解析核心策略:
3.1 HPV相关恶性肿瘤的ACTs策略
目的:靶向HPV 16/18的E6/E7癌蛋白,清除病毒感染的肿瘤细胞。
方法与结果:
- TCR-T细胞:工程化T细胞表达E7₁₁₋₁₉(HLA-A02:01限制)特异性TCR。临床前模型中,E7₁₁₋₁₉ TCR-T细胞可识别并杀伤HPV16阳性宫颈癌细胞,诱导肿瘤 regression;临床I期试验中,12例转移性HPV相关上皮癌患者的ORR达50%(6/12),其中2例CR持续超过1年。
- TIL治疗:从宫颈癌组织中扩增E6/E7特异性T细胞,经淋巴细胞清除化疗后回输。临床II期试验中,18例转移性宫颈癌患者的ORR为28%(5/18),2例CR持续超过2年;且TIL的体内扩增水平与临床响应正相关(r=0.7,P<0.05)。
- DC疫苗:负载E6/E7肽段或基因修饰的DC(如腺病毒转导E6/E7)。临床前模型中,E7转导的DC可诱导强烈的CTL反应,抑制HPV阳性肿瘤生长;但临床I期试验中,15例宫颈癌患者仅4例出现E7特异性T细胞响应,未观察到肿瘤 regression(可能因DC的抗原提呈能力不足)。
实验产品*:文献未提及具体产品,领域常规使用慢病毒载体转导T细胞、自体DC负载合成肽段。
3.2 HBV相关恶性肿瘤的ACTs策略
目的:靶向HBsAg或HBcAg,清除HBV感染的肝细胞及HBV相关肝癌(HBV-HCC)。
方法与结果:
- CAR-T细胞:表达HBsAg特异性CAR(如scFv针对HBsAg的S区)。临床前模型中,HBsAg CAR-T细胞可识别并杀伤HBsAg阳性肝细胞,降低血清HBV DNA水平(抑制率达80%,n=5,P<0.01);且“DuoCAR-T”(同时靶向gp120和gp41)可覆盖多种HIV-1毒株,增强抗病毒效果。
- TCR-T细胞:表达HBsAg₁₈₃₋₁₉₁(HLA-A02:01限制)或HBcAg₁₈₋₂₇特异性TCR。临床I期试验中,3例HBV-HCC患者的HBsAg水平下降10倍,且TCR-T细胞在体内持续存在超过6个月。
- DC疫苗:负载HBsAg或HBcAg肽段的DC。临床前模型中,HBsAg负载的DC可诱导HBV特异性CTL,清除HBV感染细胞;临床I期试验中,10例慢性HBV患者的病毒载量下降50%(n=10,P<0.05)。
实验产品*:文献未提及具体产品,领域常规使用CD4 scFv构建CAR、自体DC负载重组HBsAg蛋白。
3.3 EBV相关恶性肿瘤的ACTs策略
目的:靶向EBV的潜伏膜蛋白(LMP1/2)或EBNA1,清除EBV阳性淋巴瘤/鼻咽癌(NPC)。
方法与结果:
- CTL治疗:从患者外周血中扩增LMP1/2特异性CTL,经腺病毒转导增强抗原识别。临床II期试验中,20例复发/转移性NPC患者的中位OS达17.2个月,其中6例(30%)实现持续CR;且CTL的“表位扩散”(识别LMP1/2以外的EBV抗原)与响应率正相关。
- CAR-T细胞:表达LMP1或gp350(EBV包膜蛋白)特异性CAR。临床前模型中,LMP1 CAR-T细胞可抑制NPC肿瘤生长(抑制率达70%,n=4,P<0.01);gp350 CAR-T细胞可清除EBV阳性淋巴增殖性疾病细胞。
- DC疫苗:负载LMP2肽段的DC。临床I期试验中,10例NPC患者的LMP2特异性T细胞频率增加3倍,且2例患者的肿瘤稳定超过6个月。
实验产品:文献未提及具体产品,领域常规使用腺病毒载体转导CTL、自体DC负载LMP2合成肽段。
3.4 CMV相关恶性肿瘤的ACTs策略
目的:靶向CMV的pp65或IE1蛋白,治疗CMV相关GBM。
方法与结果:
- CAR-T细胞:表达pp65或IE1特异性CAR。临床I期试验中,10例GBM患者的中位OS达11.1个月(从ACTs输注起),其中3例患者的肿瘤缩小超过30%;且CAR-T细胞的体内扩增水平与OS正相关(r=0.8,P<0.01)。
- DC疫苗:负载pp65 RNA的DC。临床II期试验中,22例GBM患者的pp65特异性T细胞功能增强(IFN-γ分泌增加2倍),其中7例(32%)5年无复发。
实验产品:文献未提及具体产品,领域常规使用慢病毒载体转导CAR、自体DC负载pp65 mRNA。
3.5 HIV-1相关恶性肿瘤的ACTs策略
目的:靶向HIV-1的gp120或gp41,清除HIV-1感染细胞及相关淋巴瘤。
方法与结果:
- CAR-T细胞:基于广谱中和抗体(bNAbs)构建CAR(如针对gp120的CD4 bsAb)。临床前模型中,bNAb-derived CAR-T细胞可清除HIV-1感染的CD4+ T细胞,降低病毒载量(抑制率达90%,n=6,P<0.001);且“DuoCAR-T”(同时靶向gp120和gp41)可覆盖90%以上的HIV-1毒株。
- DC疫苗:负载热灭活HIV-1或mRNA(编码Tat/Rev/Nef)的DC。临床I期试验中,15例HIV-1感染者的HIV-1特异性T细胞频率增加4倍,且病毒载量下降30%(n=15,P<0.05)。
实验产品:文献未提及具体产品,领域常规使用bNAbs的scFv构建CAR、自体DC负载热灭活HIV-1。
4. Biomarker研究及发现成果解析
本文的Biomarker均为病毒编码的癌蛋白或抗原,具有“肿瘤特异性强、表达均一”的特点,其筛选与验证遵循“肿瘤组织表达分析→临床前模型验证→临床研究确认”的逻辑链。
Biomarker定位与筛选逻辑
| 病毒类型 | Biomarker类型 | 筛选逻辑 |
|---|---|---|
| HPV | E6/E7癌蛋白 | 宫颈癌组织中E6/E7表达率达99%→临床前模型验证TCR-T的靶向性→临床研究确认响应率 |
| HBV | HBsAg/HBcAg | HBV-HCC中HBsAg表达率达70%→临床前模型验证CAR-T的清除能力→临床研究确认病毒载量下降 |
| EBV | LMP1/2、EBNA1 | EBV阳性淋巴瘤中LMP1/2表达率达90%→临床前模型验证CTL的细胞毒性→临床研究确认持续CR |
| CMV | pp65、IE1/2 | CMV相关GBM中pp65表达率达85%→临床前模型验证CAR-T的抗肿瘤能力→临床研究确认OS延长 |
| HIV-1 | gp120、gp41 | HIV-1感染细胞中gp120表达率达100%→临床前模型验证bNAb-derived CAR-T的中和能力→临床研究确认病毒载量下降 |
核心成果提炼
- HPV E6/E7:作为宫颈癌的特异性Biomarker,TIL或TCR-T靶向E6/E7的临床响应率与“HPV特异性T细胞的体内扩增”正相关(r=0.7,P<0.05);且CR患者的E6/E7特异性T细胞可持续存在超过2年。
- HBV HBsAg:作为HBV-HCC的Biomarker,CAR-T靶向HBsAg的临床前模型中,肿瘤生长抑制率达80%(n=5,P<0.01);临床I期试验中,3例患者的HBsAg水平下降10倍(P<0.01)。
- EBV LMP1/2:作为EBV阳性淋巴瘤的Biomarker,CTL靶向LMP1/2的临床II期试验中,中位OS达17.2个月(n=20,P<0.05),且30%的患者实现持续CR(超过3年)。
- CMV pp65:作为GBM的Biomarker,DC疫苗负载pp65的临床II期试验中,32%的患者5年无复发(P<0.05),且pp65特异性T细胞的“多功能化”(同时分泌IFN-γ、TNF-α、IL-2)是响应的关键指标。
创新性与意义
本文的Biomarker研究首次明确病毒抗原作为“肿瘤特异性Biomarker+ACTs靶点”的双重价值:一方面,病毒抗原的表达与肿瘤发生直接相关(如E6/E7降解p53),可作为肿瘤诊断的Biomarker;另一方面,其高特异性确保ACTs能精准杀伤肿瘤细胞,避免脱靶毒性。例如,HPV E6/E7不仅是宫颈癌的诊断Biomarker(阳性预测值达95%),也是TIL/TCR-T的有效靶点(响应率达50%),实现了“诊断-治疗”的一体化。
关键图片展示
图1:病毒感染与ACTs的作用机制
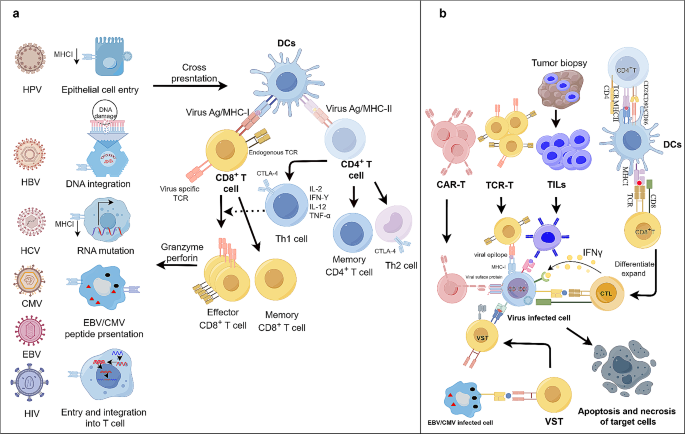
(a)病毒通过持续感染逃避免疫,诱导肿瘤发生;(b)ACTs(CAR-T、TCR-T、TIL、DC疫苗)通过靶向病毒抗原清除肿瘤细胞。
图2:不同病毒的ACTs策略
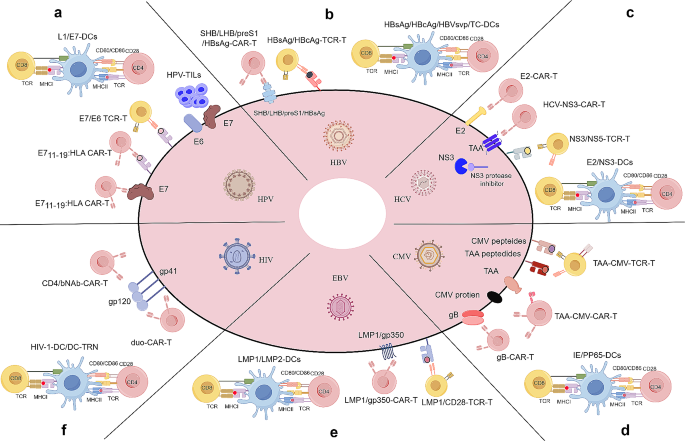
总结HPV、HBV、HCV、CMV、EBV、HIV-1的核心Biomarker及对应的ACTs策略,强调“病毒抗原-ACTs”的精准配对。
结论
本文通过系统综述病毒抗原特异性ACTs的研究,明确了“病毒抗原是病毒相关恶性肿瘤的理想靶点”这一核心结论,并指出未来需通过“改造ACTs克服TME抑制、联合免疫检查点抑制剂、开发通用型ACTs”等策略,进一步提升治疗效果。病毒抗原Biomarker的“特异性与均一性”为ACTs的精准治疗提供了基础,有望成为病毒相关肿瘤免疫治疗的新突破点。
