1. 领域背景与文献引入
文献英文标题:Deciphering metabolic heterogeneity in retinoblastoma unravels the role of monocarboxylate transporter 1 in tumor progression;发表期刊:Biomarker Research;影响因子:未公开;研究领域:儿童视网膜母细胞瘤代谢异质性与分子靶向治疗
视网膜母细胞瘤(retinoblastoma, RB)是儿童最常见的原发性眼内恶性肿瘤,全球年发病率约1/15000至1/20000。当前治疗手段包括眼球摘除、化疗、激光光凝等,但对于晚期伴玻璃体种植或视神经侵犯的病例,疗效仍有限,5年生存率仅约70%。肿瘤代谢重编程是癌症的核心特征之一,其中糖酵解增强(Warburg效应)及乳酸积累促进肿瘤微环境酸化,利于肿瘤增殖、侵袭,但RB的代谢异质性研究仍较匮乏——现有研究多聚焦于RB的缺氧微环境,缺乏单细胞水平的代谢通路解析;单羧酸转运蛋白(monocarboxylate transporter, MCT)家族作为乳酸转运的关键蛋白,在其他肿瘤(如胶质瘤、乳腺癌)中被证实为治疗靶点,但在RB中的表达及功能尚未明确。因此,本研究旨在通过单细胞转录组测序解析RB的代谢景观,揭示MCT1在RB进展中的作用,为RB的精准治疗提供新的分子靶点。
2. 文献综述解析
文献综述部分首先总结了RB的临床治疗困境:现有治疗对晚期病例效果有限,亟需探索代谢重编程等新靶点;其次,强调肿瘤代谢异质性是肿瘤适应微环境的关键,但RB的代谢异质性研究不足;再者,MCT家族通过调节乳酸代谢影响肿瘤进展,但RB中MCT的功能及临床意义尚未明确。
现有研究的局限性主要体现在三点:① 缺乏单细胞水平的RB代谢异质性分析,无法揭示不同细胞亚群的代谢差异;② 未系统探究MCT家族在RB中的作用,尤其是MCT1的功能;③ 缺乏MCT1与RB临床病理特征(如视神经侵犯)的相关性研究。
本研究的创新点在于:① 首次在单细胞水平解析RB的代谢景观,发现糖酵解是RB代谢异质性的关键驱动因素;② 明确MCT1是RB中主要的乳酸转运体,其高表达与肿瘤进展相关;③ 通过体内外实验验证MCT1抑制剂AZD3965的治疗潜力,并揭示其与RB临床预后的相关性。
3. 研究思路总结与详细解析
本研究的整体框架为“单细胞代谢景观构建→MCT1表达验证→MCT1功能实验(体外+体内)→临床相关性分析”,通过多层面实验揭示MCT1在RB中的作用。
3.1 单细胞代谢景观构建与分析
实验目的是解析RB与正常视网膜的单细胞代谢异质性,明确关键代谢通路。方法细节:整合11个RB样本(来自GSE249995、GSE168434)和5个正常视网膜样本(来自E-MTAB-7316)的单细胞转录组数据,通过t-SNE聚类、PCA分析代谢基因表达模式,利用GSEA分析富集的代谢通路,计算代谢通路活性(加权基因表达平均值)及与缺氧的相关性。
结果解读:t-SNE图显示RB与正常视网膜细胞聚类明显分离(Fig.1);RB细胞中糖酵解/糖异生通路活性显著高于氧化磷酸化(OXPHOS),且糖酵解活性与缺氧 signatures 显著相关(多数细胞类型中相关系数>0.5,Fig.2)。这表明糖酵解是RB代谢异质性的关键驱动因素,且与缺氧微环境密切相关。
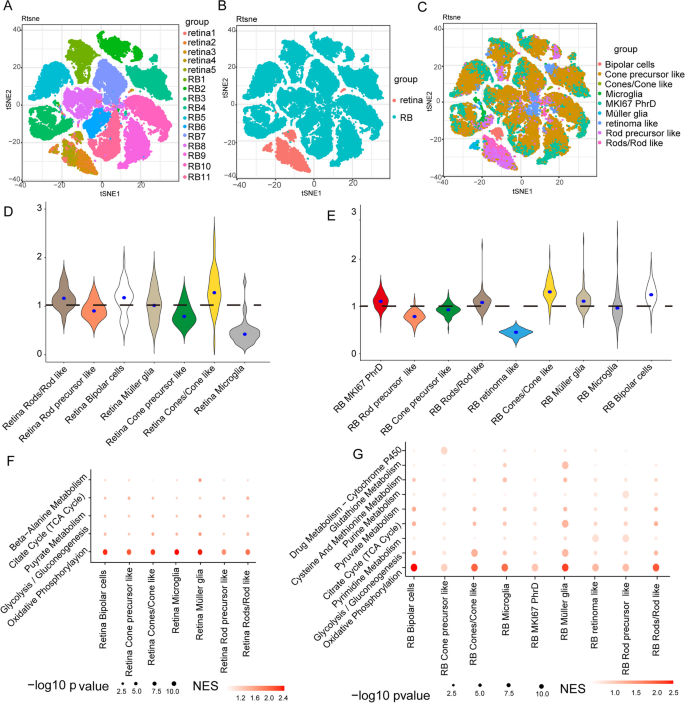
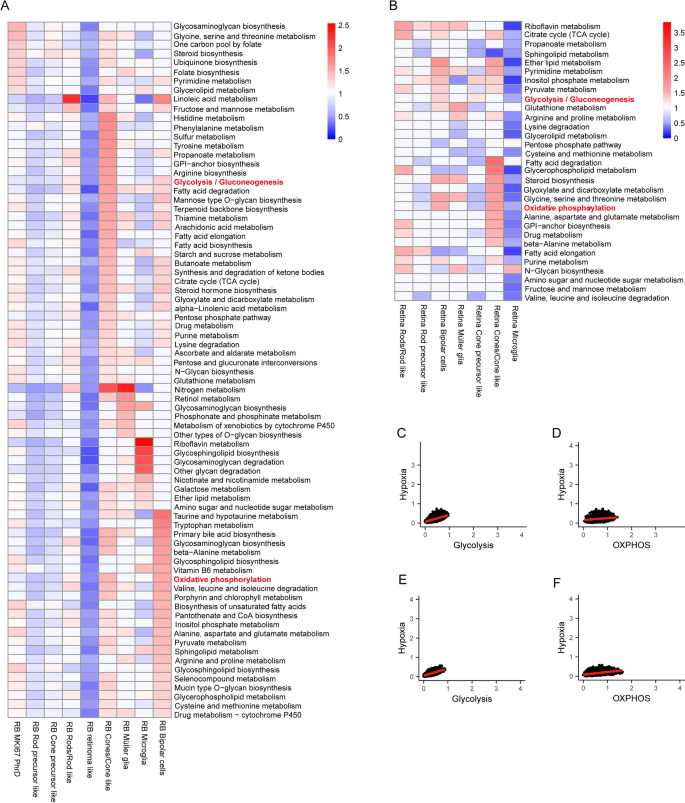
产品关联:数据来源于GEO、ArrayExpress数据库,分析工具为R软件(prcomp函数)、javaGSEA,代码来自Locasale Lab的GitHub(https://github.com/LocasaleLab/Single-Cell-Metabolic-Landscape);领域常规使用10x Genomics单细胞测序试剂盒。
3.2 MCT1表达水平验证
实验目的是验证MCT1在RB组织及细胞系中的表达。方法细节:通过scRNA-seq数据分析MCT家族(MCT1、MCT2、MCT3、MCT4)的表达,选取MCT1进行后续验证;采用免疫荧光(RB组织、细胞系)、免疫组化(47例RB临床样本)、Western blot(RB细胞系WERI-Rb1、Y79及正常视网膜色素上皮细胞ARPE-19)检测MCT1的表达。
结果解读:scRNA-seq显示MCT1(SLC16A1)在RB细胞中表达最高,尤其是MKI67+增殖性细胞(Fig.3A-C);免疫荧光及免疫组化证实RB组织中MCT1阳性表达(Fig.3D);Western blot显示RB细胞系中MCT1蛋白水平显著高于ARPE-19细胞(WERI-Rb1中MCT1表达是ARPE-19的2.5倍,n=3,P<0.0001,Fig.3F-G)。
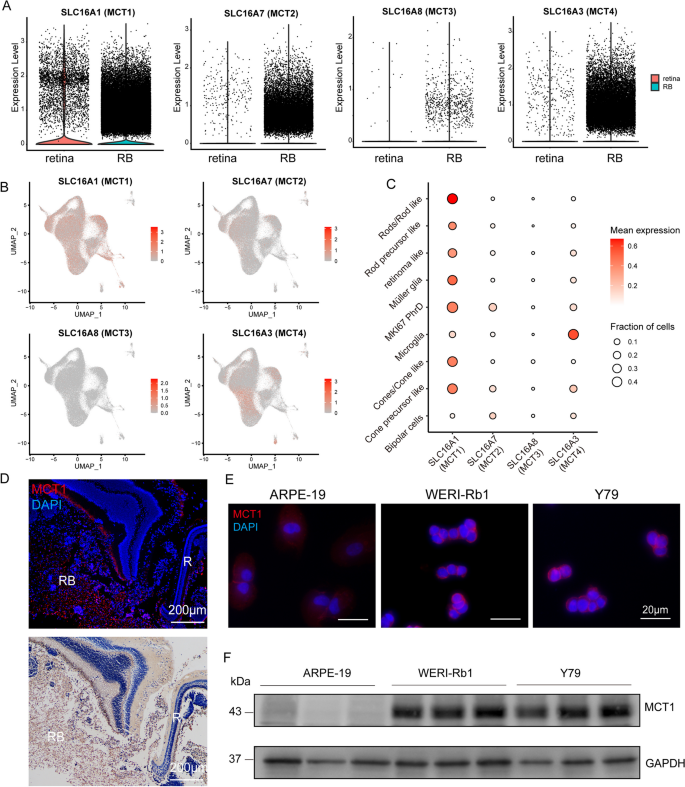
产品关联:免疫荧光及免疫组化使用ProteinTech的MCT1抗体(货号20139-1-AP);Western blot使用ProteinTech的MCT1抗体(1:10000)及GAPDH内参抗体(1:10000,货号10494-1-AP);RB细胞系WERI-Rb1、Y79及正常细胞系ARPE-19均来自ATCC。
3.3 MCT1体外功能实验
实验目的是探究MCT1对RB细胞活力、代谢及信号通路的影响。方法细节:用MCT1抑制剂AZD3965(0-1000nM)处理RB细胞系,或用siRNA(siMCT1-3,100nM)敲低MCT1;通过CCK8 assay检测细胞活力,EdU染色检测增殖,乳酸检测试剂盒检测intracellular乳酸水平,ATP/ADP ratio试剂盒检测能量状态,JC-1染色检测线粒体膜电位,Western blot检测AMPK/mTOR/S6通路的磷酸化水平(pAMPK、pmTOR、pS6)。
结果解读:AZD3965剂量依赖性降低RB细胞活力(100nM时WERI-Rb1活力下降40%,n=3,P<0.001);siMCT1-3敲低后细胞活力下降35%(n=3,P<0.01);EdU染色显示增殖细胞比例从45%降至15%(n=3,P<0.0001);intracellular乳酸水平增加2倍(n=3,P<0.01),ATP/ADP ratio升高1.5倍(n=3,P<0.05),线粒体膜电位降低(JC-1绿色/红色荧光比升高2倍,n=3,P<0.01);Western blot显示pAMPK升高1.8倍(n=3,P<0.01),pmTOR、pS6分别降低0.5倍、0.4倍(n=3,P<0.01、P<0.001,Fig.4)。这些结果表明,抑制MCT1可通过干扰乳酸代谢、激活AMPK通路抑制RB细胞增殖。
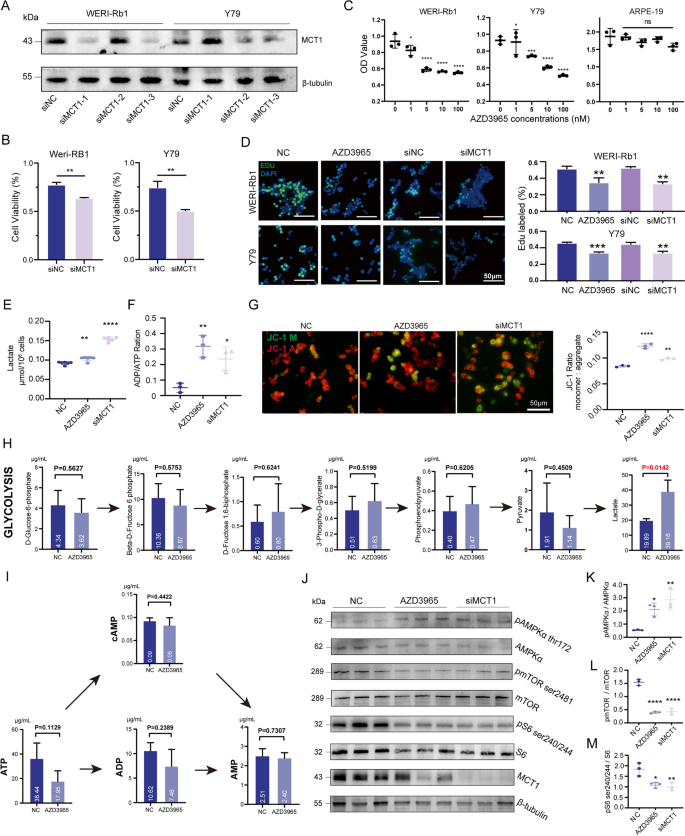
产品关联:AZD3965来自Selleck Chemicals(货号S7339);siRNA来自HanYi Biosciences;CCK8试剂盒是Vazyme的A311-01;EdU试剂盒是Beyotime的C0071;乳酸检测试剂盒是Solarbio的BC2230;ATP/ADP ratio试剂盒是Abnova的KA1673;JC-1试剂盒是Solarbio的M8650;Western blot抗体来自Cell Signaling Technology(pAMPK:#50081;pS6:#5364;pmTOR:#2974)。
3.4 MCT1体内功能验证
实验目的是验证MCT1抑制剂AZD3965对RB体内生长的抑制作用。方法细节:构建WERI-Rb1裸鼠眼内异种移植模型(1×10^5细胞/眼),术后立即注射不同剂量的AZD3965(1nM、10nM、100nM)或PBS,28天后处死小鼠,检测肿瘤 incidence、大小及病理特征;另构建肿瘤 regression 模型(14天后注射100nM AZD3965),检测肿瘤负荷、凋亡(TUNEL)、增殖(Ki67)及信号通路(pAMPK/pmTOR/pS6)。
结果解读:AZD3965剂量依赖性抑制肿瘤生长(Fig.5);100nM时肿瘤 incidence 从100%降至60%(n=5,P<0.05),肿瘤面积减少50%(n=5,P<0.01);TUNEL染色显示凋亡细胞比例增加3倍(n=5,P<0.001),Ki67阳性细胞比例降低40%(n=5,P<0.001,Fig.6);免疫组化显示pAMPK升高,pmTOR、pS6降低。这些结果证实AZD3965可有效抑制RB体内肿瘤生长。
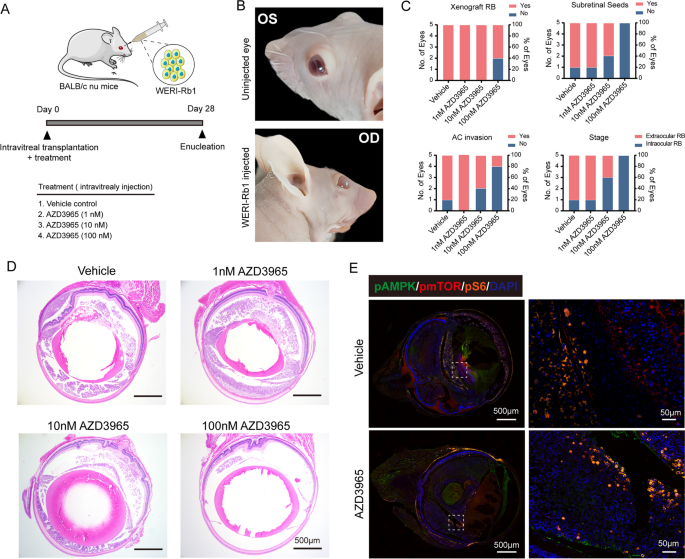
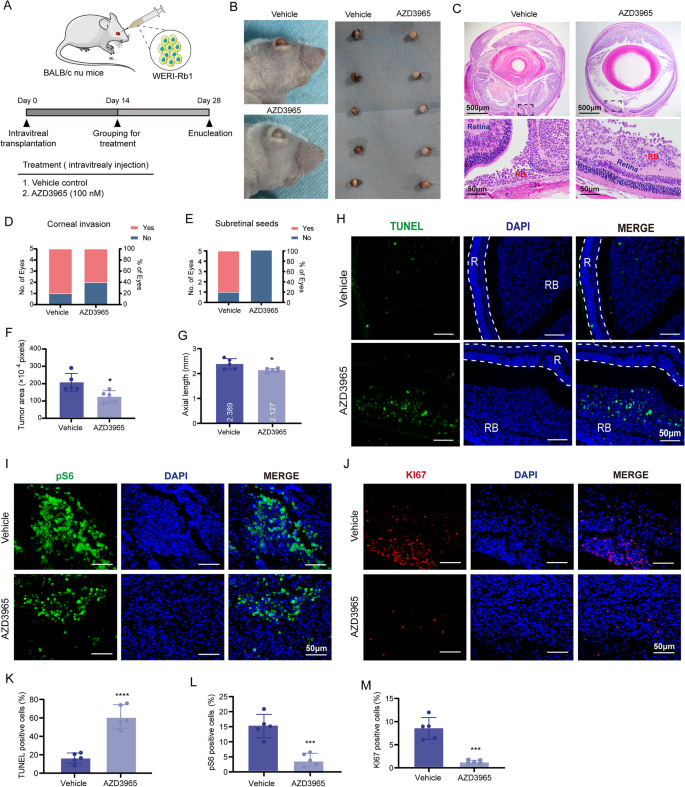
产品关联:裸鼠来自Zhuhai BesTest Bio-Tech;AZD3965来自Selleck Chemicals;TUNEL试剂盒是Beyotime的C1088;免疫组化抗体同前。
3.5 MCT1临床相关性分析
实验目的是探究MCT1表达与RB临床病理特征的相关性。方法细节:用GEPIA分析泛癌中MCT1(SLC16A1)的表达,免疫组化检测47例RB患者的MCT1表达(IRS评分:阳性比例×强度,≥4为高表达),分析其与临床参数(如视神经侵犯、性别、年龄)的相关性。
结果解读:GEPIA显示SLC16A1在12种肿瘤中高表达,且与不良预后相关;47例RB患者中,MCT1高表达占76.6%(36/47),高表达与视神经侵犯显著相关(P=0.0044);Western blot显示眼外RB样本中MCT1表达高于眼内样本(1.5倍,n=4,P<0.05,Fig.7)。
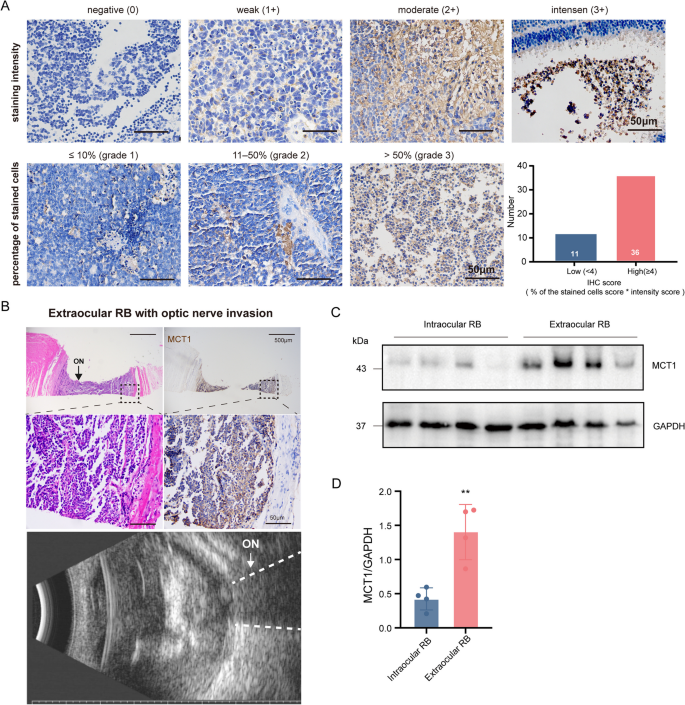
产品关联:GEPIA数据库(http://gepia.cancer-pku.cn);免疫组化抗体来自ProteinTech(MCT1:20139-1-AP)。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究的Biomarker为单羧酸转运蛋白1(MCT1,编码基因SLC16A1),类型为蛋白 Biomarker。筛选逻辑为“scRNA-seq筛选MCT家族高表达成员→组织/细胞系验证表达→体内外功能验证→临床样本关联预后”,形成完整的验证链条。
研究过程详述
Biomarker来源:RB组织、细胞系(WERI-Rb1、Y79)、临床样本(47例RB患者)。验证方法:① 免疫荧光验证MCT1在RB组织及细胞系中的表达;② 免疫组化验证MCT1在临床样本中的表达(IRS评分);③ Western blot验证MCT1在细胞系及临床样本中的蛋白水平。
特异性与敏感性:MCT1在RB细胞中高表达,而在正常视网膜色素上皮细胞中低表达;47例RB患者中MCT1高表达占76.6%,与视神经侵犯的相关性具有统计学意义(P=0.0044)。
核心成果提炼
MCT1是RB的预后Biomarker,高表达与视神经侵犯相关(P=0.0044),提示其可作为RB预后判断的指标;同时,MCT1是RB的治疗靶点,抑制剂AZD3965可抑制RB细胞增殖及体内肿瘤生长。本研究的创新性在于首次揭示MCT1在RB中的功能及临床意义,为RB的预后判断及靶向治疗提供了新的生物标志物。
综上,本研究通过单细胞代谢分析、功能实验及临床相关性研究,明确MCT1是RB进展的关键驱动因素及治疗靶点,为RB的精准治疗提供了重要的理论依据。
