1. 领域背景与文献引入
文献英文标题:Small molecule tyrosine kinase inhibitors modulated blood immune cell counts in patients with oncogene-driven NSCLC;发表期刊:Biomarker Research;影响因子:未公开;研究领域:非小细胞肺癌(NSCLC)靶向治疗与免疫微环境互作
非小细胞肺癌(NSCLC)是全球癌症死亡的主要原因之一,约25%的患者携带EGFR、ALK、ROS1等驱动基因突变。小分子酪氨酸激酶抑制剂(TKIs)如奥希替尼、阿来替尼等通过特异性抑制驱动基因信号通路,显著延长了这类患者的无进展生存期(PFS)和总生存期(OS),成为驱动基因阳性NSCLC的标准治疗方案。然而,免疫检查点抑制剂(ICIs,如PD-1/PD-L1抑制剂)在驱动基因阳性NSCLC中的临床疗效远差于驱动基因阴性患者,即使部分患者肿瘤高表达PD-L1,ICIs响应率仍不足20%。现有研究认为,驱动基因阳性肿瘤的内在特征(如PD-L1低表达、肿瘤突变负荷TMB低)及肿瘤微环境(如肿瘤浸润淋巴细胞TILs少、调节性T细胞增加)是ICIs疗效不佳的主要原因,但这些机制无法完全解释高PD-L1患者的无响应现象。
此外,TKIs作为靶向治疗药物,其对患者免疫系统的调制作用尚未被系统研究。外周血免疫细胞计数(如绝对淋巴细胞计数ALCs)已被报道为ICIs疗效的潜在生物标志物,但TKIs治疗后这些免疫细胞的动态变化与临床疗效的关联仍不明确。当前研究空白在于:缺乏TKIs对驱动基因阳性NSCLC患者外周血免疫细胞的影响分析,以及对应的疗效预测生物标志物,同时缺乏体外模型研究TKIs与ICIs的相互作用。本研究旨在填补这一空白,通过分析驱动基因阳性NSCLC患者接受TKIs治疗后外周血免疫细胞的变化,关联临床疗效,并建立患者来源的体外模型探讨TKIs与ICIs的相互作用,为优化这类患者的免疫联合治疗策略提供依据。
2. 文献综述解析
作者通过梳理现有研究,将驱动基因阳性NSCLC对ICIs疗效不佳的机制分为三类:一是肿瘤内在特征(PD-L1低表达、TMB低);二是肿瘤微环境特征(TILs少、M2型巨噬细胞浸润增加);三是驱动基因信号通路对免疫的抑制(如EGFR激活通过PI3K/AKT通路上调PD-L1并诱导调节性T细胞增殖)。现有研究的局限性在于:这些机制无法解释部分高PD-L1或高TMB的驱动基因阳性患者对ICIs无响应的现象,且缺乏TKIs对免疫细胞调制作用的研究——TKIs虽能抑制肿瘤生长,但可能通过调节免疫细胞功能影响后续ICIs的疗效,这一环节尚未被探索。
此外,现有研究已证实ALCs、CD4+CD8+细胞计数等外周血免疫细胞指标是ICIs疗效的生物标志物,但TKIs治疗后这些指标的动态变化与临床疗效的关系仍未明确。本研究的创新点在于:首次系统分析TKIs对驱动基因阳性NSCLC患者外周血免疫细胞的调制作用,结合临床疗效评估其预后价值,并利用患者来源的肿瘤细胞与外周血单个核细胞(PBMCs)共培养模型,探索TKIs与ICIs的相互作用——这不仅填补了TKIs对免疫细胞影响的研究空白,更为驱动基因阳性NSCLC的免疫联合治疗提供了新的理论依据。
3. 研究思路总结与详细解析
本研究采用“临床队列分析-免疫细胞动态监测-疗效关联-体外模型验证”的闭环研究思路,目标是明确TKIs对驱动基因阳性NSCLC患者外周血免疫细胞的调制作用及与临床疗效的关系,同时探索TKIs与ICIs的相互作用。研究分为四个关键环节:患者队列建立与基线特征分析、外周血免疫细胞表型及动态变化分析、免疫细胞变化与临床疗效的关联分析、患者来源体外模型构建与药物相互作用研究。
3.1 患者队列建立与基线特征分析
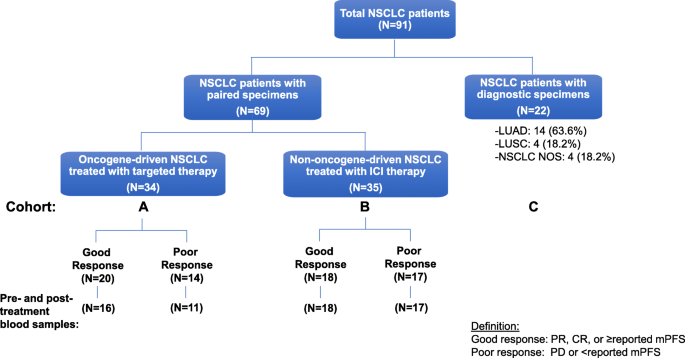
实验目的是明确不同队列(驱动基因阳性接受TKIs、驱动基因阴性接受ICIs、未治疗)NSCLC患者的基线特征及外周血免疫细胞差异。方法细节:回顾性纳入91例NSCLC患者,分为三个队列——队列A(34例,驱动基因阳性,接受TKIs治疗,其中27例有治疗前后血样)、队列B(35例,驱动基因阴性,接受ICIs治疗,均有治疗前后血样)、队列C(22例,未治疗,仅基线血样)。收集患者性别、年龄、病理类型、驱动基因状态等临床数据,及血常规、流式细胞术检测的13项外周血免疫细胞指标(如CD3%、ALCs、CD4+细胞计数)。
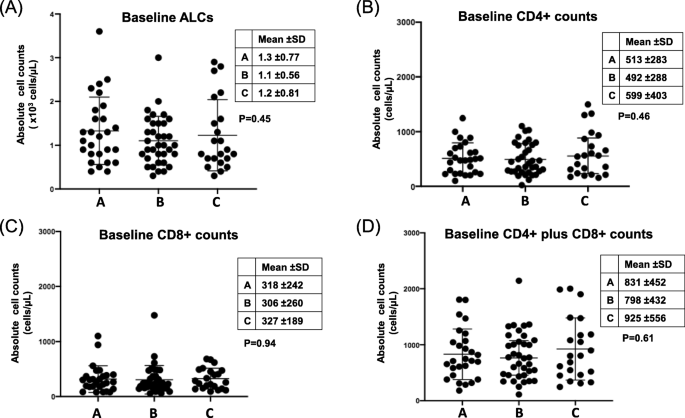
结果解读:队列A患者中女性(65%)、亚洲人(50%)、肺腺癌(97%)比例显著高于队列B和C(P<0.05),符合驱动基因阳性NSCLC的临床特征;基线时,队列A的CD3+ T细胞比例(CD3%)显著低于队列B和C(P<0.05),但其他12项免疫细胞指标(如ALCs、CD4+、CD8+细胞计数)在三个队列间无显著差异(图1、表3)。
产品关联:文献未提及具体患者招募及数据收集的产品,领域常规使用电子病历系统(EMR)收集临床数据,血常规检测使用全自动血细胞分析仪(如Sysmex XN系列)。
3.2 外周血免疫细胞表型及动态变化分析
实验目的是检测TKIs或ICIs治疗后外周血免疫细胞的表型变化。方法细节:采集患者治疗前后的外周血,通过Ficoll-Paque密度梯度离心分离PBMCs,采用两种流式细胞术策略——1)常规多色流式细胞术(BD Fortessa)检测CD3、CD4、CD8等主要T细胞亚群的比例及计数;2)24色光谱流式细胞术(Cytek Aurora)分析更广泛的免疫细胞亚群(如NK细胞、B细胞、单核细胞)。结果通过FlowJo 7.6.1或Cytobank软件分析。
结果解读:队列A患者接受TKIs治疗后,CD3%显著升高(6.4±2.5%,P=0.041),而白细胞计数WBC(-3.5±1.1×10³ cells/μL,P=0.015)、绝对中性粒细胞计数ANCs(-3.6±1.1 cells/μL,P=0.014)、衍生中性粒细胞淋巴细胞比dNLR(-2.4±1.2,P=0.027)显著降低;队列B患者接受ICIs治疗后,ALCs(1300±800 vs 1100±600×10³ cells/μL,P<0.001)、CD4+(593±297 vs 503±284 cells/μL,P=0.004)、CD8+(400±476 vs 280±323 cells/μL,P=0.006)细胞计数均显著升高(表4、表5,图2)。
产品关联:实验所用关键产品:BD Fortessa多色流式细胞仪、Cytek Aurora光谱流式细胞仪、FlowJo 7.6.1流式分析软件、Cytobank数据分析平台。
3.3 免疫细胞变化与临床疗效的关联分析
实验目的是明确免疫细胞变化与TKIs/ICIs临床疗效的关系。方法细节:根据RECIST 1.1标准评估患者临床疗效(完全缓解CR、部分缓解PR、稳定SD、进展PD),将患者分为良好响应组(CR+PR+SD)和不良响应组(PD)。采用Wilcoxon秩和检验比较两组患者治疗前后免疫细胞的变化,并用Cox比例风险模型分析免疫细胞计数与PFS、OS的关联。
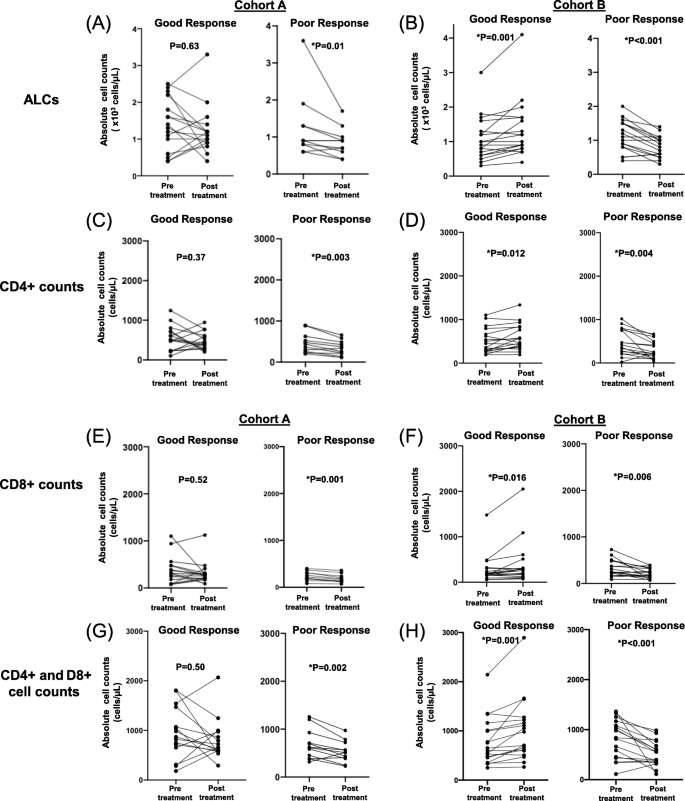
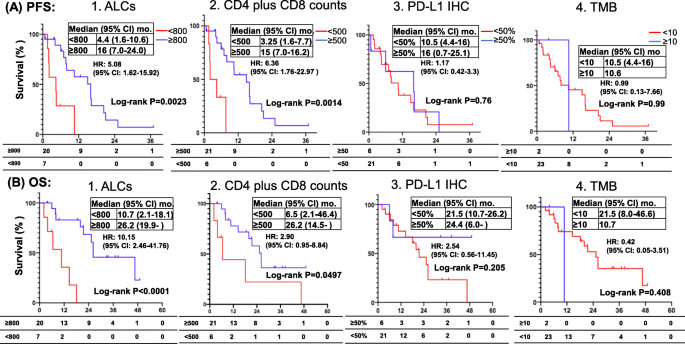
结果解读:队列A中,11例TKIs不良响应患者的ALCs、CD4+、CD8+、CD4+CD8+细胞计数均显著降低(P<0.05);16例良好响应患者中,仅62.5%的患者ALCs降低,37.5%的患者ALCs升高(图3左)。队列B中,18例ICIs良好响应患者的ALCs、CD4+、CD8+细胞计数显著升高(P<0.05),17例不良响应患者则显著降低(图3右)。进一步生存分析显示:队列A患者治疗后ALCs≥800 cells/μL的患者,PFS(16.0 vs 4.4个月,HR=5.08,P=0.0023)和OS(26.2 vs 10.7个月,HR=10.15,P<0.0001)显著更长(图5);队列B患者治疗后CD4+CD8+≥500 cells/μL的患者,PFS(6.5 vs 3.5个月,HR=2.7,P=0.012)和OS(27.8 vs 11.2个月,HR=3.03,P=0.026)显著更长(图6)。
产品关联:文献未提及具体统计分析软件,领域常规使用SAS 9.4(本研究采用)、GraphPad Prism进行统计分析。
3.4 体外共培养模型构建与药物相互作用研究
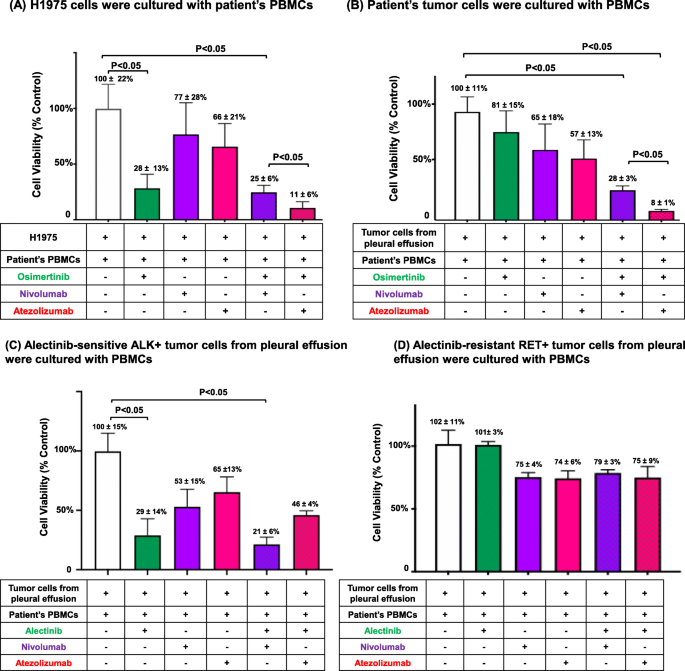
实验目的是探索TKIs与ICIs在驱动基因阳性NSCLC中的相互作用。方法细节:收集驱动基因阳性NSCLC患者的恶性胸腔积液,分离肿瘤细胞;同时采集患者外周血分离PBMCs。将肿瘤细胞与PBMCs以2:1比例共培养,分别加入TKIs(奥希替尼、阿来替尼)、ICIs(纳武利尤单抗、阿替利珠单抗)或两者联合,72小时后用MTS法检测细胞 viability(以未处理细胞为对照)。
结果解读:奥希替尼联合阿替利珠单抗对EGFR突变敏感(H1975细胞)和耐药的肿瘤细胞均有协同抑制作用(生长抑制率11% vs 28%,P<0.05);阿来替尼联合阿替利珠单抗对ALK融合敏感的肿瘤细胞则有拮抗作用(生长抑制率46% vs 29%,P<0.05);阿来替尼联合ICIs对RET融合耐药的肿瘤细胞无显著抑制作用(图8)。这些结果提示,TKIs与ICIs的相互作用具有患者特异性,需根据驱动基因类型和药物敏感性个性化选择联合方案。
产品关联:实验所用关键产品:MTS试剂(Molecular Devices)、SpectraMax M3微孔板读板仪(Molecular Devices)、Ficoll-Paque密度梯度离心液。
4. Biomarker研究及发现成果解析
本研究聚焦于外周血免疫细胞计数作为驱动基因阳性NSCLC患者接受TKIs治疗的疗效biomarkers,通过“基线比较-治疗后动态监测-ROC曲线确定截断值-生存分析验证”的逻辑链进行筛选与验证。
Biomarker定位与筛选逻辑
本研究涉及的Biomarker主要为循环免疫细胞类指标,包括绝对淋巴细胞计数(ALCs)、CD3+ T细胞比例(CD3%)、CD4+CD8+ T细胞计数。筛选与验证逻辑:1)通过队列比较分析基线及治疗后免疫细胞的变化;2)通过ROC曲线及Youden指数确定ALCs(800 cells/μL)和CD4+CD8+(500 cells/μL)的最优截断值;3)通过Cox比例风险模型验证这些biomarkers与PFS、OS的关联。
研究过程与数据解析
Biomarker来源为患者外周血样本(治疗前后采集)。验证方法包括:1)血常规检测ALCs;2)流式细胞术检测CD3%、CD4+、CD8+细胞计数;3)ROC曲线分析确定截断值;4)生存分析验证预后价值。
特异性与敏感性数据:以ALCs≥800 cells/μL作为截断值,预测队列A患者PFS的风险比HR=5.08(95%置信区间CI=1.62-15.92,P=0.0023),OS的HR=10.15(95% CI=2.46-41.76,P<0.0001);以CD4+CD8+≥500 cells/μL作为截断值,预测队列A患者PFS的HR=8.89(95% CI=1.89-41.86,P=0.006)。
核心成果与创新点
本研究首次发现:驱动基因阳性NSCLC患者接受TKIs治疗后,ALCs和CD4+CD8+细胞计数的动态变化可作为预后biomarkers——治疗后ALCs≥800 cells/μL或CD4+CD8+≥500 cells/μL的患者,PFS和OS显著更长(P<0.05)。此外,CD3%作为基线biomarker,驱动基因阳性患者基线CD3%显著低于其他队列,提示其可能作为驱动基因阳性NSCLC的免疫特征。
本研究的创新性在于:1)首次系统报道TKIs对驱动基因阳性NSCLC患者外周血免疫细胞的调制作用;2)将ALCs、CD4+CD8+细胞计数确立为这类患者接受TKIs治疗的预后biomarkers;3)通过体外模型发现TKIs与ICIs的相互作用具有患者特异性,为个性化免疫联合治疗提供了依据。
本研究为驱动基因阳性NSCLC患者的治疗策略优化提供了重要参考:临床可通过监测TKIs治疗后ALCs和CD4+CD8+细胞计数的变化,预测患者预后;同时,需根据患者驱动基因类型和药物敏感性,选择TKIs与ICIs的联合方案。未来研究需进一步扩大样本量,验证这些biomarkers的普适性,并探索TKIs调制免疫细胞的分子机制。
