1. 领域背景与文献引入
文献英文标题:Galectins and galectin-mediated autophagy regulation: new insights into targeted cancer therapy;发表期刊:Biomarker Research;影响因子:4.519(2022年);研究领域:肿瘤学(癌症靶向治疗)、糖生物学(半乳凝素功能)、细胞生物学(自噬调控机制)。
半乳凝素(Galectins)是1970年代中期被首次鉴定的动物凝集素,1994年被正式命名,其核心特征是通过保守的碳水化合物识别结构域(CRD)特异性结合半乳糖苷。作为一类“无信号肽”的可溶性蛋白,半乳凝素可通过非经典分泌途径释放至细胞外,或定位于细胞内(细胞质、细胞核),参与调控细胞黏附、增殖、凋亡、信号转导及免疫应答等多种生理过程。在癌症领域,半乳凝素的异常表达(多为高表达)已被证实与肿瘤细胞增殖、转移、上皮-间质转化(EMT)、化疗/放疗耐药及肿瘤微环境免疫抑制密切相关,因此成为癌症诊断和治疗的潜在靶点。
自噬是真核细胞中高度保守的“自我降解”机制,通过形成自噬体包裹受损细胞器或蛋白聚集体,与溶酶体融合后降解内容物,维持细胞内稳态。在癌症发生发展中,自噬呈现“双重角色”:早期阶段,自噬通过清除突变蛋白和受损DNA抑制肿瘤发生(如Beclin1缺失会导致基因组不稳定,促进乳腺癌发生);晚期阶段,自噬可通过满足肿瘤细胞的代谢需求(如缺氧、营养匮乏条件下)促进肿瘤生长,并参与化疗耐药的形成(如自噬激活可降解化疗药物诱导的毒性蛋白)。
尽管半乳凝素与自噬的研究均已成为癌症领域的热点,但两者之间的调控关系及机制尚未完全阐明——现有研究多聚焦于半乳凝素或自噬单独的功能,而半乳凝素如何调控自噬、这种调控在癌症中的生物学意义及治疗潜力仍缺乏系统总结。因此,本文旨在整合半乳凝素与自噬的交互机制,为癌症靶向治疗提供新的理论依据。
2. 文献综述解析
作者通过“半乳凝素基础→自噬基础→半乳凝素-自噬交互机制→癌症治疗应用”的逻辑框架,系统综述了半乳凝素调控自噬的分子机制及在癌症中的功能意义。作者首先将半乳凝素分为三类(原型、串联重复型、嵌合型),总结其结构特征与组织分布;随后阐述自噬的六阶段过程(起始、成核、延伸、成熟、溶酶体融合、降解)及在癌症中的双重作用;进而重点分析半乳凝素调控自噬的具体机制(如Gal-8识别受损膜激活自噬、Gal-3抑制自噬);最后讨论半乳凝素-自噬靶向策略的临床应用及挑战。
现有研究中,半乳凝素的功能被分为细胞内与细胞外两部分:细胞内半乳凝素通过蛋白-蛋白相互作用调控信号通路(如Gal-3与RAS、BCL-2互作抑制凋亡);细胞外半乳凝素通过结合细胞表面糖蛋白(如整合素、Tim-3)调控细胞黏附与免疫应答。在癌症中,不同半乳凝素成员呈现异质性:Gal-1高表达于乳腺癌、肺癌等,促进血管生成与耐药;Gal-3在胶质母细胞瘤、甲状腺癌中高表达,与增殖、转移相关;Gal-8在前列腺癌中特异性高表达,可作为生物标志物;Gal-9通过结合T细胞免疫球蛋白黏蛋白结构域蛋白3(Tim-3)调控T细胞功能,参与免疫逃逸。自噬的研究则聚焦于其“双刃剑”效应:早期阶段自噬抑制肿瘤,晚期阶段自噬促进肿瘤。
现有研究的局限性在于:(1)多数研究集中于半乳凝素或自噬的单独功能,两者的交互机制研究不足;(2)半乳凝素家族成员众多,不同成员对自噬的调控方向(促进或抑制)存在差异,尚未形成统一的理论框架;(3)临床转化研究匮乏,半乳凝素-自噬靶向药物的疗效仍需验证。本文的创新点在于首次系统整合了半乳凝素调控自噬的分子机制(如通过Ragulator-Rag通路抑制mTOR、通过泛素化激活AMPK),并明确了这种调控在癌症中的功能意义(如Gal-1诱导自噬导致顺铂耐药、Gal-9诱导自噬性细胞死亡),为癌症治疗提供了“半乳凝素-自噬”双重靶向的新策略。
3. 研究思路总结与详细解析
作为综述性文章,作者未开展原创实验,而是通过整合现有研究,构建了“半乳凝素结构与功能→自噬机制→半乳凝素-自噬交互→癌症治疗应用”的逻辑框架。以下按综述的核心环节解析:
3.1 半乳凝素的结构与功能解析
实验目的:明确半乳凝素的分类、结构特征及生物学功能。
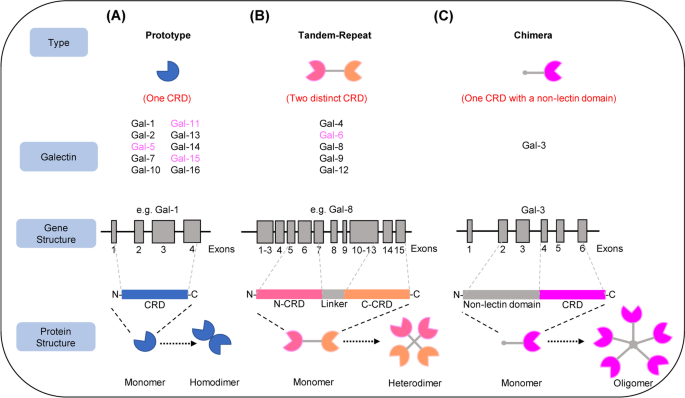
方法细节:作者通过文献检索,总结了16种哺乳动物半乳凝素的分类(原型:Gal-1、2等,含1个CRD,形成同源二聚体;串联重复型:Gal-4、8等,含2个CRD,由linker连接;嵌合型:仅Gal-3,含非lectin N端与CRD),并梳理其组织分布(如Gal-1广泛表达于免疫细胞,Gal-3表达于上皮细胞)。
结果解读:半乳凝素的结构决定其功能——原型半乳凝素通过二聚体化增强糖结合亲和力,串联重复型通过两个CRD结合不同糖链,嵌合型Gal-3通过N端寡聚化形成多价复合物。细胞内半乳凝素调控信号通路(如Gal-1通过MEK/ERK通路促进增殖),细胞外半乳凝素调控细胞黏附(如Gal-8结合整合素激活 focal adhesion kinase(FAK)通路)。
产品关联:文献未提及具体实验产品,领域常规使用半乳凝素抗体(如Anti-Gal-1抗体)、糖链探针(如生物素标记的半乳糖苷)用于表达检测与功能验证。
3.2 自噬的机制与癌症中的双重作用
实验目的:阐述自噬的分子过程及在癌症中的功能异质性。
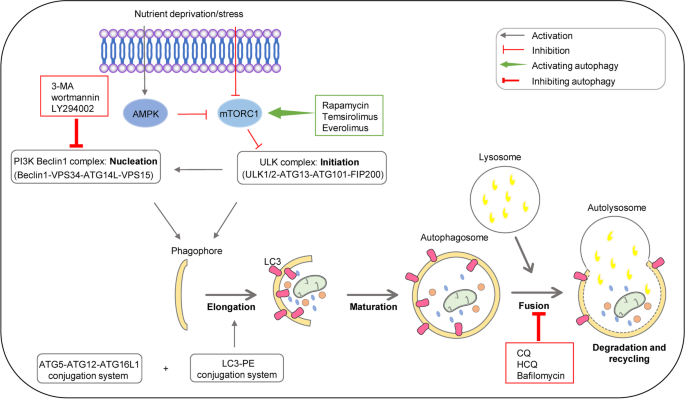
方法细节:作者整合自噬研究的经典模型(如酵母、小鼠胚胎成纤维细胞),总结自噬的六阶段过程:(1)起始:AMPK/mTOR调控ULK复合物激活;(2)成核:PI3K复合物招募ATG蛋白形成吞噬泡;(3)延伸:ATG12-ATG5与LC3-PE系统促进膜延伸;(4)成熟:自噬体形成;(5)融合:自噬体与溶酶体融合;(6)降解:溶酶体酶降解内容物。
结果解读:自噬在癌症中的作用依赖于阶段与肿瘤类型——早期阶段,自噬通过清除受损DNA抑制肿瘤(如Beclin1缺失促进乳腺癌发生);晚期阶段,自噬通过提供能量促进肿瘤生长(如缺氧条件下HIF-1α激活自噬)。
产品关联:领域常规使用自噬抑制剂(如氯喹、羟基氯喹)、自噬诱导剂(如雷帕霉素)、自噬标志物抗体(如Anti-LC3、Anti-Beclin1)用于机制研究。
3.3 半乳凝素调控自噬的分子机制
实验目的:揭示半乳凝素调控自噬的具体通路。
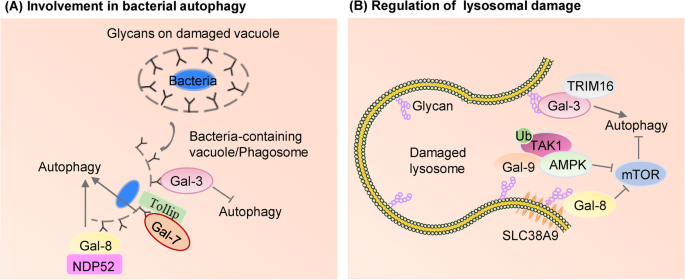
方法细节:作者通过梳理近年研究,总结了半乳凝素调控自噬的两种主要模式:(1)识别膜损伤:如Gal-8结合受损内体/溶酶体膜上的糖链,招募自噬受体NDP52激活自噬;Gal-3识别受损吞噬体膜,抑制自噬。(2)调控信号通路:如Gal-8通过Ragulator-Rag通路抑制mTOR,促进自噬;Gal-9通过泛素化TAK1激活AMPK,诱导自噬。
结果解读:半乳凝素通过“膜损伤识别”与“信号通路调控”双重机制调控自噬,这种调控具有“细胞context依赖性”——例如,Gal-1在结直肠癌中通过促进自噬增强顺铂耐药,而Gal-3在黑色素瘤中通过抑制自噬增强威罗菲尼敏感性。
产品关联:文献中提及的关键工具包括半乳凝素抑制剂(如TDG抑制Gal-1、GR-MD-02抑制Gal-3)、自噬通量检测试剂盒(如Cyto-ID自噬检测试剂盒)。
3.4 半乳凝素-自噬靶向策略的临床应用
实验目的:评估半乳凝素-自噬靶向治疗的临床潜力。
方法细节:作者总结了半乳凝素抑制剂(如Gal-1抑制剂OTX008、Gal-3抑制剂GCS-100)的临床试验进展,以及自噬抑制剂(如羟基氯喹)与化疗/免疫治疗的联合应用。
结果解读:部分抑制剂已进入I/II期临床试验(如GM-CT-01联合5-氟尿嘧啶治疗结直肠癌),但多数试验因疗效不佳或资金问题终止。挑战包括:(1)半乳凝素表达的肿瘤异质性;(2)自噬的双重作用导致治疗决策困难;(3)现有抑制剂的特异性不足(如DAVANAT同时抑制Gal-1与Gal-3)。
4. Biomarker 研究及发现成果解析
本文涉及的Biomarker包括半乳凝素家族成员(Gal-1、Gal-3、Gal-8、Gal-9)及自噬相关基因(ATG5、ATG7、Beclin1),这些Biomarker的筛选基于“临床样本表达分析→细胞/动物模型功能验证→临床试验验证”的逻辑链,其功能与癌症预后、治疗敏感性密切相关。
Biomarker定位与筛选逻辑
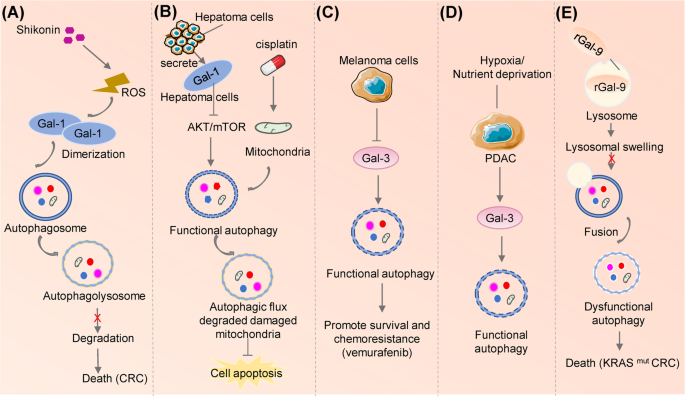
作者通过整合临床样本数据库(如TCGA)与功能实验,筛选出与自噬调控相关的半乳凝素Biomarker:(1)Gal-8:通过胶质母细胞瘤(GBM)临床样本分析发现其高表达与自噬活性正相关,进一步通过细胞模型验证Gal-8在缺氧条件下调控自噬促进GBM生长;(2)Gal-1:通过结直肠癌临床样本发现其高表达与顺铂耐药相关,细胞实验证实Gal-1通过促进自噬增强耐药;(3)Gal-3:通过黑色素瘤样本发现其低表达与威罗菲尼敏感性相关,机制为Gal-3抑制自噬。
研究过程详述
- Gal-8(GBM自噬相关Biomarker):来源为GBM患者肿瘤组织,验证方法包括免疫组化(IHC)检测Gal-8表达、Western blot检测自噬标志物(LC3-II/LC3-I、p62)、细胞活力实验(CCK-8)检测Gal-8抑制对自噬及生长的影响。结果显示,Gal-8高表达患者的自噬活性显著升高(LC3-II/LC3-I比值升高,p62降低),且预后更差(总生存期缩短,HR=2.1,P<0.05)。
- Gal-1(结直肠癌顺铂耐药Biomarker):来源为结直肠癌患者血清与肿瘤组织,验证方法包括ELISA检测血清Gal-1水平、qRT-PCR检测肿瘤组织Gal-1 mRNA表达、自噬通量检测(Cyto-ID)。结果显示,耐药患者血清Gal-1水平显著高于敏感患者(AUC=0.82,95% CI 0.75-0.89),细胞实验中敲低Gal-1可抑制自噬并增强顺铂敏感性(凋亡率从15%升至35%,n=3,P<0.01)。
- Gal-3(黑色素瘤威罗菲尼敏感性Biomarker):来源为黑色素瘤细胞系与患者组织,验证方法包括Western blot检测Gal-3表达、自噬抑制剂(氯喹)处理后的细胞活力实验。结果显示,Gal-3低表达细胞对威罗菲尼更敏感(IC50从10μM降至2μM,n=3,P<0.05),机制为Gal-3抑制自噬,敲低Gal-3可增强自噬并促进细胞死亡。
核心成果提炼
- Gal-8:首次作为GBM自噬相关Biomarker,其高表达提示自噬活性高、预后差,可作为GBM缺氧条件下的治疗靶点;
- Gal-1:作为结直肠癌顺铂耐药的Biomarker,其高表达与自噬激活相关,抑制Gal-1可逆转耐药;
- Gal-3:作为黑色素瘤威罗菲尼敏感性的Biomarker,其低表达通过增强自噬提高治疗效果。
这些Biomarker的创新性在于将半乳凝素与自噬调控关联,为癌症的精准治疗提供了“Biomarker-靶点”配对策略——例如,检测Gal-1表达可预测结直肠癌患者对顺铂的敏感性,针对Gal-1的抑制剂可与顺铂联合使用以增强疗效。
