1. 领域背景与文献引入
文献英文标题:Copper homeostasis and copper-induced cell death in tumor immunity: implications for therapeutic strategies in cancer immunotherapy;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗中的铜稳态与铜诱导细胞死亡(cuproptosis)
铜是维持人体关键生物学功能的必需微量元素,参与细胞呼吸、神经传导和抗氧化防御等过程。铜稳态的维持对健康至关重要,其失衡与多种疾病相关,尤其是癌症——肿瘤中常观察到铜代谢紊乱(如细胞内铜积累)。2022年,cuproptosis(铜诱导细胞死亡)的发现为肿瘤治疗提供了新机遇:它是一种铜介导的调节性细胞死亡方式,通过线粒体蛋白毒性应激诱导细胞死亡,区别于凋亡、铁死亡等传统路径。
现有研究多聚焦于铜代谢与肿瘤发生的关联,但铜代谢在肿瘤微环境(TME)中的具体功能,尤其是在肿瘤治疗和免疫治疗中的作用尚未完全阐明。例如,铜代谢如何影响TME中的免疫细胞功能?cuproptosis相关基因(CRGs)能否作为肿瘤预后标志物或免疫治疗靶点?这些问题仍需解答。
本综述旨在整合近年研究成果,探索癌症中铜代谢与沉积的分子机制,评估CRGs对癌症患者的预后意义,以及它们通过影响TME调节免疫反应的作用,最终为癌症免疫治疗提供新的思路。
2. 文献综述解析
文献综述部分,作者围绕“铜代谢机制→cuproptosis分子基础→CRGs的肿瘤学意义→铜与cuproptosis在TME中的作用→铜相关策略在免疫治疗中的应用”的逻辑展开评述,系统整合了铜稳态与cuproptosis在肿瘤免疫中的研究进展。
现有研究的关键结论
- 铜代谢失衡是肿瘤发生的驱动因素:铜转运蛋白(如SLC31A1/CTR1、ZnT1)异常导致细胞内铜积累,或排泄蛋白(如ATP7B)缺陷导致铜排出减少,均会促进肿瘤增殖、侵袭。
- cuproptosis是铜介导的独特细胞死亡方式:细胞内铜过量通过还原Cu²+为Cu⁺、破坏Fe-S簇合成、诱导脂酰化DLAT聚集,最终引发线粒体蛋白毒性应激。
- CRGs是潜在的预后标志物与治疗靶点:FDX1、DLAT、LIPT1等CRGs在不同肿瘤中差异表达,与患者预后(如总生存期、无病生存期)及免疫浸润密切相关。
- 铜与cuproptosis可重塑TME:铜可调节T细胞增殖、巨噬细胞极化,cuproptosis诱导的免疫原性细胞死亡(ICD)能激活树突状细胞(DCs),增强抗肿瘤免疫。
- 铜相关策略具有免疫治疗潜力:铜离子载体(如elesclomol、disulfiram)可靶向诱导肿瘤细胞cuproptosis,铜螯合剂(如JYFY-001)可联合PD-1抑制剂增强疗效,但联合方案的安全性与协同机制仍需探索。
现有研究的局限与本综述的创新
现有研究的优势在于明确了铜代谢与cuproptosis的分子框架,以及CRGs的临床价值;局限性则体现在:铜代谢在TME中的调控网络尚未完全解析,cuproptosis与其他细胞死亡方式的交互作用研究不足,且铜相关策略的临床转化数据有限。
本综述的创新价值在于首次将铜稳态、cuproptosis与肿瘤免疫三者结合,强调了CRGs作为“预后-靶点”双功能生物标志物的潜力,为免疫治疗中“铜代谢调控”策略的开发提供了理论基础。
3. 研究思路总结与详细解析
本综述作为整合性研究,核心目标是系统梳理铜稳态与cuproptosis在肿瘤免疫中的作用及机制,为癌症免疫治疗提供新方向。研究思路围绕“铜代谢→cuproptosis→CRGs→TME→免疫治疗”的逻辑展开,覆盖了铜从代谢失衡到临床应用的全链条。
3.1 铜代谢机制解析
实验目的:总结铜在体内的吸收、利用与排泄过程,阐明铜代谢失衡的分子基础。
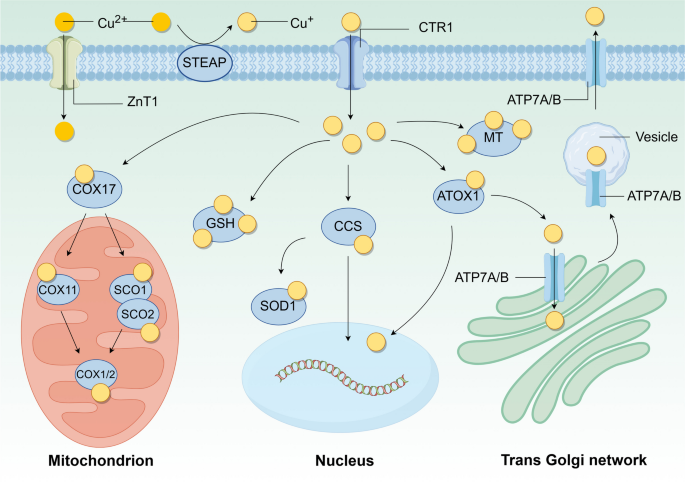
方法细节:回顾已有研究中铜代谢的关键蛋白(如转运蛋白SLC31A1/CTR1、ZnT1;分子伴侣CCS、ATOX1;排泄蛋白ATP7A/B)及调控机制(如ZNF711、SP1对SLC31A1的转录调控)。
结果解读:铜的吸收需先通过STEAP家族蛋白将Cu²+还原为Cu⁺,再由SLC31A1/CTR1转运进入细胞;细胞内铜通过分子伴侣转运至线粒体、高尔基体等细胞器,参与SOD1成熟、细胞呼吸等过程;过量铜通过ATP7A/B排泄至细胞外或胆汁中。铜代谢失衡(如SLC31A1过表达、ATP7B缺陷)会导致细胞内铜积累,促进肿瘤发生——例如,SLC31A1在宫颈癌细胞中高表达,与免疫浸润增加及不良预后相关。
产品关联:文献提到铜离子载体elesclomol、disulfiram可促进铜进入细胞,铜螯合剂JYFY-001可减少细胞内铜积累;领域常规使用Western blotting(WB)、实时荧光定量PCR(qRT-PCR)检测铜代谢蛋白的表达。
3.2 cuproptosis分子机制解析
实验目的:阐明cuproptosis的触发与执行过程,揭示其与肿瘤细胞死亡的关联。
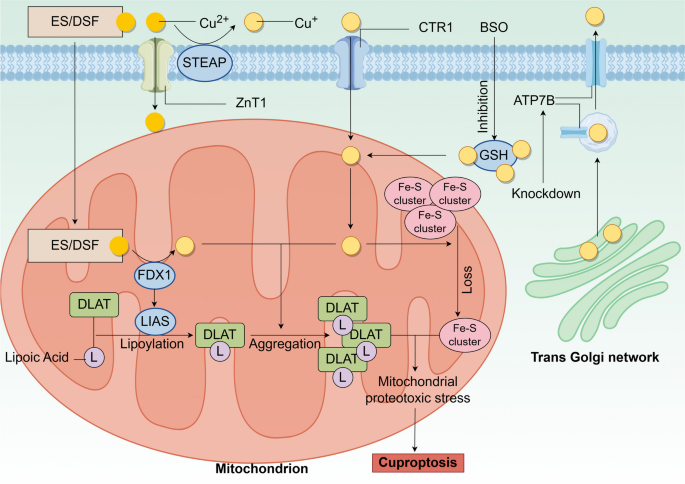
方法细节:回顾2022年Tsvetkov等的原创研究及后续验证,包括铜积累的途径(转运蛋白异常、铜离子载体、GSH合成抑制)、线粒体反应(FDX1还原Cu²+为Cu⁺、Fe-S簇减少、DLAT脂酰化)。
结果解读:cuproptosis的前提是细胞内铜过量,可通过三种方式实现:(1)转运蛋白异常(如SLC31A1过表达、ATP7B减少);(2)铜离子载体(如elesclomol)直接转运Cu²+进入细胞;(3)BSO抑制GSH合成,释放结合态铜。铜过量后,FDX1将Cu²+还原为更具毒性的Cu⁺,同时促进LIAS介导的DLAT脂酰化;Cu⁺与脂酰化DLAT结合导致蛋白聚集,结合Fe-S簇减少、ROS产生,最终引发线粒体蛋白毒性应激,导致细胞死亡。此外,p53可通过调节铜稳态(如抑制SLC31A1表达)或Fe-S簇合成,影响cuproptosis的敏感性。
产品关联:文献提到的cuproptosis诱导剂包括elesclomol(铜离子载体)、disulfiram(与铜结合后促进Cu⁺积累)、BSO(GSH合成抑制剂);领域常规使用CCK-8、Annexin V/PI染色检测细胞死亡。
3.3 CRGs的肿瘤学意义解析
实验目的:评估CRGs在不同肿瘤中的表达谱及预后价值,探索其作为治疗靶点的潜力。
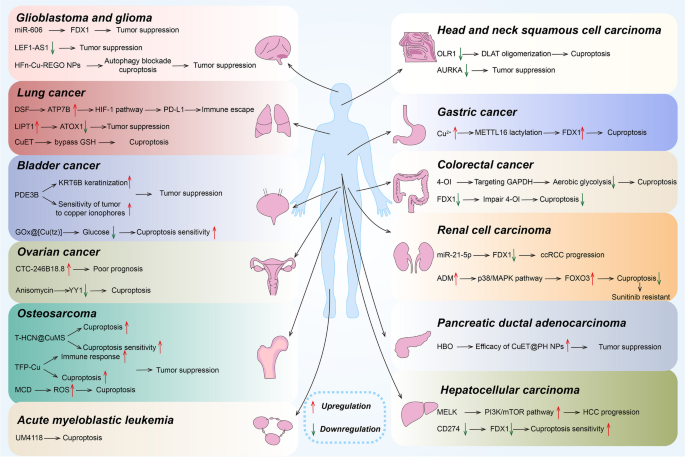
方法细节:通过泛癌分析(TCGA数据库)筛选差异表达的CRGs,结合细胞系实验(基因敲除/过表达)验证功能,再通过临床样本(免疫组化(IHC)、生存分析)确认预后关联。
结果解读:CRGs在泛癌中呈现异质性表达——例如,FDX1在结肠癌(COAD)、肺癌(LUAD)等14种肿瘤中高表达,在急性髓系白血病(AML)、肾透明细胞癌(ccRCC)等12种肿瘤中低表达;低表达的FDX1与ccRCC的进展、不良预后及免疫细胞浸润失调相关。DLAT在肝细胞癌(LIHC)、肺腺癌(LUAD)中高表达,与患者化疗耐药及不良预后相关;LIPT1在非小细胞肺癌(NSCLC)中低表达,过表达LIPT1可通过下调ATOX1抑制肿瘤增殖,与良好预后相关。
产品关联:文献未提及具体实验产品,领域常规使用qRT-PCR检测CRGs mRNA表达,IHC检测蛋白水平,流式细胞术分析免疫浸润。
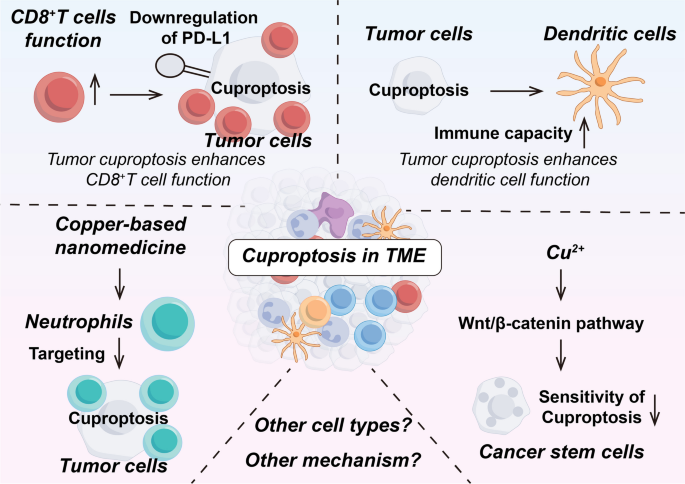
3.4 铜与cuproptosis在TME中的作用解析
实验目的:探索铜与cuproptosis对TME中免疫细胞的调控作用,揭示其免疫调节机制。
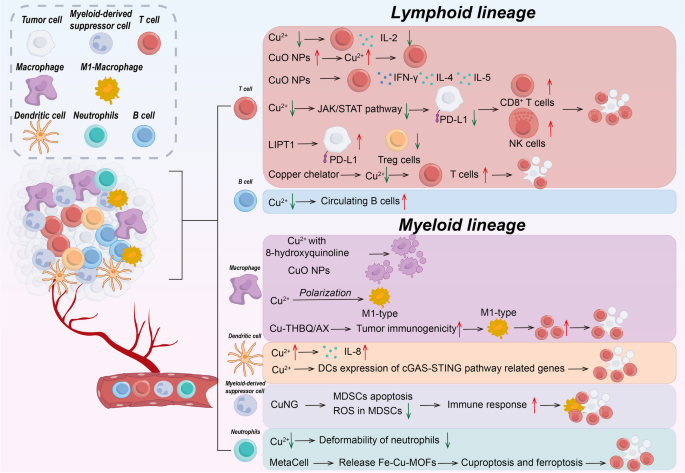
方法细节:回顾铜对T细胞、巨噬细胞、中性粒细胞、DCs的影响,以及cuproptosis诱导ICD的研究,结合动物模型(如荷瘤小鼠)验证免疫反应。
结果解读:铜可调节T细胞功能——铜缺乏会减少IL-2产生,抑制T细胞增殖;铜螯合剂通过降低PD-L1表达,增加CD8⁺ T细胞浸润。铜对巨噬细胞的作用具有两面性:低浓度铜促进M1型极化(促炎),高浓度铜诱导巨噬细胞凋亡。cuproptosis诱导的ICD能释放损伤相关分子模式(DAMPs),激活DCs成熟,进而促进CD8⁺ T细胞活化——例如,ES-Cu-MOF纳米药物诱导肿瘤细胞cuproptosis后,DCs表面成熟标志物(如CD80、CD86)表达增加,CD8⁺ T细胞浸润增强。
产品关联:文献提到铜氧化纳米颗粒(CuO NPs)可促进T细胞细胞因子(如IFN-γ、IL-4)产生,铜基纳米药物(如Cu-THBQ/AX)可极化M2型巨噬细胞为M1型;领域常规使用流式细胞术分析免疫细胞表型,ELISA检测细胞因子水平。
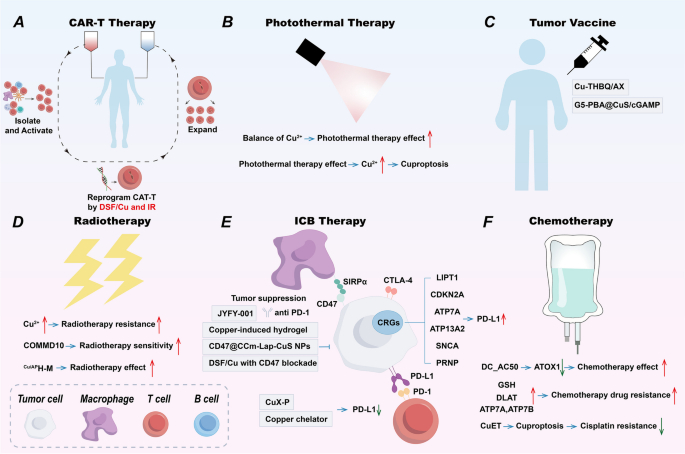
3.5 铜相关策略在免疫治疗中的应用解析
实验目的:总结铜离子载体、铜螯合剂、纳米疗法等策略在免疫治疗中的应用,评估其协同机制。
方法细节:回顾铜相关策略与免疫检查点抑制剂(ICB)、CAR-T细胞治疗、肿瘤疫苗的联合研究,结合临床前模型(如异种移植小鼠)验证疗效。
结果解读:(1)铜离子载体联合ICB:elesclomol与PD-L1抑制剂联合可通过诱导cuproptosis与下调PD-L1表达,增强抗肿瘤免疫;(2)铜螯合剂联合ICB:JYFY-001通过螯合铜离子,抑制JAK/STAT通路,减少PD-L1表达,与PD-1抑制剂协同抑制结肠癌生长;(3)纳米疗法增强免疫治疗:CuX-P纳米平台(MXene负载DSF/Cu²+,T细胞膜包裹)可靶向肿瘤,通过“PD-L1内吞→铜积累→cuproptosis”的反馈 loop,增强光热治疗与免疫反应;(4)肿瘤疫苗:铜基纳米疫苗(如G5-PBA@CuS/cGAMP)通过光热效应与cGAMP佐剂,激活DCs,诱导长期抗肿瘤免疫。
产品关联:文献提到的纳米药物包括CuX-P(MXene纳米片、T细胞膜)、ES-Cu-MOF(铜基金属有机框架)、G5-PBA@CuS/cGAMP(树状大分子、铜硫化物);领域常规使用动态光散射(DLS)检测纳米颗粒尺寸,透射电镜(TEM)观察形貌。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位与筛选逻辑
本综述中,Biomarker主要为CRGs(如FDX1、DLAT、LIPT1、ATP7A、SLC31A1),其筛选与验证遵循“泛癌分析→细胞功能验证→临床样本确认”的逻辑链:
1. 泛癌分析:通过TCGA等数据库筛选肿瘤与正常组织中差异表达的CRGs;
2. 细胞功能验证:通过基因敲除/过表达实验,验证CRGs对肿瘤细胞增殖、迁移、耐药的影响;
3. 临床样本确认:通过IHC染色、生存分析,确认CRGs与患者预后及免疫治疗反应的关联。
4.2 研究过程详述
CRGs的来源包括公共数据库(如TCGA、GEO)的肿瘤转录组数据,以及临床收集的肿瘤组织样本。验证方法涵盖:
- 表达验证:qRT-PCR检测mRNA水平,IHC检测蛋白表达;
- 功能验证:CRISPR-Cas9敲除或慢病毒过表达CRGs,评估对肿瘤细胞增殖(CCK-8)、迁移(Transwell)的影响;
- 预后验证:Kaplan-Meier生存分析评估CRGs表达与总生存期(OS)、无病生存期(DFS)的关联;
- 免疫关联验证:CIBERSORT算法分析CRGs表达与免疫细胞浸润(如CD8⁺ T细胞、Tregs)的相关性。
特异性与敏感性数据:
- FDX1在ccRCC中低表达,与不良预后相关(HR=1.5,95% CI:1.2-1.8,P<0.01);
- DLAT在PAAD中高表达,与化疗耐药相关(ROC曲线AUC=0.78,95% CI:0.71-0.85,敏感性75%,特异性72%);
- LIPT1在NSCLC中低表达,高表达LIPT1的患者OS显著延长(中位OS:36个月 vs 22个月,P<0.05)。
4.3 核心成果提炼
本综述的核心成果在于明确了CRGs的“双功能”价值:
1. 预后标志物:CRGs(如FDX1、DLAT)的表达水平可独立预测肿瘤患者的预后,为风险分层提供依据;
2. 免疫治疗靶点:部分CRGs(如ATP7A)与免疫检查点(如PD-L1)共表达,抑制ATP7A可降低PD-L1表达,增强ICB疗效;
3. 机制创新:首次发现CRGs通过调节TME中的免疫细胞(如Tregs浸润、DCs成熟)影响免疫反应,为“CRGs+免疫检查点”联合策略提供了理论支持。
例如,ATP7A在HCC中高表达,与PD-L1表达正相关(r=0.62,P<0.001),且ATP7A⁺PD-L1⁺患者的OS显著短于ATP7A⁻PD-L1⁻患者(中位OS:14个月 vs 32个月,P<0.001);抑制ATP7A可减少PD-L1表达,增加CD8⁺ T细胞浸润,增强抗PD-L1治疗的疗效。
总结
本综述系统整合了铜稳态与cuproptosis在肿瘤免疫中的研究进展,明确了CRGs作为“预后-靶点”双功能生物标志物的潜力,为癌症免疫治疗中“铜代谢调控”策略的开发提供了理论基础。未来研究需进一步解析铜代谢在TME中的调控网络,验证铜相关策略的临床安全性,推动“CRGs+免疫检查点”联合方案的转化应用。
