1. 领域背景与文献引入
文献英文标题:Functional heterogeneity of cancer-associated fibroblasts with distinct neoadjuvant immunotherapy plus chemotherapy response in esophageal squamous cell carcinoma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:食管鳞状细胞癌肿瘤微环境与新辅助免疫联合化疗响应。
食管鳞状细胞癌(ESCC)是全球第六大癌症死因,占食管癌的85%,5年生存率仅15-25%。近年来,新辅助免疫联合化疗(neoICT,如替雷利珠单抗联合卡铂+白蛋白紫杉醇)显著提高了ESCC患者的病理完全缓解(pCR)率,但仍有近半数患者响应率低或出现耐药。肿瘤微环境(TME)的异质性是治疗响应差异的核心因素,其中癌相关成纤维细胞(CAFs)作为TME的主要 stromal 细胞,参与细胞外基质(ECM)重塑、免疫抑制及药物耐药,但ESCC患者neoICT后CAFs的功能异质性及与治疗响应的关系尚不明确。因此,解析neoICT后TME中CAFs的动态变化及功能表型,对揭示治疗耐药机制、提高ESCC患者的治疗响应具有重要意义。本研究针对这一空白,通过单细胞RNA测序(scRNA-seq)和多重免疫荧光(mfIHC),系统解析了ESCC患者neoICT前后TME的细胞组成变化,重点阐明了CAFs的功能亚型与治疗响应的关联及机制。
2. 文献综述解析
作者对现有研究的分类维度主要围绕CAFs的异质性及功能:
1. CAFs的亚型分类:现有研究将CAFs分为肌成纤维细胞CAFs(myCAFs,表达ACTA2、FAP)、炎症性CAFs(iCAFs,表达IL6、CCL2)、抗原呈递CAFs(apCAFs)等,但ESCC中CAFs的亚型鉴定及功能研究不足;
2. CAFs的功能:myCAFs通过分泌胶原蛋白(如COL1A1)重塑ECM,形成物理屏障阻碍T细胞浸润;iCAFs通过分泌炎症因子(如IL6)招募 immunosuppressive细胞(如M2巨噬细胞),促进免疫抑制;
3. 现有研究的局限性:多基于细胞系或动物模型,缺乏ESCC患者neoICT前后CAFs的单细胞水平动态分析,且CAFs与T细胞相互作用介导治疗耐药的机制尚未阐明。
本研究的创新点在于:
- 首次在ESCC患者中,通过scRNA-seq解析了neoICT前后CAFs的功能异质性;
- 鉴定出与治疗耐药相关的CAFs亚型(CD248+机械响应CAFs、IL6+CCL2+免疫调节CAFs);
- 揭示了CAFs与T细胞通过TIGIT-NECTIN2相互作用介导免疫抑制的机制,为靶向CAFs提高neoICT响应提供了新靶点。
3. 研究思路总结与详细解析
3.1 整体框架
研究目标:解析ESCC患者neoICT后TME的动态变化,尤其是CAFs的功能表型与治疗响应的关系。
核心科学问题:CAFs亚型如何介导neoICT耐药?
技术路线:临床样本收集→scRNA-seq分析TME细胞组成→CAFs亚型鉴定→功能机制研究(轨迹分析、转录因子调控)→CAFs与T细胞相互作用分析→mfIHC临床验证→生存分析。
3.2 临床样本收集与单细胞RNA测序
实验目的:获取neoICT前后的ESCC样本,进行单细胞转录组分析。
方法细节:纳入18例ESCC患者,收集41份样本(17份治疗前内镜活检,24份治疗后手术切除),其中6例为配对样本;样本经sCelLive™组织保存液保存,酶解成单细胞悬液(用Singleron PythoN™组织解离系统),通过10x Genomics平台进行scRNA-seq;数据过滤标准:基因数200-前2%、UMI数前2%、线粒体含量<50%。
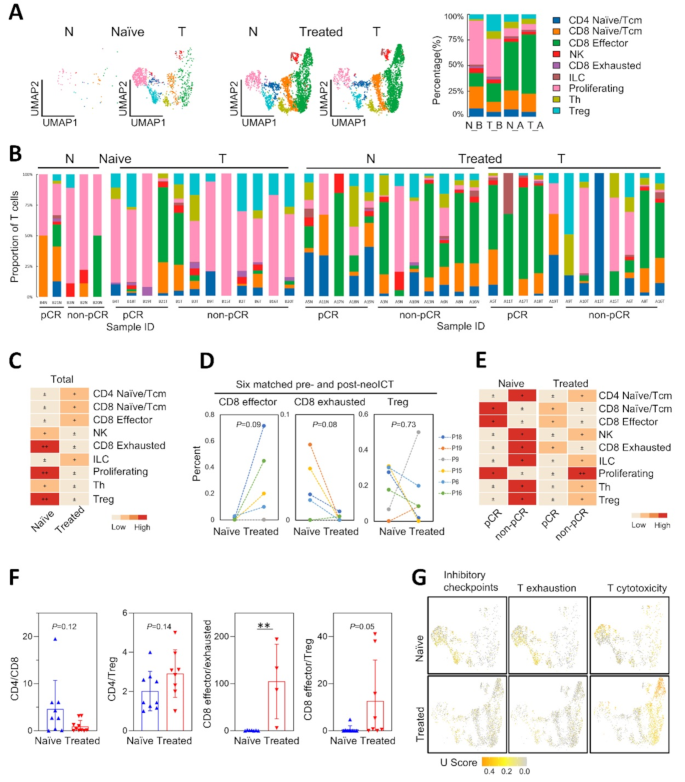
结果解读:共获得232710个高质量细胞,平均每个细胞检测到1343个基因、4782个UMI;细胞类型注释显示,TME包含上皮细胞、单核吞噬细胞、成纤维细胞、T细胞等11种细胞类型。
产品关联:实验所用关键产品:Singleron的sCelLive™组织保存液、sCelLive™组织解离液;10x Genomics单细胞测序平台;抗体:ADH1B(Proteintech,Cat#19899-1)、CD248(Abcam,Cat#ab204914)等。
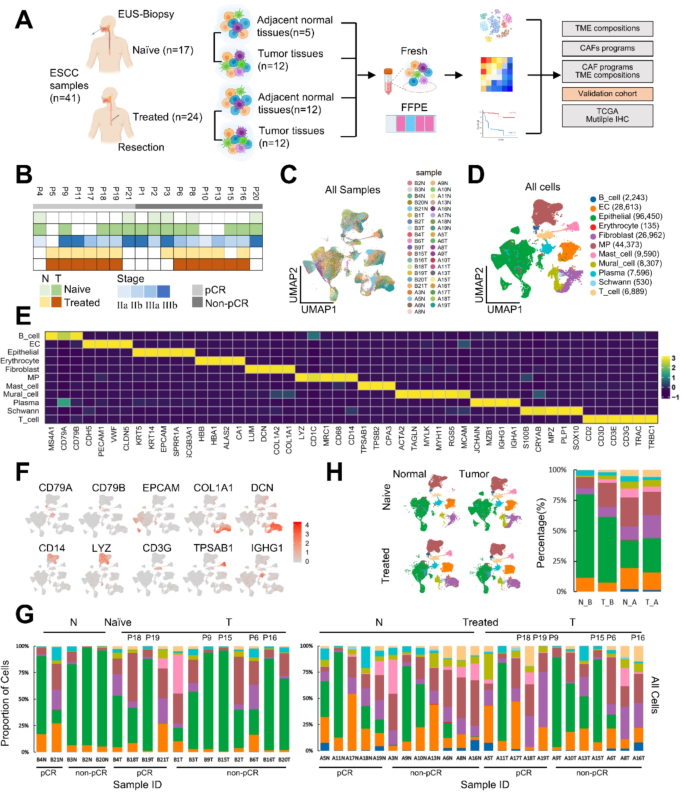
3.3 肿瘤微环境细胞类型鉴定与动态变化分析
实验目的:分析neoICT前后TME细胞组成的变化。
方法细节:用Cell-ID和SynEcoSys™(基于CellMakerDB、PanglaoDB)注释细胞类型;用STARTRAC-dist分析细胞类型的富集程度;用Mann-Whitney U检验和Wilcoxon配对检验比较治疗前后的差异。
结果解读:
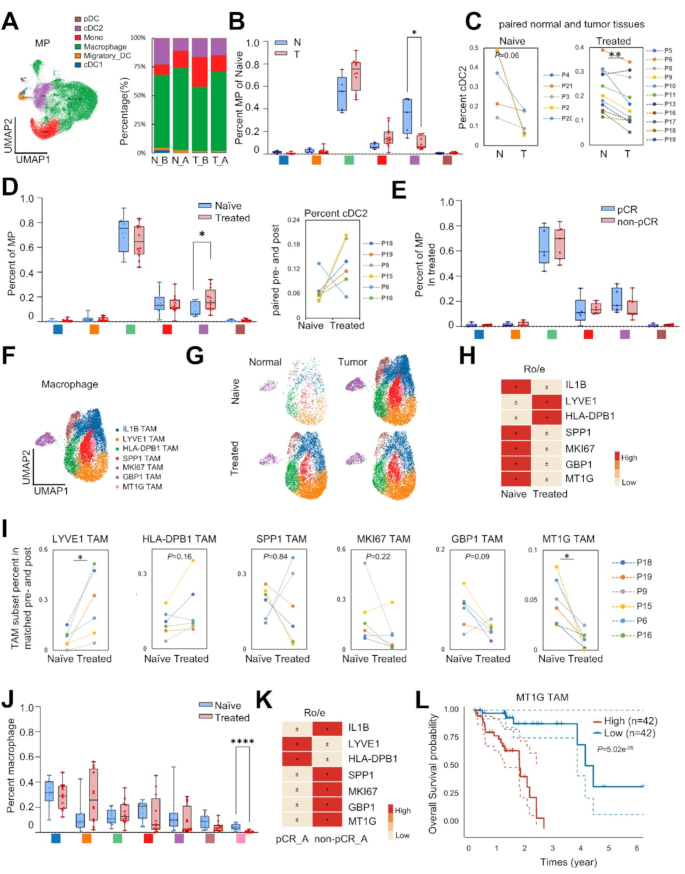
- neoICT后,上皮细胞比例降低(P<0.05),成纤维细胞、免疫细胞(如cDC2)比例升高(P<0.05);
- 单核吞噬细胞中,MT1G+M2巨噬细胞(促肿瘤)在non-pCR组富集(P<0.05),与不良预后相关(TCGA生存分析P=5.02e-05);
- 内皮细胞中,静脉EC比例升高(P<0.05),毛细血管EC和增殖EC比例降低(P<0.05)。
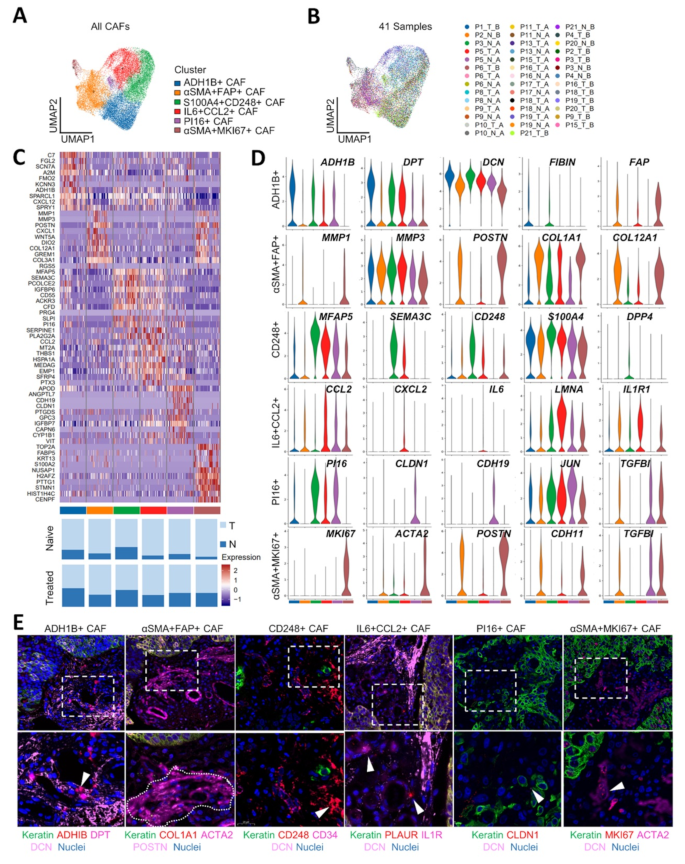
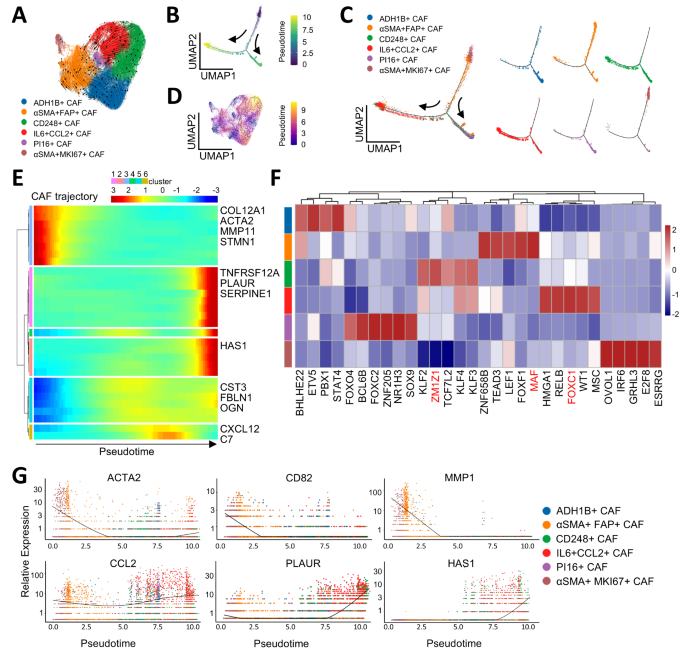
3.4 癌相关成纤维细胞亚型的鉴定与功能解析
实验目的:鉴定ESCC中CAFs的亚型及功能。
方法细节:对26962个成纤维细胞进行无监督聚类;基于差异基因表达(如ADH1B、CD248、IL6)和GO分析(ECM组织、炎症反应)定义亚型;用Monocle2/3进行轨迹分析,鉴定CAFs的分化路径;用转录因子(TF)分析解析调控网络。
结果解读:
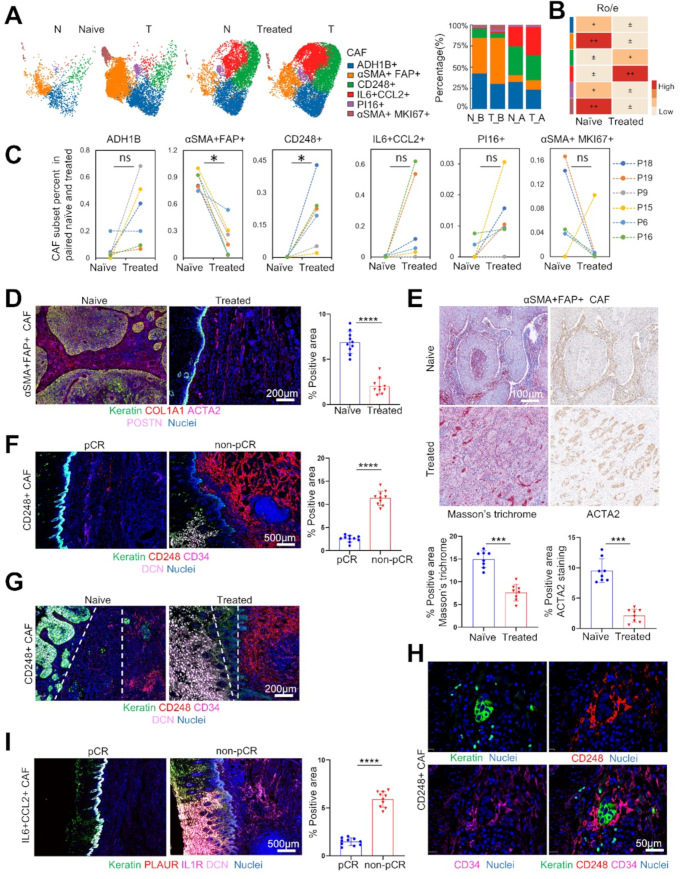
- CAFs亚型鉴定:6种亚型,包括2种稳态样CAFs(ssl-CAFs:ADH1B+、PI16+)、3种机械响应CAFs(mr-CAFs:αSMA+FAP+、αSMA+MKI67+、CD248+)、1种免疫调节CAFs(im-CAFs:IL6+CCL2+);
- 动态变化:neoICT后,αSMA+FAP+mr-CAFs比例降低(P<0.05),CD248+mr-CAFs和IL6+CCL2+im-CAFs比例升高(P<0.05);
- 功能机制:
- CD248+mr-CAFs:表达CD248、S100A4等机械响应基因,位于肿瘤巢周围,形成物理屏障阻碍CD8+T细胞浸润;
- IL6+CCL2+im-CAFs:表达IL6、CCL2等炎症基因,诱导免疫抑制;
- 轨迹分析:αSMA+FAP+mr-CAFs分化为CD248+mr-CAFs和IL6+CCL2+im-CAFs,转录因子MAF调控αSMA+FAP+mr-CAFs,ZMIZ1调控CD248+mr-CAFs,FOXC1调控IL6+CCL2+im-CAFs。
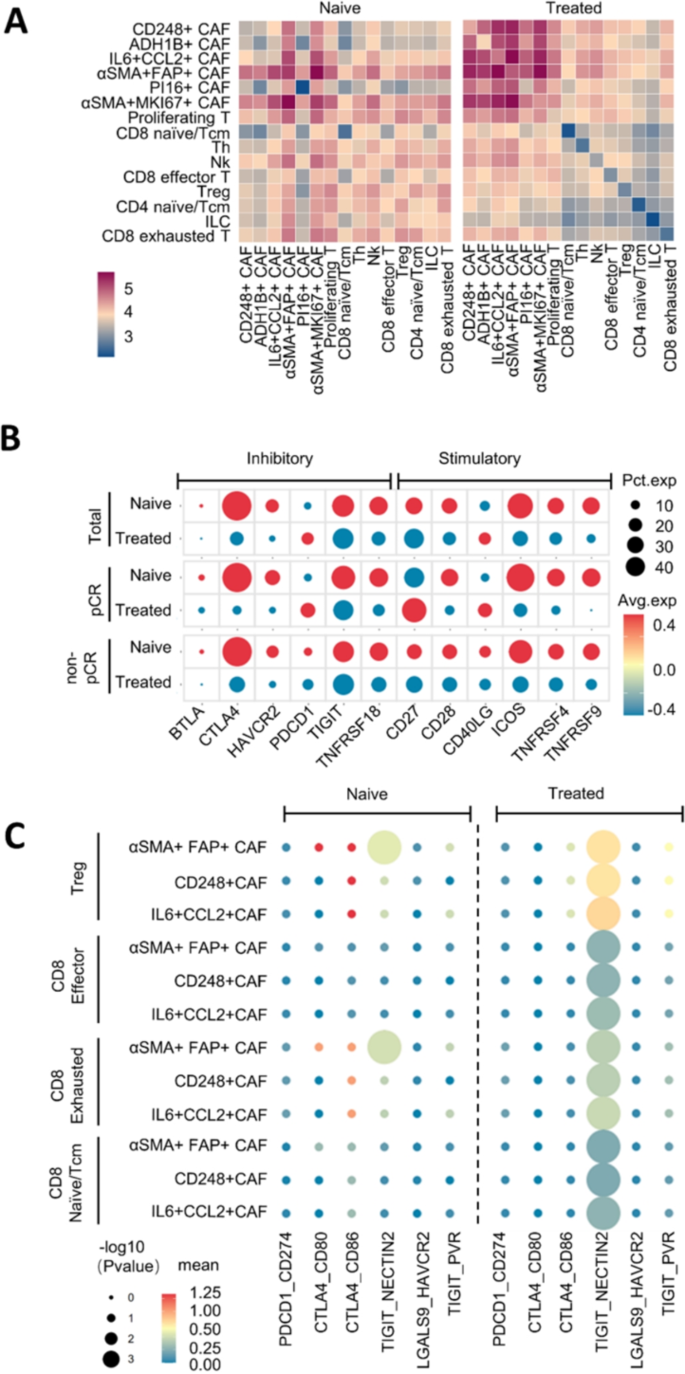
3.5 癌相关成纤维细胞与T细胞相互作用机制研究
实验目的:解析CAFs与T细胞的相互作用及对免疫抑制的影响。
方法细节:用CellPhoneDB分析CAFs与T细胞的配体-受体对;用mfIHC验证配体(NECTIN2)和受体(TIGIT)的表达;比较pCR与non-pCR组的相互作用差异。
结果解读:
- 相互作用变化:neoICT后,CTLA4-CD86/80相互作用降低,TIGIT-NECTIN2相互作用增强;
- 关键机制:CD248+mr-CAFs和IL6+CCL2+im-CAFs高表达NECTIN2,与T细胞表面TIGIT结合;non-pCR组中,Tregs与CAFs的TIGIT-NECTIN2相互作用显著高于pCR组(P<0.05),促进免疫抑制;
- 次要机制:PDCD1/CD274相互作用较弱,不是主要的免疫抑制通路。
3.6 临床样本验证与生存分析
实验目的:验证CAFs亚型与治疗响应的关系。
方法细节:对10例患者的FFPE样本进行mfIHC染色,检测CAFs标志物(αSMA、FAP、CD248、IL6)的表达;用ImageJ量化染色强度;用TCGA数据库分析CAFs基因 signature 与生存的关系。
结果解读:
- 临床验证:neoICT后,αSMA+FAP+mr-CAFs比例降低(P<0.0001),CD248+mr-CAFs和IL6+CCL2+im-CAFs比例升高(P<0.0001);non-pCR组CD248+mr-CAFs和IL6+CCL2+im-CAFs比例显著高于pCR组(P<0.0001);
- 生存分析:αSMA+FAP+mr-CAFs基因 signature 与多种癌症(如BLCA、KIRC)的不良预后相关(P<0.05)。
4. Biomarker研究及发现成果解析
4.1 Biomarker定位
本研究涉及的Biomarker包括:
- CAFs亚型:CD248+机械响应CAFs(mr-CAFs)、IL6+CCL2+免疫调节CAFs(im-CAFs);
- T细胞抑制性 checkpoint:TIGIT(表达于T细胞表面)。
筛选逻辑:scRNA-seq聚类→差异基因表达→临床样本mfIHC验证→生存分析关联;
验证逻辑:单细胞水平鉴定→组织水平量化→治疗响应关联→机制验证。
4.2 研究过程详述
- 来源:ESCC患者的肿瘤组织样本;
- 验证方法:scRNA-seq检测基因表达,mfIHC检测蛋白水平,CellPhoneDB分析相互作用;
- 特异性与敏感性:
- CD248+mr-CAFs:non-pCR组比例显著高于pCR组(n=10,P<0.0001);
- IL6+CCL2+im-CAFs:non-pCR组比例显著高于pCR组(n=10,P<0.0001);
- TIGIT:non-pCR组T细胞表达水平显著高于pCR组(P<0.05);
- 功能关联:
- CD248+mr-CAFs:形成物理屏障,阻碍CD8+T细胞浸润和药物递送;
- IL6+CCL2+im-CAFs:通过IL6诱导治疗耐药;
- TIGIT-NECTIN2:CAFs表达NECTIN2与T细胞TIGIT结合,促进免疫抑制;
- 创新性:首次在ESCC中鉴定出CD248+mr-CAFs作为机械响应亚型,揭示其与T细胞通过TIGIT-NECTIN2相互作用介导耐药。
4.3 核心成果提炼
- CD248+mr-CAFs:作为ESCC患者neoICT耐药的 Biomarker,其高表达与non-pCR相关(P<0.0001),可通过靶向CD248破坏物理屏障,提高T细胞浸润;
- IL6+CCL2+im-CAFs:作为免疫抑制 Biomarker,其高表达与non-pCR相关(P<0.0001),可通过IL6抑制剂降低炎症反应;
- TIGIT:作为T细胞抑制性 checkpoint,其与NECTIN2的相互作用是免疫抑制的关键,靶向TIGIT可恢复T细胞功能。
本研究为ESCC患者neoICT的个性化治疗提供了新的 Biomarker 和靶点,具有重要的临床转化价值。
