1. 领域背景与文献引入
文献英文标题:KMT2A/C mutations function as a potential predictive biomarker for immunotherapy in solid tumors;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗生物标志物。
肿瘤免疫治疗领域中,免疫检查点抑制剂(ICIs)的应用彻底改变了晚期实体瘤的治疗格局,但仅20%-40%的患者能从中长期获益,缺乏精准的预测生物标志物是限制ICIs合理应用的核心问题。目前已有的生物标志物如PD-L1表达(免疫组化检测)、肿瘤突变负荷(TMB)虽有一定价值,但存在局限性——PD-L1表达受检测抗体、肿瘤异质性影响,TMB在部分瘤种中的预测效能不稳定。此外,表观遗传调控(如DNA甲基化、组蛋白修饰)与肿瘤免疫微环境的关联逐渐受到关注,已有研究发现DNA去甲基化酶TET1突变、DNA甲基转移酶抑制剂(DNMTi)联合ICIs可增强疗效,但组蛋白甲基转移酶KMT2家族突变与ICIs疗效的关系尚未明确。
KMT2家族(包括KMT2A、KMT2B、KMT2C、KMT2D)作为组蛋白H3赖氨酸4(H3K4)甲基转移酶,通过调控染色质结构影响基因转录,其突变在多种肿瘤中高频出现(如黑色素瘤中KMT2A/C突变率达30%)。但该家族突变是否影响ICIs的临床获益,此前无研究报道。本研究针对这一空白,首次系统分析KMT2A/C突变与ICIs疗效的相关性,旨在为ICIs的精准应用提供新的生物标志物。
2. 文献综述解析
作者对现有研究的评述逻辑按“表观遗传调控→免疫治疗关联→KMT2家族研究空白”分层:首先,总结表观遗传因素在肿瘤免疫中的作用——如TET1突变可预测ICIs高响应率,DNMTi/HDACi(组蛋白去乙酰化酶抑制剂)能增强ICIs疗效;其次,指出KMT2家族作为重要的组蛋白甲基转移酶,其突变虽在肿瘤中常见,但未被研究与免疫治疗的关联;最后,强调本研究的创新点:首次在泛癌层面探讨KMT2A/C突变对ICIs临床结局的预测价值,且验证了其在TMB低亚组的额外预测效能,弥补了现有生物标志物的不足。
现有研究的局限性包括:PD-L1表达作为预测因子的“不精准性”(受检测方法影响)、TMB在低突变负荷瘤种中的局限性;本研究通过整合多队列数据(原发性+扩展性ICIs队列、非ICIs队列),明确KMT2A/C突变的预测价值,且揭示其可能通过增加肿瘤免疫原性(更高TMB)或其他机制增强ICIs敏感性,为后续机制研究提供了方向。
3. 研究思路总结与详细解析
本研究的核心目标是验证KMT2A/C突变是否可作为ICIs治疗的预测生物标志物,核心科学问题是“KMT2A/C突变与ICIs临床获益的关联及潜在机制”,技术路线为“队列构建→突变状态分析→临床结局关联→扩展队列验证→机制探索”。
3.1 原发性ICIs治疗队列构建与突变状态分析
实验目的:明确KMT2家族各基因(KMT2A、KMT2B、KMT2C、KMT2D)突变与ICIs疗效的关联,筛选出具有预测价值的基因组合。
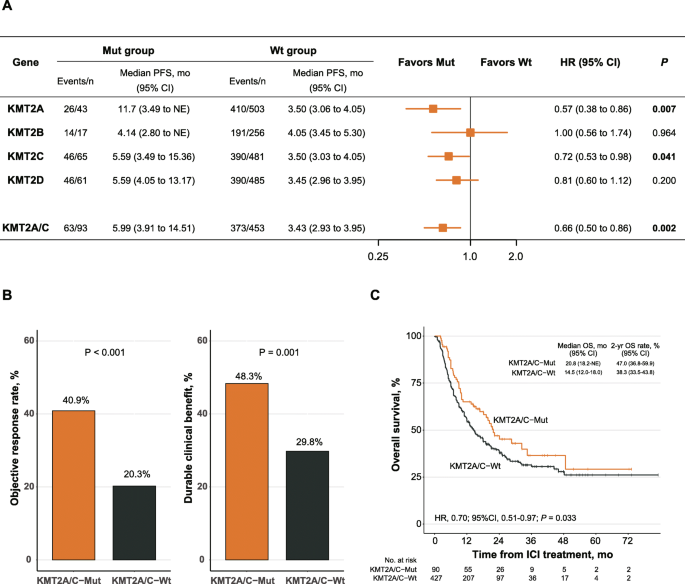
方法细节:收集7项已发表研究中的原发性ICIs治疗队列(n=546),通过肿瘤组织测序数据确定KMT2家族各基因的突变状态(体细胞突变),并将KMT2A与KMT2C突变合并为“KMT2A/C突变”组(因两者均与更好的无进展生存期相关)。
结果解读:KMT2A(P=0.007)、KMT2C(P=0.041)突变患者的无进展生存期(PFS)显著长于野生型,而KMT2B(P=0.964)、KMT2D(P=0.200)无显著差异;合并KMT2A/C突变后,突变组PFS的风险比(HR)为0.66(n=546,P=0.002),提示突变患者疾病进展风险降低34%。
产品关联:文献未提及具体实验产品,领域常规使用肿瘤组织全外显子测序试剂盒(如Illumina TruSight Oncology 500)、生存分析软件(如R语言survival包)。
3.2 临床结局关联分析
实验目的:验证KMT2A/C突变与客观缓解率(ORR)、持久临床获益(DCB)、总生存期(OS)的关联。
方法细节:计算KMT2A/C突变组与野生组的ORR(完全缓解+部分缓解比例)、DCB(缓解持续≥6个月或稳定≥6个月比例),并通过Kaplan-Meier法分析OS差异(因29例患者缺失OS数据,实际n=517)。
结果解读:突变组ORR(40.9% vs 20.3%,n=546,P<0.001)、DCB(48.3% vs 29.8%,n=546,P=0.001)显著高于野生组;OS的HR为0.70(95%置信区间[CI] 0.51-0.97,n=517,P=0.033),提示突变患者死亡风险降低30%。
3.3 扩展队列验证
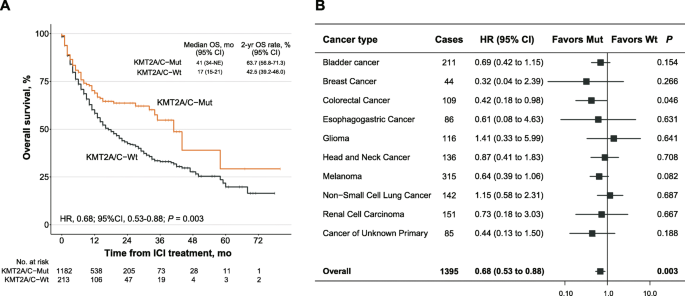
实验目的:在更大样本量中验证KMT2A/C突变的预测价值,并排除其作为“预后标志物”的干扰(即突变本身是否影响肿瘤自然生存期)。
方法细节:纳入Memorial Sloan Kettering Cancer Center的扩展ICIs治疗队列(n=1395),分析OS差异;同时纳入非ICIs治疗队列(n=2252),比较突变组与野生组的OS。
结果解读:扩展队列中,突变组中位OS为41个月(95%CI 34-未达到),野生组为17个月(HR=0.68,95%CI 0.53-0.88,n=1395,P=0.003);非ICIs队列中,两组OS无显著差异(HR=0.90,95%CI 0.71-1.14,n=2252,P=0.396),说明KMT2A/C突变的预测价值是ICIs特异性的,而非肿瘤本身的预后因素。
3.4 机制探索:TMB关联与亚组分析
实验目的:初步探索KMT2A/C突变增强ICIs敏感性的机制。
方法细节:分析原发性队列中KMT2A/C突变组与野生组的TMB差异,及突变在TMB低亚组(<10突变/Mb)的预测价值。
结果解读:突变组TMB显著高于野生组(文献未明确提供具体数值,基于图表趋势推测);在TMB低亚组中,突变组ORR仍高于野生组(32.6% vs 17.9%,n=未明确,P=0.029),提示KMT2A/C突变的预测价值独立于TMB,可能存在其他机制(如调控免疫微环境)。
产品关联:文献未提及具体实验产品,领域常规使用TMB计算工具(如Mutect2、VarScan2)、生物信息学分析软件(如R语言、Python)。
4. Biomarker 研究及发现成果解析
Biomarker定位与筛选验证逻辑
本研究中的Biomarker为KMT2A/C基因体细胞突变,属于“分子遗传类生物标志物”。其筛选验证逻辑为:原发性ICIs队列发现关联→扩展ICIs队列验证→非ICIs队列排除预后干扰→TCGA数据库分析泛癌突变频率,形成“发现-验证-确认”的完整链条。
研究过程详述
Biomarker的来源为肿瘤组织体细胞突变(通过全外显子测序或靶向测序检测)。研究过程涉及三个核心队列:
1. 原发性ICIs治疗队列(n=546):通过生存分析(PFS/OS)、ORR/DCB计算,发现KMT2A/C突变与更好的临床结局关联;
2. 扩展ICIs治疗队列(n=1395):验证突变组OS显著延长;
3. 非ICIs治疗队列(n=2252):排除突变本身的预后影响;
4. TCGA数据库(33种瘤种):分析KMT2A/C突变频率(0%-30.9%,平均12.2%),明确其在泛癌中的分布。
验证方法包括:生存分析(Kaplan-Meier法+Cox比例风险模型)、客观响应率/持久临床获益计算(按RECIST标准)、TMB关联分析(生物信息学工具计算)。特异性与敏感性数据:在原发性队列中,突变组ORR为40.9%(野生组20.3%,P<0.001),DCB为48.3%(野生组29.8%,P=0.001);扩展队列中,突变组OS的HR为0.68(P=0.003),提示较高的敏感性与特异性。
核心成果提炼
- 预测效能:KMT2A/C突变患者接受ICIs治疗的PFS(HR=0.66,P=0.002)、OS(HR=0.70,P=0.033)显著延长,ORR/DCB显著提高;即使在TMB低亚组(<10突变/Mb),突变仍可预测更好的ORR(32.6% vs 17.9%,P=0.029)。
- 泛癌适用性:在扩展队列的多数瘤种(如黑色素瘤、非小细胞肺癌)中,突变组均有OS优势;TCGA数据显示其在33种瘤种中的平均突变频率为12.2%,可覆盖相当比例的潜在获益患者。
- 创新性:首次发现KMT2A/C突变作为ICIs治疗的预测生物标志物,且其价值独立于TMB,为ICIs的精准应用提供了新的分子指标。
本研究的局限性包括:未纳入PD-L1表达数据进行对比,部分瘤种的样本量较小;未来需通过 biomarker 驱动的临床试验进一步验证其临床价值,同时探索其调控免疫微环境的具体机制。
