1. 领域背景与文献引入
文献英文标题:Treatment with rituximab and brentuximab vedotin in a patient of common variable immune deficiency-associated classic Hodgkin lymphoma;发表期刊:Biomark Res;影响因子:未公开;研究领域:普通变异型免疫缺陷(CVID)相关淋巴增殖性疾病(经典霍奇金淋巴瘤)的靶向治疗。
普通变异型免疫缺陷(CVID)是一种罕见的原发性免疫缺陷病,核心特征为免疫球蛋白(IgG、IgA、IgM)水平显著降低,病因涉及ITK、BTK等多个基因缺陷。临床表型异质性大,患者常反复发生细菌性鼻窦炎、肺炎等感染,伴发免疫性血小板减少性紫癜、自身免疫性溶血性贫血等自身免疫病,部分患者还会进展为淋巴增殖性疾病(包括恶性淋巴瘤)。领域共识:CVID患者的恶性肿瘤发生率较普通人群高约5倍,其中非霍奇金淋巴瘤(NHL)是最常见的关联恶性肿瘤(占比29%),而经典霍奇金淋巴瘤(cHL)则极为罕见(发生率约0.8%)。由于病例数有限,CVID相关cHL的预后尚未明确,仅有的少数报告显示,传统细胞毒性化疗(如ABVD方案)虽对免疫功能正常的cHL患者有效,但在CVID患者中因免疫缺陷导致感染并发症风险显著升高——部分患者甚至因败血症死亡,治疗耐受性极差。
近年来,靶向治疗成为淋巴瘤的重要治疗策略。利妥昔单抗是抗CD20单克隆抗体,主要用于治疗表达CD20的B细胞NHL;维布妥昔单抗是抗CD30抗体-药物偶联物,获批用于复发/难治性cHL。两者均具有靶向性强、不良反应轻的特点,且利妥昔单抗曾被安全用于CVID患者的自身免疫性细胞减少症治疗。然而,这两种药物在CVID相关cHL中的应用效果及安全性尚未见报道,成为领域内的研究空白。本研究通过病例报告的形式,首次探讨利妥昔单抗联合维布妥昔单抗在CVID相关cHL患者中的治疗价值,为这类免疫缺陷人群的淋巴瘤治疗提供新的临床证据。
2. 文献综述解析
文献综述围绕“CVID的临床特征与淋巴瘤关联”“CVID相关淋巴瘤的治疗挑战”“靶向药物的作用机制与应用现状”三大维度展开。首先,作者总结CVID的核心病理特征(免疫球蛋白缺乏、T细胞功能异常)及常见并发症,强调NHL是最常见的关联恶性肿瘤,而cHL因发生率低,其发病机制、临床特征及预后均不明确。其次,作者指出传统化疗的局限性:CVID患者本身免疫缺陷,化疗会进一步抑制免疫功能,导致严重感染风险显著升高。此外,作者梳理了靶向药物的机制:利妥昔单抗通过结合CD20介导B细胞清除,维布妥昔单抗通过CD30靶向递送细胞毒性药物(MMAE)诱导肿瘤细胞凋亡;现有研究证实两者对部分cHL患者有效,但在CVID相关cHL中的应用无报道。
通过对比现有研究的未解决问题(CVID相关cHL的安全有效治疗方案缺失),本研究的创新价值凸显:首次报告CVID相关cHL患者使用利妥昔单抗联合维布妥昔单抗的临床结局,证明靶向药物在这类患者中的安全性和有效性,填补了CVID相关淋巴增殖性疾病靶向治疗的空白。
3. 研究思路总结与详细解析
本研究为病例报告,研究目标是评估利妥昔单抗与维布妥昔单抗在CVID相关cHL患者中的安全性和疗效;核心科学问题是“靶向CD20/CD30的药物能否在不增加感染风险的前提下,有效治疗CVID相关cHL”;技术路线为“患者临床特征收集→病理诊断→靶向治疗→疗效评估→长期随访”。
3.1 患者临床特征与诊断
实验目的:明确患者的CVID诊断及cHL的病理特征。
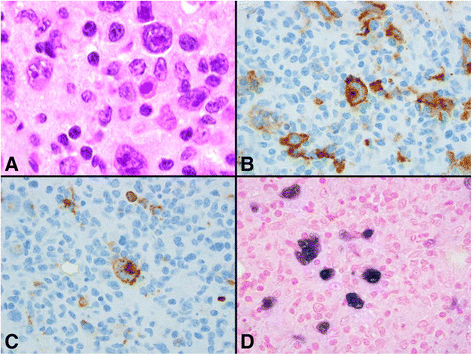
方法细节:回顾性收集患者病史(2006年诊断CVID,ITK突变)、实验室检查(低丙种球蛋白血症)及影像学结果(2013年CT提示全身淋巴结肿大);对左髂骨骨髓活检标本进行HE染色、免疫组化(CD30、CD20、PAX-5)及EB病毒编码RNA(EBER)原位杂交(使用Ventana Medical Systems的INFORM EBER探针和iVIEWTMblue检测试剂盒)。
结果解读:患者为25岁女性,2013年因左腰腹痛、发热就诊,骨髓活检HE染色显示HRS细胞(霍奇金 Reed-Sternberg细胞)伴纤维炎性背景(图1a);免疫组化显示HRS细胞表达CD30(图1b)、CD20(弱至中度,图1c)及PAX-5(弱);EBER原位杂交阳性(图1d),最终诊断为EBV阳性CVID相关经典霍奇金淋巴瘤。
产品关联:实验所用关键产品:Ventana Medical Systems的INFORM EBER探针及iVIEWTMblue检测试剂盒;利妥昔单抗、维布妥昔单抗的具体品牌未提及,领域常规使用相应药物(如利妥昔单抗常用罗氏美罗华)。
3.2 初始利妥昔单抗治疗与疗效评估
实验目的:观察利妥昔单抗单药对CVID相关cHL的初步疗效。
方法细节:患者接受利妥昔单抗治疗(375 mg/m²,每周1次,共4周期);治疗前后监测临床症状(发热、腹痛)、实验室指标(LDH)及PET-CT。
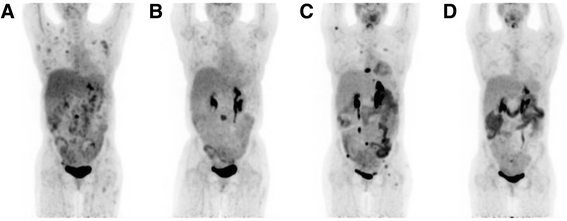
结果解读:治疗后患者发热、腹痛缓解,LDH从853 U/L(正常313~618 U/L)降至正常;2014年1月PET-CT显示淋巴结代谢接近完全缓解,但骨病变(左侧髂骨、L3椎体)仅部分缓解(图2b)。
3.3 后续治疗与疗效评估
实验目的:清除残留病灶,评估维布妥昔单抗的疗效。
方法细节:患者先接受L3椎体放疗(4000 cGy),追加4周期利妥昔单抗;2014年6月PET-CT显示骨病变进展(右侧肱骨等新发病灶,图2c),更换为维布妥昔单抗(1.8 mg/kg,每3周1次,共10周期),同时维持利妥昔单抗每2个月1次。
结果解读:2014年12月PET-CT显示所有病变代谢完全消失(完全缓解,图2d);治疗中仅出现中度神经病变(维布妥昔单抗常见不良反应),无严重感染。
3.4 长期随访
实验目的:评估治疗的长期有效性和安全性。
方法细节:患者维持利妥昔单抗每2个月1次,定期随访临床症状及PET-CT。
结果解读:截至文献发表时,患者无疾病复发,一般状况良好,未出现严重感染。
4. Biomarker 研究及发现成果解析
Biomarker定位:本研究的Biomarker为淋巴瘤细胞表面的CD20和CD30分子,筛选逻辑基于病理活检的免疫组化结果(HRS细胞表达CD20和CD30),验证逻辑为“靶点表达→靶向治疗→疗效确认”的闭环。
研究过程详述:Biomarker来源为患者骨髓活检的HRS细胞;验证方法为免疫组化染色(CD20、CD30);由于是病例报告,未进行大样本特异性与敏感性分析,但患者肿瘤细胞确实表达这两个Biomarker,且治疗后完全缓解。
核心成果提炼:本研究首次证实,CD20和CD30不仅是cHL的诊断Biomarker,也是CVID相关cHL的有效治疗靶点。患者使用利妥昔单抗(靶向CD20)联合维布妥昔单抗(靶向CD30)后达到完全缓解,且无严重感染,证明该方案安全有效。长期随访(无复发)提示疗效持久。由于是病例报告,未提供HR值、ROC曲线等数据,但临床结局明确支持该方案的价值。
