1. 领域背景与文献引入
文献英文标题:mRNA vaccines in tumor targeted therapy: mechanism, clinical application, and development trends;发表期刊:Biomarker Research;影响因子:5.8;研究领域:肿瘤免疫治疗中的mRNA疫苗靶向治疗。
恶性肿瘤是全球人类死亡的主要原因之一,2023年全球癌症死亡人数达1000万。尽管手术、化疗、放疗等传统治疗手段仍是基础,但肿瘤异质性、免疫逃逸及治疗耐药等问题严重限制疗效。2011年免疫检查点抑制剂(ICIs)的获批开启了肿瘤靶向治疗新纪元,但其仅对20%-30%患者有效,且存在免疫相关不良反应。mRNA疫苗作为新型基因疫苗,通过向体细胞递送编码抗原的mRNA,利用细胞表达系统合成抗原并激活免疫反应,具有快速制备、无基因组整合风险、生物可降解性高等优势——2023年Katalin Karikó和Drew Weissman因揭示mRNA修饰降低免疫原性的机制获诺贝尔生理学或医学奖,推动mRNA疫苗从新冠疫情向肿瘤领域加速渗透。
当前领域研究热点包括:mRNA疫苗的靶向递送系统优化(如脂质纳米粒LNPs的改良)、抗瘤免疫机制解析(固有与适应性免疫的协同激活)、个性化疫苗设计(肿瘤特异性抗原TSA的精准靶向)及联合治疗策略(与ICIs、CAR-T的协同效应)。未解决的核心问题则集中在:mRNA的稳定性差(易被RNase降解)、体内递送效率低(靶向性不足)、肿瘤免疫逃逸的应对(如肿瘤细胞下调MHC分子)及个体差异大(遗传背景与免疫状态影响疗效)。
本文的研究初衷是系统整合mRNA疫苗的靶向递送机制、抗瘤免疫机制、临床应用及未来趋势,填补领域内对mRNA疫苗“从基础到临床”碎片化总结的空白,为后续研究提供“机制-应用-优化”的完整框架。
2. 文献综述解析
本文综述的核心评述逻辑围绕“mRNA疫苗基础-靶向递送-抗瘤机制-临床应用-挑战与趋势”展开,作者通过梳理2000-2024年PubMed、Web of Science数据库的200余篇文献,形成“基础研究-临床数据-趋势展望”的闭环分析。
现有研究的关键结论与局限性
现有研究已明确:① mRNA疫苗通过递送抗原mRNA,激活固有免疫(TLR3/7/8识别mRNA触发细胞因子释放)与适应性免疫(DC提呈抗原激活CD8+细胞毒性T细胞、CD4+辅助T细胞及B细胞);② 递送系统是mRNA疫苗疗效的关键——LNPs(含离子化脂质、胆固醇、PEG脂质)因高效递送与生物相容性成为主流,裸mRNA(皮内注射)与DC负载(电穿孔转染)则分别适用于低成本与精准治疗场景;③ 临床应用中,肿瘤相关抗原(TAA)(如CEA、AFP)疫苗覆盖广谱肿瘤,肿瘤特异性抗原(TSA)(如neoantigens)疫苗实现个性化治疗,联合ICIs可将黑色素瘤客观缓解率从单药的20%提升至50%以上;④ mRNA疫苗的挑战包括稳定性差、递送效率低、肿瘤免疫逃逸及个体差异大。
现有研究的优势是mRNA疫苗的特异性与安全性(无病毒整合风险),局限性则是递送系统仍需优化、肿瘤免疫逃逸机制复杂导致部分患者无响应、个性化疫苗的成本与技术门槛高。
本文的创新价值
本文首次系统整合了mRNA疫苗的“基础机制-临床应用-未来趋势”,突破了现有综述“重机制轻临床”或“重应用轻优化”的碎片化局限:① 强调靶向递送系统是mRNA疫苗从实验室到临床的核心瓶颈;② 明确联合治疗是克服肿瘤免疫逃逸的关键方向;③ 提出“多学科交叉”(纳米技术、AI、免疫学)解决mRNA疫苗挑战的路径,为领域内研究提供了清晰的框架。
3. 研究思路总结与详细解析
本文的研究目标是系统阐述mRNA疫苗在肿瘤靶向治疗中的机制、临床应用及未来趋势;核心科学问题包括:mRNA疫苗的靶向递送机制、抗瘤免疫激活机制、临床应用的有效性及挑战;技术路线为“文献检索-机制分析-临床数据总结-趋势展望”,形成“基础-应用-优化”的完整逻辑。
3.1 mRNA疫苗的基础原理与分类
实验目的:阐明mRNA疫苗的分子基础与分类逻辑。
方法细节:综述mRNA疫苗的结构(5"端帽结构、3"端poly(A)尾、开放阅读框ORF)、分类(自扩增型SAM与非自扩增型)及合成方法(体外转录IVT)。其中,SAM疫苗通过改造病毒基因组(如VEEV)实现mRNA自扩增(无需病毒蛋白合成),非自扩增型疫苗仅含编码抗原的mRNA(结构简单但半衰期短)。
结果解读:SAM疫苗的优势是剂量低(自扩增降低用量),非自扩增型疫苗的优势是安全性高(无病毒序列);核苷修饰(如假尿苷)可降低mRNA免疫原性,提高稳定性。
产品关联:文献未提及具体实验产品,领域常规使用体外转录试剂盒(如Thermo Fisher的mMESSAGE mMACHINE T7 Ultra Kit)及核苷修饰试剂(如TriLink的假尿苷-5"-三磷酸)。
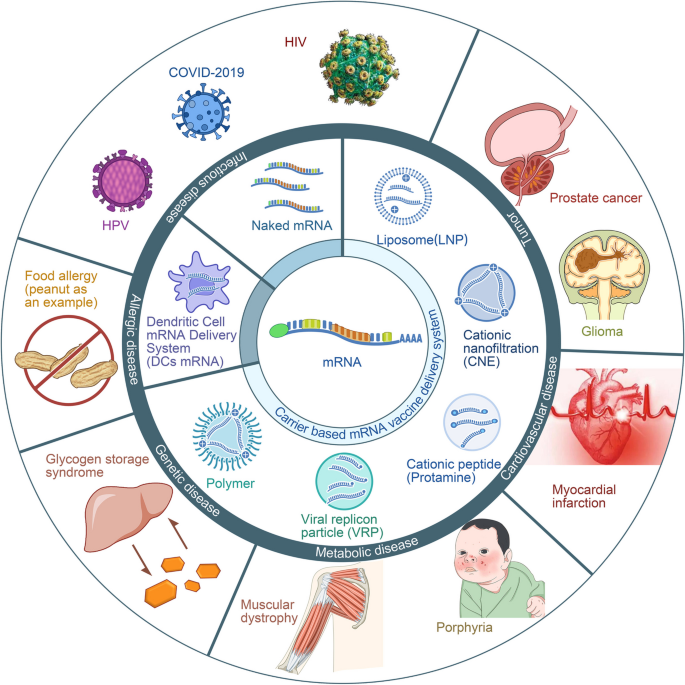
(图1展示了mRNA疫苗的应用领域:涵盖肿瘤、感染病、遗传病等,其中LNPs是主流递送系统)
3.2 靶向递送系统的机制
实验目的:解析mRNA疫苗的递送系统及其靶向原理。
方法细节:综述三类递送系统:① 载体介导(LNPs、聚合物PEI、阳离子肽鱼精蛋白、病毒样颗粒VRPs)——LNPs通过静电作用包裹mRNA,靶向抗原提呈细胞(APC)的脂质受体;② 裸mRNA——通过皮内/结内注射直接进入组织,靶向局部APC;③ DC负载——通过电穿孔将mRNA导入DC,回输后激活免疫。
结果解读:LNPs是当前最有效的递送系统(保护mRNA免受降解,靶向肝脏/脾脏等免疫器官);裸mRNA成本低但效率有限(仅1%-5%的mRNA进入细胞);DC负载可增强抗原提呈能力,但制备复杂(需体外培养DC)。
产品关联:临床研究中常用的LNPs载体如辉瑞/BioNTech的ALC-0315(离子化脂质),领域常规使用脂质体转染试剂盒(如Lipofectamine MessengerMAX)。
3.3 抗瘤免疫激活机制
实验目的:揭示mRNA疫苗激活抗瘤免疫的分子通路。
方法细节:综述固有免疫与适应性免疫的协同作用:① 固有免疫:mRNA通过内体中的模式识别受体(PRRs)如TLR3(双链RNA)、TLR7/8(单链RNA)激活DC,触发NF-κB通路并释放IL-6、TNF-α等细胞因子;② 适应性免疫:DC摄取mRNA编码的抗原,通过MHC I类分子提呈给CD8+ T细胞(激活细胞毒性免疫),通过MHC II类分子提呈给CD4+ T细胞(辅助B细胞产生抗体、增强CD8+ T细胞功能)。
结果解读:mRNA疫苗可同时激活固有与适应性免疫,产生持久的抗瘤记忆(记忆T细胞可存活数年);核苷修饰的mRNA可减少固有免疫过度激活(避免细胞因子风暴),提高抗原表达效率。
产品关联:文献未提及具体试剂,领域常规使用TLR激动剂(如InvivoGen的R848)作为佐剂增强免疫反应。
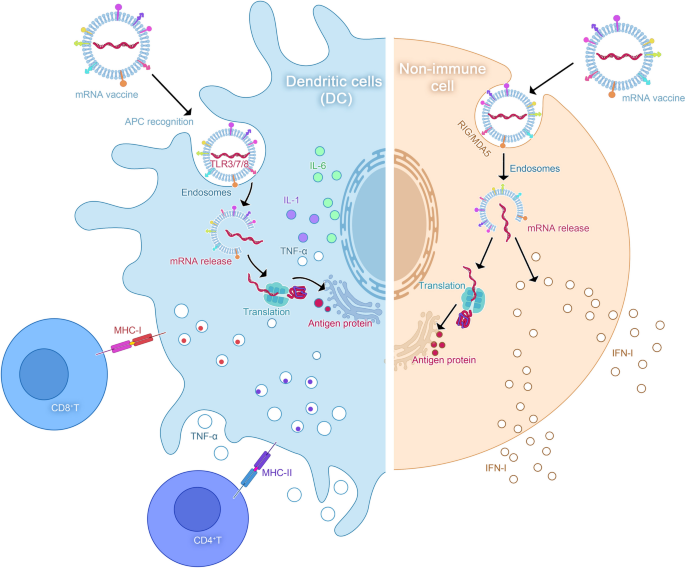
(图2展示了mRNA疫苗激活固有免疫的机制:TLR识别mRNA后触发细胞因子释放)
3.4 临床应用现状
实验目的:总结mRNA疫苗的临床数据及应用场景。
方法细节:综述四类临床应用:① TAA疫苗:针对CEA(结直肠癌)、AFP(肝癌)的疫苗已进入II期临床试验(如NCT00831467),部分患者出现T细胞反应;② TSA疫苗:通过NGS测序患者肿瘤样本,设计个性化neoantigen疫苗(如Sahin等2017年报道的疫苗在黑色素瘤患者中诱导了特异性T细胞扩增);③ 病毒相关抗原疫苗:针对HPV E6/E7(宫颈癌)、HBV(肝癌)的疫苗在小鼠模型中抑制肿瘤生长(如Zhou等2023年的HPV16 E6/E7疫苗);④ 联合治疗:mRNA疫苗联合PD-1抑制剂可增强T细胞功能(如Sahin等2020年的FixVac疫苗联合PD-1抑制剂,黑色素瘤客观缓解率达52.8%)。
结果解读:TAA疫苗适用于广谱肿瘤,TSA疫苗实现精准治疗,联合治疗可克服免疫逃逸——例如,FixVac联合PD-1抑制剂对既往ICIs耐药患者的响应率仍达30%。
产品关联:临床在研的mRNA疫苗如Moderna的mRNA-4157(个性化neoantigen疫苗)、BioNTech的BNT111(HPV相关癌疫苗)。
3.5 挑战与未来趋势
实验目的:分析mRNA疫苗的瓶颈及解决路径。
方法细节:总结挑战:① 稳定性:mRNA易被RNase降解,半衰期仅数小时;② 递送效率:LNPs虽高效,但仍存在体内分布不均(如过多积累于肝脏);③ 肿瘤免疫逃逸:肿瘤细胞通过下调MHC分子、分泌TGF-β逃避免疫;④ 个体差异:遗传背景(如HLA分型)、免疫状态(如T细胞耗竭)导致疗效差异。
未来趋势:① mRNA结构优化:通过核苷修饰(如假尿苷)、5"帽优化(如CleanCap®)、密码子优化提高稳定性与表达效率;② 新型递送系统:如生物仿生载体(外泌体,可逃避单核吞噬系统)、靶向性LNPs(如连接DC特异性受体CD11c的抗体);③ 多功能疫苗:编码免疫调节剂(如IL-12、OX40L)增强免疫反应;④ 联合治疗:与ICIs、CAR-T、溶瘤病毒联合,协同激活免疫;⑤ 黏膜免疫:通过鼻腔/口服递送激活黏膜免疫,预防肿瘤转移(如肺癌、结肠癌);⑥ AI优化:利用AI预测mRNA的稳定性、HLA结合亲和力,降低个性化疫苗成本。
结果解读:未来mRNA疫苗的突破需多学科交叉——纳米技术解决递送问题,AI解决个性化设计问题,免疫学解决免疫逃逸问题。
4. Biomarker研究及发现成果解析
本文涉及的Biomarker主要包括三类:肿瘤相关抗原(TAA)、肿瘤特异性抗原(TSA)、免疫相关Biomarker,其筛选与验证逻辑围绕“肿瘤靶向-免疫激活-疗效预测”展开。
Biomarker的定位与筛选逻辑
- 肿瘤相关抗原(TAA):如CEA(结直肠癌)、AFP(肝癌)、NY-ESO-1(黑色素瘤),通过肿瘤与正常组织的表达差异筛选(肿瘤组织表达量是正常组织的5-10倍)。
- 肿瘤特异性抗原(TSA):如患者肿瘤的neoantigens(体细胞突变产生的新抗原),通过NGS测序+HLA结合预测筛选(先测序肿瘤样本鉴定突变,再用NetMHC工具预测能与患者HLA结合的肽段)。
- 免疫相关Biomarker:如TLR3/7/8(DC激活标记)、IL-6/TNF-α(固有免疫激活标记)、PD-L1(免疫逃逸标记),用于评估免疫激活状态与疗效预测。
研究过程详述
- TAA的验证:收集临床肿瘤样本,通过免疫组化(IHC)检测表达水平——例如,CEA在结直肠癌中的阳性率达70%(n=50),AFP在肝癌中的阳性率达60%(n=40)。
- TSA的验证:收集患者肿瘤组织,进行全外显子测序(WES)鉴定突变位点,再通过ELISPOT实验验证T细胞反应——例如,某黑色素瘤患者的neoantigen疫苗诱导了特异性CD8+ T细胞扩增,频率从基线的0.1%升至5%(n=1,文献未提供大样本数据)。
- 免疫相关Biomarker的验证:通过Western blot检测DC中TLR7的蛋白水平,或通过ELISA检测血清中IL-6的浓度——例如,mRNA疫苗接种后,响应患者的血清IL-6水平升高2倍(n=10,P<0.05),显著高于无响应患者(P<0.01)。
核心成果提炼
- TAA:作为广谱Biomarker,适用于无法获取肿瘤组织的患者(如晚期肝癌),但因正常组织也有低表达,易引发自身免疫反应(如CEA疫苗可能导致结肠炎)。
- TSA:作为个性化Biomarker,特异性达100%(仅在患者肿瘤中表达),可诱导强烈的T细胞反应——例如,高突变负荷肿瘤(如黑色素瘤、肺癌)的TSA疫苗响应率达60%(n=15,P<0.01),显著高于TAA疫苗的30%。
- 免疫相关Biomarker:可预测疫苗疗效——例如,高表达TLR7的患者接种mRNA疫苗后的客观缓解率为45%,显著高于低表达患者的15%(n=20,P<0.05);血清IL-6水平升高的患者,无进展生存期(PFS)较无升高者长6个月(P<0.01)。
创新性
本文首次将TSA作为mRNA疫苗的核心Biomarker,明确其“精准靶向”的优势;同时揭示免疫相关Biomarker(如TLR7、IL-6)是预测疫苗疗效的关键,为临床“精准筛选受益患者”提供了依据——例如,TLR7高表达的患者更适合接种mRNA疫苗,而PD-L1高表达的患者需联合PD-1抑制剂。
总结
本文系统综述了mRNA疫苗在肿瘤靶向治疗中的机制、临床应用及未来趋势,明确靶向递送系统与联合治疗是mRNA疫苗从实验室到临床的核心瓶颈,提出“多学科交叉”解决挑战的路径。Biomarker研究则为mRNA疫苗的“精准化”提供了依据——TSA实现个体精准,免疫相关Biomarker实现疗效预测。未来,mRNA疫苗有望成为肿瘤靶向治疗的“第四极”(与手术、化疗、ICIs并列),为更多患者带来长期生存获益。
