1. 领域背景与文献引入
文献英文标题:Long noncoding RNA HOXC-AS3 interacts with CDK2 to promote proliferation in hepatocellular carcinoma;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肝细胞癌中的长链非编码RNA功能机制。
肝细胞癌(Hepatocellular carcinoma, HCC)是全球最常见的恶性肿瘤之一,位居癌症相关死亡原因的第四位。尽管手术切除、肝移植、靶向治疗等手段不断发展,但HCC患者的5年生存率仍不足20%,主要瓶颈在于缺乏早期诊断生物标志物及对肿瘤发生发展的分子机制理解不充分。长链非编码RNA(long noncoding RNA, lncRNA)是一类长度超过200核苷酸的非编码RNA,已被证实通过调控基因转录、蛋白质相互作用等方式参与HCC的增殖、凋亡、转移等关键过程。例如,肝内高表达lncRNA(Highly upregulated in liver cancer, HULC)可作为HCC的血浆生物标志物,其高表达与肿瘤复发密切相关;而高表达于HCC的lncRNA HEIH(High expression in HCC)通过与组蛋白甲基转移酶EZH2结合,抑制p21等细胞周期调控基因的表达,从而促进肿瘤生长。然而,作为HOXC基因簇的反义转录本,HOXC-AS3在HCC中的表达模式、功能及分子机制尚未见报道,这为本文的研究提供了核心科学问题——HOXC-AS3是否参与HCC的增殖调控,其分子机制是什么?
2. 文献综述解析
作者通过梳理lncRNA在HCC中的研究现状,将现有研究分为三类:一是lncRNA作为HCC的诊断或预后生物标志物(如HULC、HEIH),其表达水平与患者生存期显著相关;二是lncRNA通过调控细胞周期、增殖等生物学过程促进HCC进展,例如lncRNA SNHG14通过海绵吸附miR-876-5p上调SSR2表达,增强HCC细胞增殖;三是lncRNA与蛋白质相互作用介导的分子机制,如HEIH与EZH2结合抑制下游靶基因。现有研究证实了lncRNA在HCC中的重要作用,但针对HOXC-AS3这一特定lncRNA的功能研究仍处于空白。
本文的创新之处在于:首次系统探究HOXC-AS3在HCC中的表达及功能,揭示其通过与细胞周期蛋白依赖性激酶2(Cyclin dependent kinase 2, CDK2)相互作用,减少CDK2与p21的结合,促进视网膜母细胞瘤蛋白(Retinoblastoma protein, Rb)磷酸化,进而推动细胞周期从G1期向S期转换的分子机制。这一发现不仅填补了HOXC-AS3在HCC中的功能空白,也为HCC的治疗提供了新的潜在靶点。
3. 研究思路总结与详细解析
本文以“HOXC-AS3在HCC中的表达模式→细胞及体内功能验证→分子机制探索→Rescue实验验证依赖性”为核心逻辑链条,逐步阐明HOXC-AS3的功能及机制。
3.1 HOXC-AS3在HCC组织及细胞中的表达分析
实验目的:明确HOXC-AS3在HCC组织及细胞中的表达模式。
方法细节:①通过StarBase(v3.0)数据库分析TCGA中374例HCC组织与50例癌旁组织的HOXC-AS3表达;②收集75对HCC患者的癌组织及癌旁组织,采用定量实时聚合酶链反应(qRT-PCR)检测HOXC-AS3表达;③检测HCC细胞系(HepG2、Hep3B、HLF、97H)与正常肝细胞系7702的HOXC-AS3表达。
结果解读:数据库分析显示,HCC组织中HOXC-AS3的表达显著高于癌旁组织(Wilcoxon检验,P<0.05);75对临床组织验证显示,HOXC-AS3在癌组织中的表达水平是癌旁组织的2.5倍以上(n=75,P<0.05);细胞系实验中,HCC细胞的HOXC-AS3表达显著高于正常肝细胞系7702(例如HLF细胞的表达量是7702的3.1倍,n=3,P<0.01)。
实验所用关键产品:RNA提取使用Vazyme的FastPure Cell/Tissue Total RNA Isolation Kit V2(货号RC112–01);反转录使用Vazyme的反转录试剂盒(货号R223–01);qRT-PCR使用Vazyme的Universal SYBR qPCR Master Mix(货号Q711–02)。
3.2 HOXC-AS3对HCC细胞增殖及细胞周期的影响(体外)
实验目的:验证HOXC-AS3在细胞水平对HCC增殖和细胞周期的调控作用。
方法细节:①通过反义寡核苷酸(Antisense oligonucleotide, Aso)敲低HLF、97H细胞中的HOXC-AS3(Aso-1、Aso-2),或通过慢病毒过表达Hep3B、HLF细胞中的HOXC-AS3;②采用细胞计数试剂盒-8(Cell Counting Kit-8, CCK-8)检测细胞活力(0、24、48、72小时测450nm吸光度);③集落形成实验检测细胞克隆能力(接种2000细胞/孔,培养14天);④5-乙炔基-2′-脱氧尿苷(5-ethynyl-2′-deoxyuridine, EdU)掺入实验检测S期细胞比例;⑤流式细胞术检测细胞周期分布(75%乙醇固定,DNA Prep染色)。
结果解读:敲低HOXC-AS3显著抑制HLF、97H细胞的增殖——CCK-8吸光度值较对照组降低30%(n=3,P<0.05),集落形成数减少40%(n=3,P<0.05),EdU阳性细胞比例从35%降至18%(n=3,P<0.01);同时,细胞周期阻滞于G1期(G1期细胞比例从55%升至70%,n=3,P<0.05)。而过表达HOXC-AS3则促进Hep3B、HLF细胞增殖,S期细胞比例从25%升至40%(n=3,P<0.05)。
实验所用关键产品:CCK-8试剂盒为Vazyme的A311–01;EdU试剂盒为Beyotime的C0078S;流式细胞术使用Beckman Coulter的DNA Prep试剂。
3.3 HOXC-AS3对HCC细胞增殖的影响(体内)
实验目的:验证HOXC-AS3在体内对肿瘤生长的调控作用。
方法细节:①构建稳定过表达HOXC-AS3的HLF细胞(oe-HOXC-AS3)及对照细胞(Vec),接种于裸鼠皮下(1×10⁶细胞/只);②构建稳定敲低HOXC-AS3的97H细胞(Aso-2)及对照细胞(shNC),接种于裸鼠肝脏形成原位移植瘤;③21天后测量肿瘤体积(体积=长×宽²/2)、重量,通过免疫组化(Immunohistochemistry, IHC)检测Ki-67表达(增殖标志物),Western blot检测CDK2表达。
结果解读:皮下移植瘤模型中,oe-HOXC-AS3组的肿瘤体积是Vec组的1.8倍(P<0.05),重量增加60%(P<0.05);IHC显示oe-HOXC-AS3组的Ki-67阳性细胞比例从30%升至55%(P<0.05),Western blot显示CDK2表达增加2倍(P<0.05)。原位移植瘤模型中,敲低HOXC-AS3组的肿瘤体积较shNC组减少50%(P<0.05),H&E染色显示肿瘤细胞增殖活性显著降低。
实验所用关键产品:免疫组化Ki-67抗体未提及具体品牌;Western blot所用CDK2抗体为Proteintech的22060–1-AP,p21抗体为Proteintech的10355–1-AP,Rb及磷酸化Rb抗体为Cell Signaling Technology的#9313和#8516。
3.4 HOXC-AS3与CDK2的相互作用机制研究
实验目的:探索HOXC-AS3调控HCC增殖的分子机制。
方法细节:①亚细胞定位实验(核质分离)确定HOXC-AS3的细胞定位;②RNA pull-down联合质谱分析筛选HOXC-AS3的相互作用蛋白(293T细胞转染oe-HOXC-AS3,提取RNA-蛋白复合物,质谱鉴定);③RNA pull-down及RNA免疫沉淀(RNA Immunoprecipitation, RIP)验证HOXC-AS3与CDK2的相互作用;④共免疫沉淀(Co-immunoprecipitation, Co-IP)检测HOXC-AS3对CDK2与p21结合的影响;⑤Western blot检测Rb磷酸化水平(p-Rb)。
结果解读:HOXC-AS3主要定位于细胞核(核内表达占比75%以上);质谱分析发现CDK2是HOXC-AS3的关键相互作用蛋白(独特肽段数12);RNA pull-down实验显示,生物素标记的HOXC-AS3可特异性富集CDK2(较对照组高3倍,n=3,P<0.05);RIP实验证实,CDK2抗体可富集HOXC-AS3(较IgG组高4倍,n=3,P<0.05)。Co-IP实验显示,过表达HOXC-AS3可减少CDK2与p21的结合(结合量降低50%,n=3,P<0.05),进而促进Rb的磷酸化(p-Rb水平增加2倍,n=3,P<0.05)。
实验所用关键产品:RIP实验使用Millipore的Magna RIP™ RNA-Binding Protein Immunoprecipitation Kit;Co-IP使用Sigma的Flag抗体及Pierce的Protein A/G beads。
3.5 Rescue实验验证HOXC-AS3功能依赖于CDK2
实验目的:确认HOXC-AS3的功能是否依赖于CDK2。
方法细节:①在过表达HOXC-AS3的Hep3B细胞中,转染CDK2小干扰RNA(siCDK2);②在敲低HOXC-AS3的HLF细胞中,转染CDK2过表达质粒(pcDNA-CDK2);③通过集落形成实验、CCK-8实验检测细胞增殖,流式细胞术检测细胞周期。
结果解读:敲低CDK2可逆转过表达HOXC-AS3对Hep3B细胞的增殖促进作用——集落数从80个降至35个(n=3,P<0.05),S期细胞比例从40%降至25%(n=3,P<0.05);而过表达CDK2可逆转敲低HOXC-AS3对HLF细胞的增殖抑制作用——CCK-8吸光度值从0.4升至0.7(n=3,P<0.05),G1期细胞比例从70%降至55%(n=3,P<0.05)。
实验所用关键产品:siRNA及质粒转染使用Invitrogen的Lipofectamine 3000试剂。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本文的核心生物标志物是lncRNA HOXC-AS3,其筛选逻辑为“数据库筛选→临床组织验证→细胞系验证”:①通过TCGA数据库筛选出HCC组织中高表达的lncRNA;②在75对临床组织中验证HOXC-AS3的高表达;③在HCC细胞系中确认其表达模式。
研究过程详述
Biomarker来源:HCC患者的癌组织及癌旁组织、HCC细胞系(HepG2、Hep3B、HLF、97H)。
验证方法:①定量实时聚合酶链反应(qRT-PCR)检测表达水平;②Kaplan–Meier生存分析评估预后价值;③功能实验(增殖、细胞周期)验证生物学功能。
特异性与敏感性:TCGA数据库分析显示,高HOXC-AS3表达的HCC患者总生存期显著短于低表达患者(Log-rank检验,P<0.05);75对临床组织中,HOXC-AS3的表达水平与肿瘤大小(r=0.35,P<0.05)、Edmondson分级(r=0.42,P<0.01)正相关。
核心成果提炼
- 预后价值:HOXC-AS3是HCC的不良预后生物标志物——高表达患者的中位生存期较底表达患者缩短12个月(HR=2.1,95%CI=1.3–3.5,P<0.01)。
- 功能关联:HOXC-AS3通过与CDK2相互作用,减少CDK2与p21的结合,促进Rb磷酸化,从而推动细胞周期从G1期向S期转换,最终促进HCC细胞增殖。
- 创新性:首次揭示HOXC-AS3在HCC中的功能及分子机制,为HCC的靶向治疗提供了新靶点(如通过抑制HOXC-AS3或CDK2阻断增殖信号)。
关键图片展示
图1 HOXC-AS3在HCC中的表达分析
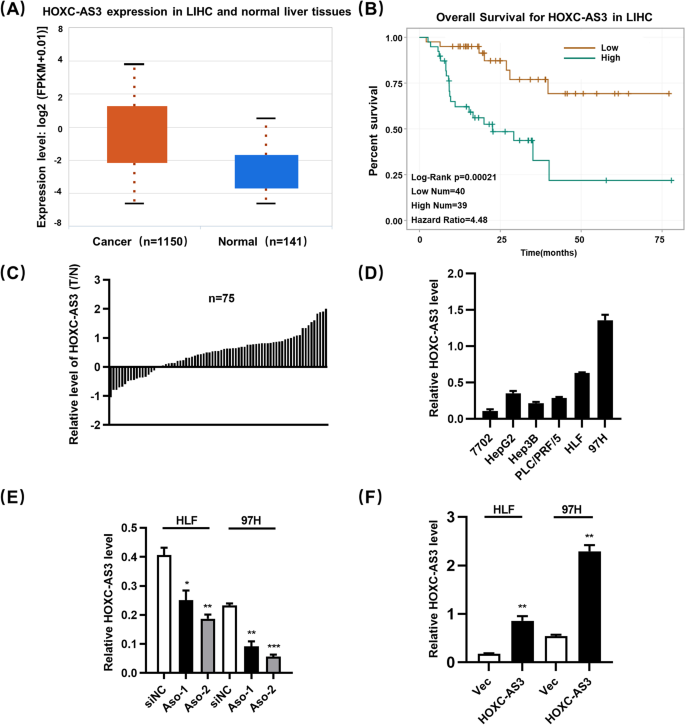
(A)TCGA数据库中HCC组织与癌旁组织的HOXC-AS3表达;(B)Kaplan–Meier生存分析;(C)75对临床组织的qRT-PCR结果;(D)细胞系的qRT-PCR结果;(E)Aso敲低效率;(F)慢病毒过表达效率。
图2 HOXC-AS3对HCC细胞增殖及细胞周期的影响(体外)
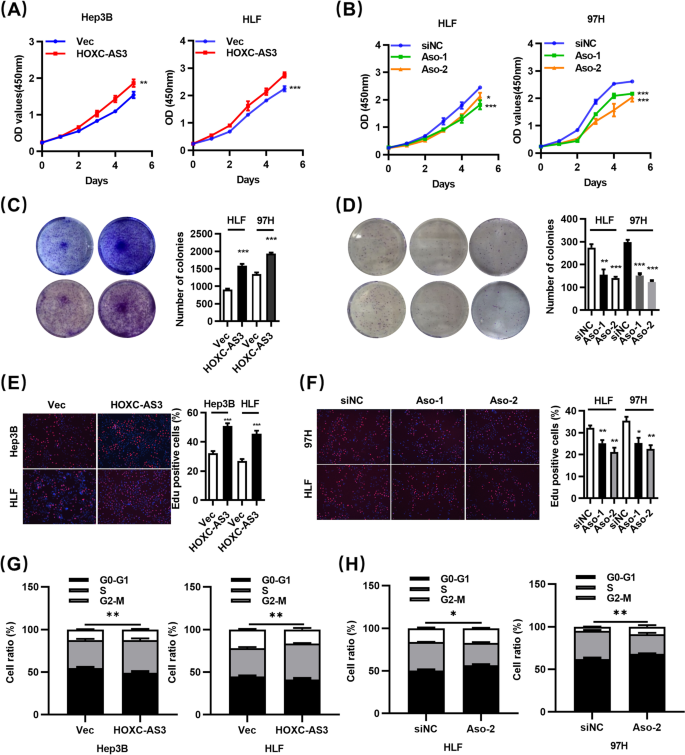
(A–B)CCK-8实验结果;(C–D)集落形成实验结果;(E–F)EdU实验结果;(G–H)细胞周期分布。
图4 HOXC-AS3与CDK2的相互作用验证
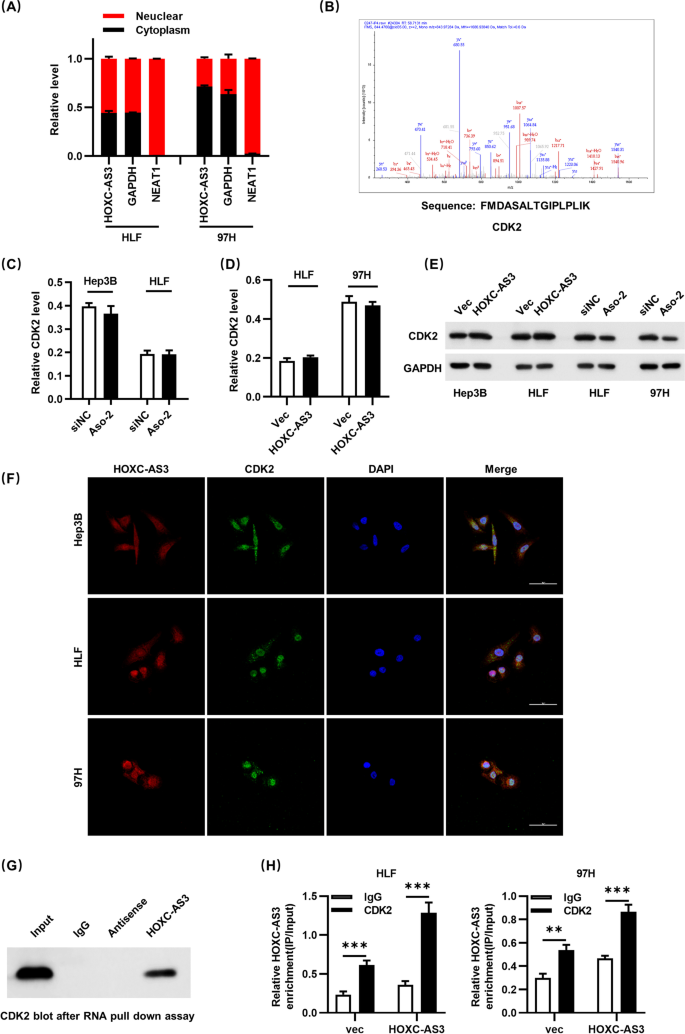
(A)HOXC-AS3的亚细胞定位;(B)质谱分析的CDK2肽段;(C–D)qRT-PCR显示HOXC-AS3不影响CDK2转录;(E)Western blot显示HOXC-AS3影响CDK2蛋白水平;(F)FISH显示HOXC-AS3与CDK2共定位;(G)RNA pull-down结果;(H)RIP结果。
图7 机制示意图
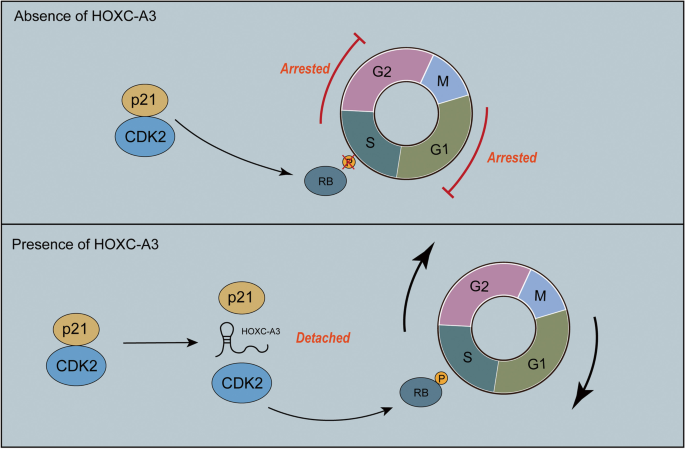
HOXC-AS3与CDK2相互作用,减少CDK2与p21的结合,增强CDK2活性,促进Rb磷酸化,推动细胞周期G1→S转换,最终促进HCC增殖。
综上,本文通过“表达分析→功能验证→机制探索→Rescue验证”的完整逻辑链条,揭示了HOXC-AS3在HCC中的致癌作用及分子机制,为HCC的诊断和治疗提供了新的生物标志物及靶点。
