1. 领域背景与文献引入
文献英文标题:Lower BCL11B expression is associated with adverse clinical outcome for patients with myelodysplastic syndrome;发表期刊:Biomarker Research;影响因子:未公开;研究领域:骨髓增生异常综合征(MDS)免疫相关预后生物标志物。
骨髓增生异常综合征(MDS)是一种以骨髓造血功能衰竭、外周血细胞减少及高风险进展为急性髓系白血病(AML)为特征的侵袭性血液系统疾病,其遗传异质性强,预后差异极大——低危患者生存期可达5年以上,而高危患者中位生存期不足1年。近年来,免疫微环境异常被证实是MDS进展的关键驱动因素:患者骨髓中虽存在抗肿瘤效应T细胞(如CD8+细胞毒性T细胞),但常因调节性T细胞(Treg)增多、细胞因子失衡等免疫抑制机制,导致T细胞功能障碍,无法有效清除肿瘤细胞。然而,目前仍缺乏能精准评估MDS患者T细胞功能改变的免疫生物标志物,限制了预后分层与个体化治疗的开展。
B细胞白血病/淋巴瘤11B(BCL11B)是调控T细胞发育、增殖及功能维持的核心转录因子,其低表达可导致T细胞受体(TCR)信号通路异常,引发T细胞功能障碍。已有研究证实,BCL11B低表达与T细胞急性淋巴细胞白血病患者的不良预后密切相关,但其在MDS中的表达特征及预后价值尚未明确。针对这一研究空白,本研究通过多数据集分析与临床样本验证,首次探索了BCL11B作为MDS预后生物标志物的可行性及其与T细胞功能的关联。
2. 文献综述解析
作者对MDS领域现有研究的评述逻辑围绕“疾病预后异质性-免疫微环境异常-T细胞功能改变-BCL11B的调控作用”展开,核心结论与局限性如下:
现有研究明确了MDS的预后异质性不仅与细胞遗传学异常相关,还与免疫微环境改变直接相关——肿瘤细胞可通过诱导Treg增多、分泌转化生长因子-β(TGF-β)等免疫抑制因子,逃避免疫监视;同时,MDS患者外周血及骨髓中的效应T细胞虽存在克隆扩增,但因凋亡增加、细胞因子(如干扰素-γ)分泌减少,无法有效发挥抗瘤作用,其具体机制尚未完全阐明。此外,BCL11B作为T细胞发育的关键调控因子,其低表达已被证实与T细胞功能障碍及白血病患者的不良预后相关,但该因子在MDS中的表达特征及与T细胞功能的关联尚未被研究。
本研究的创新点在于:(1)首次系统分析了MDS患者BCL11B的表达特征;(2)揭示了BCL11B与MDS患者临床结局(如OS、RMST)的关联;(3)阐明了BCL11B与T细胞亚群及TCR复合物基因的相互作用,为MDS的免疫预后评估提供了新的生物标志物。
3. 研究思路总结与详细解析
本研究的整体框架为:以“BCL11B在MDS中的预后价值”为核心,通过“数据库挖掘-临床样本验证-相关性分析-生存评估”的闭环思路,回答三个关键科学问题——BCL11B在MDS中的表达是否异常?是否与临床结局相关?是否与T细胞功能关联?
3.1 数据库与临床样本收集
实验目的是获取MDS患者与健康人群的BCL11B表达数据及临床信息。方法细节为:从Gene Expression Omnibus(GEO)数据库下载两个MDS数据集(GSE13159包含73例健康人、153例MDS患者的RNA-seq数据;GSE114922包含117例MDS患者的RNA-seq数据及生存信息);同时收集广东省人民医院的31例MDS患者及6例由MDS进展为继发性急性髓系白血病(sAML)患者的骨髓样本。结果为成功获取了用于分析的基因表达数据及对应的临床特征(如风险分层、年龄、性别、生存时间)。
3.2 BCL11B表达水平验证
实验目的是比较MDS患者与健康人群、不同临床特征MDS患者的BCL11B表达差异。方法细节为:首先通过GSE13159数据集分析健康人(HI)与MDS患者的BCL11B mRNA表达水平;随后采用定量实时PCR(qRT-PCR)检测临床样本的BCL11B表达,并按风险分层(低/中危vs高/极高危)、年龄(≤60岁vs>60岁)、性别(男vs女)及疾病状态(MDS vs sAML)进行亚组分析。
结果显示:GSE13159数据集下,MDS患者的BCL11B表达显著低于健康人(P<0.001);临床样本中,高/极高危MDS患者(n=16)及sAML患者(n=6)的BCL11B表达显著低于低/中危患者(n=15,P=0.027),>60岁患者的BCL11B表达低于≤60岁患者(P=0.048),男性患者的BCL11B表达低于女性患者(P=0.027)。对应的Fig1展示了上述差异,
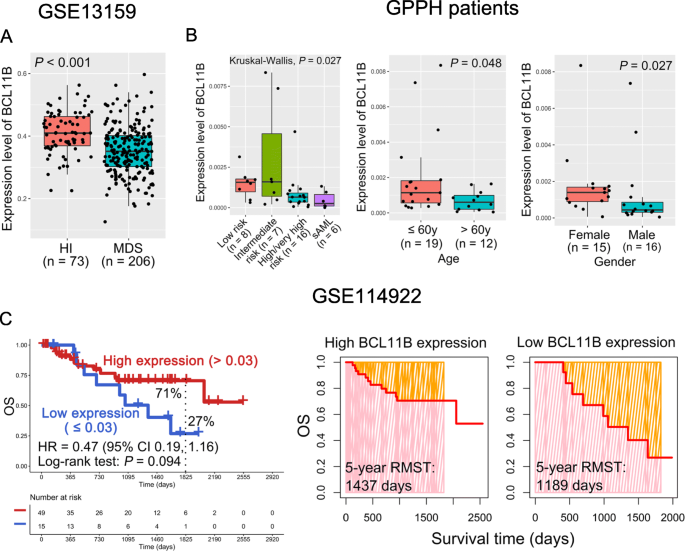
。
3.3 生存分析
实验目的是评估BCL11B表达与MDS患者生存结局的关系。方法细节为:基于GSE114922数据集的生存信息,将患者按BCL11B表达水平分为高、低两组,采用Kaplan-Meier法分析总生存期(OS),并计算限制平均生存期(RMST,即固定时间点内的平均生存时间)。
结果显示:低BCL11B表达组的5年OS率为27%,显著低于高表达组的71%(P=0.094,虽未达到统计学显著,但显示出明确的不良预后趋势);低表达组的5年RMST为1189天,短于高表达组的1437天(Fig1C)。
3.4 BCL11B与T细胞亚群及TCR基因的关联分析
实验目的是探讨BCL11B表达与T细胞功能的关系。方法细节为:首先通过GSE13159数据集分析BCL11B与T细胞亚群(naive CD4+ T细胞、活化记忆CD4+ T细胞、CD8+ T细胞、Treg)的相关性;随后分析BCL11B与TCR复合物基因(CD3D、CD3E、CD3G)的表达相关性;最后将BCL11B与CD3E、CD3G的表达组合,分析其对OS及RMST的影响。
结果显示:BCL11B表达与naive CD4+ T细胞、活化记忆CD4+ T细胞及CD8+ T细胞呈正相关(R>0,P<0.001),与Treg呈负相关(R=-0.17,P=0.017);BCL11B与CD3E、CD3G在GSE13159(R>0,P<0.01)及GSE114922(R>0,P<0.01)数据集中均呈正相关,且临床样本验证了这一相关性(R>0,P<0.05);联合分析显示,BCL11B^{low}CD3E^{low}CD3G^{low}组的4年OS率(25%)显著低于BCL11B^{high}CD3E^{high}CD3G^{high}组(84%,P=0.040),且RMST更短(Fig2)。对应的Fig2展示了上述关联,
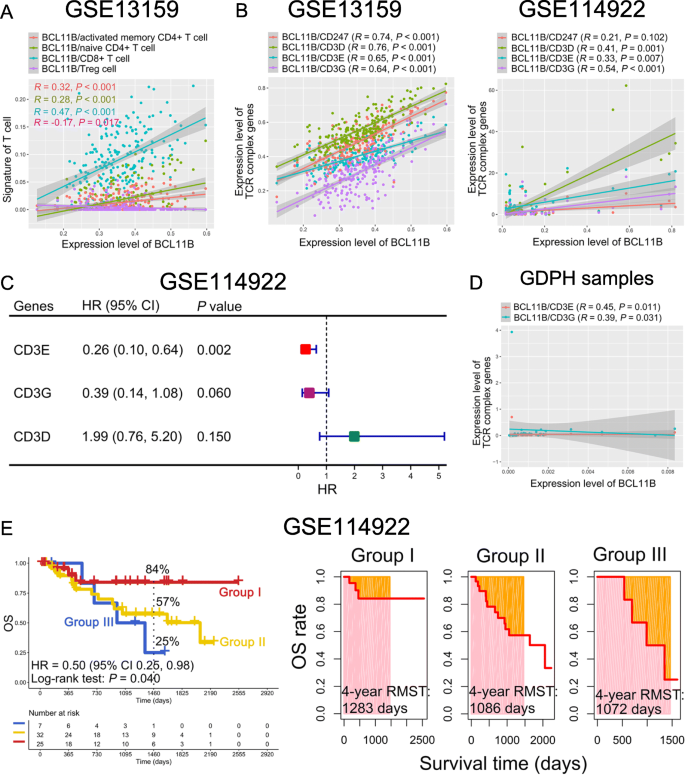
。
3. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本研究的核心生物标志物为骨髓样本中BCL11B的mRNA表达,其筛选与验证逻辑为“数据库初筛(GSE13159比较MDS与健康人表达差异)→临床样本验证(不同临床特征亚组的表达差异)→生存分析(评估预后价值)→机制关联(分析与T细胞亚群、TCR基因的关系)”,形成完整的生物标志物开发链条。
研究过程与数据
Biomarker来源为骨髓样本(GEO数据集的RNA-seq数据及临床中心的骨髓穿刺样本);验证方法包括RNA-seq(数据库)与定量实时PCR(临床样本);特异性与敏感性方面:低BCL11B表达组的5年OS率为27%(vs高表达组71%,P=0.094),联合CD3E、CD3G低表达时,4年OS率降至25%(P=0.040),提示其具有一定的预后区分能力。
核心成果
(1)临床关联:BCL11B低表达与MDS患者的不良临床特征直接相关——高/极高危、sAML、>60岁、男性患者的BCL11B表达显著更低;(2)预后价值:低BCL11B表达组的OS更短(5年OS率27% vs 71%)、RMST更短(1189天 vs 1437天),联合CD3E、CD3G低表达时,预后进一步恶化(4年OS率25%);(3)机制关联:BCL11B通过调控T细胞功能影响MDS预后——其表达与naive/活化记忆CD4+ T细胞、CD8+ T细胞呈正相关(提示效应T细胞功能正常),与Treg呈负相关(提示免疫抑制减轻),且与TCR复合物基因CD3E、CD3G呈正相关(提示TCR信号通路完整)。
本研究首次揭示了BCL11B作为MDS免疫相关预后生物标志物的价值,为MDS的预后分层提供了新的免疫指标,也为后续靶向T细胞功能的治疗(如CAR-T细胞疗法)提供了理论基础。
