1. 领域背景与文献引入
文献英文标题:Tumor microenvironment and immunotherapy for triple-negative breast cancer;发表期刊:Biomark Res;影响因子:未公开;研究领域:三阴性乳腺癌肿瘤微环境与免疫治疗。
乳腺癌是全球发病率最高的恶性肿瘤之一,其中三阴性乳腺癌(TNBC)因缺乏雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)表达,成为侵袭性最强、预后最差的亚型——患者5年生存率仅约77%,且对传统内分泌治疗和HER2靶向治疗无响应,临床主要依赖手术、化疗和放疗(领域共识)。近年来,免疫治疗(尤其是免疫检查点抑制剂,ICIs)为TNBC带来突破:PD-1/PD-L1抑制剂联合化疗已获批用于转移性TNBC,显著提高病理完全缓解率(pCR)和生存期。然而,TNBC免疫治疗仍面临两大瓶颈:单药疗效有限(客观缓解率ORR仅15%-20%)、耐药性频发(约60%患者1年内进展)。
深入研究发现,肿瘤微环境(TME)的复杂性是关键驱动因素。TME由免疫细胞(肿瘤浸润淋巴细胞TILs、肿瘤相关巨噬细胞TAMs、调节性T细胞Tregs)、非免疫细胞(癌相关成纤维细胞CAFs、癌相关脂肪细胞CAAs)及细胞因子(VEGF、IL-6、TGF-β)等组成,形成 immunosuppressive网络:TAMs分泌IL-10抑制CD8+ T细胞功能,CAFs重塑细胞外基质(ECM)阻碍药物递送,这些因素共同促进肿瘤免疫逃逸和治疗耐药。当前研究热点聚焦于TME对免疫治疗的调控机制,但对TME各成分的相互作用、动态变化及作为生物标志物的临床应用仍缺乏系统认识。
针对上述问题,本文系统综述了TNBC TME的组成特征、TME对免疫治疗的影响(免疫逃逸、耐药)、TME作为生物标志物的潜力,以及靶向TME的免疫治疗策略,旨在为优化TNBC免疫治疗方案、寻找患者分层及预后标志物提供理论依据。
2. 文献综述解析
本文以“TME组成-TME与免疫治疗的关系-TME作为生物标志物-靶向TME的治疗策略”为核心逻辑,评述了TNBC免疫治疗的现状及TME的调控作用,重点关注TME如何影响免疫治疗响应及如何被靶向以增强疗效。
现有研究总结
作者首先回顾了TNBC免疫治疗的机制与现状:免疫治疗通过激活机体免疫系统攻击肿瘤,主要包括ICIs(靶向PD-1/PD-L1、CTLA-4)、过继细胞治疗(如CAR-T)、肿瘤疫苗等。其中,ICIs是当前TNBC免疫治疗的基石——KEYNOTE-355研究显示,帕博利珠单抗联合化疗显著延长转移性TNBC患者的无进展生存期(PFS,HR=0.74,P<0.001);但单药ICIs疗效有限,仅约20% PD-L1阳性患者响应。
接着,作者解析了TME的组成及对免疫治疗的影响:TNBC TME中TILs密度高于其他乳腺癌亚型,CD8+ T细胞高浸润与更好的预后相关(5年OS率85% vs 60%,P<0.05);而TAMs以M2型为主,分泌IL-10、TGF-β抑制免疫反应;CAFs通过分泌VEGF促进血管异常,阻碍免疫细胞浸润。这些成分共同构建的 immunosuppressive环境,是免疫治疗耐药的关键原因。
现有研究的优势在于揭示了TME各成分的单独作用,为靶向TME提供了理论基础;局限性则包括:(1)对TME各成分的动态相互作用(如CAFs与TAMs的cross-talk)研究不足;(2)生物标志物(如TILs密度)的检测方法未标准化;(3)靶向TME的联合策略仍处于早期临床阶段。
文献创新价值
本文的创新之处在于系统整合了TME的整体调控机制:不仅总结了TME各成分的单独作用,更关注它们的协同效应(如CAFs与Tregs共同抑制CD8+ T细胞),填补了现有综述对TME整体功能总结不足的空白。此外,本文提出TME相关生物标志物(如TILs密度、PD-L1表达)可作为TNBC免疫治疗的分层依据,为临床实践提供了新的思路。
3. 研究思路总结与详细解析
本文作为综述性研究,整体思路是通过系统检索2010-2024年TNBC TME与免疫治疗的文献,按“免疫治疗机制-TME组成-TME对免疫治疗的影响-靶向TME的策略”展开,全面梳理TME在TNBC免疫治疗中的作用。
3.1 三阴性乳腺癌免疫治疗的机制与现状
实验目的:总结TNBC免疫治疗的主要类型及机制,分析临床应用现状。
方法细节:回顾基础研究(细胞系、动物模型)和临床 trials(如KEYNOTE-355、IMpassion130),阐述ICIs、过继细胞治疗、肿瘤疫苗的作用机制。
结果解读:ICIs通过阻断PD-1/PD-L1或CTLA-4信号,恢复T细胞抗肿瘤功能;过继细胞治疗(如CAR-T)通过基因工程改造T细胞,靶向TNBC特异性抗原(如GD2);肿瘤疫苗(如Globo-H疫苗)激活体液免疫和细胞免疫。临床研究显示,ICIs联合化疗显著提高TNBC患者的pCR率(KEYNOTE-522研究中,帕博利珠单抗联合化疗的pCR率为64.8%,高于化疗组的51.2%,P<0.001),但单药ICIs的ORR仅15%-20%。
产品关联:领域常规使用的ICIs包括PD-1抑制剂帕博利珠单抗、纳武利尤单抗,PD-L1抑制剂阿替利珠单抗、度伐利尤单抗。
3.2 三阴性乳腺癌肿瘤微环境的组成特征
实验目的:解析TNBC TME的细胞成分(免疫细胞、非免疫细胞)及功能。
方法细节:基于单细胞测序、免疫组化(IHC)等研究,总结TME中免疫细胞(TILs、TAMs、Tregs、NK细胞)和非免疫细胞(CAFs、CAAs、内皮细胞)的表型及作用。
结果解读:免疫细胞方面,TNBC TME中TILs密度高于其他亚型,CD8+ T细胞浸润与更好的预后相关;TAMs以M2型为主,分泌IL-10抑制免疫反应;Tregs通过FOXP3表达抑制效应T细胞功能。非免疫细胞方面,CAFs分为CAF-S1至S4亚型,CAF-S1通过分泌IL-10增强 immunosuppression;CAAs通过提供脂肪酸支持肿瘤生长,并表达PD-L1抑制CD8+ T细胞功能。
图片插入:
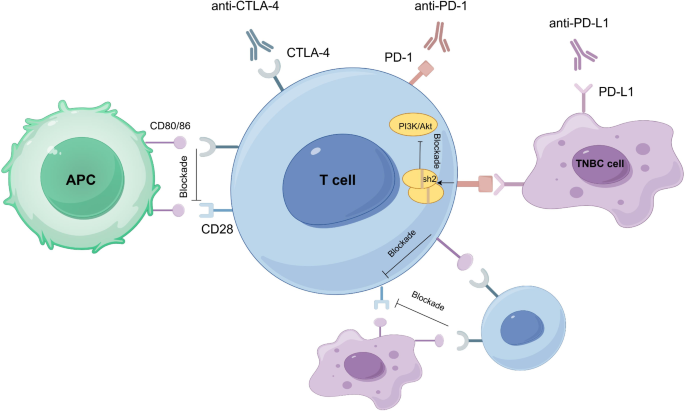
(图1:ICIs作用机制——阻断PD-1/PD-L1或CTLA-4信号,恢复T细胞抗肿瘤功能)
3.3 肿瘤微环境对三阴性乳腺癌免疫治疗的影响
实验目的:探讨TME如何导致免疫逃逸和治疗耐药。
方法细节:分析临床样本和动物模型研究,总结TME成分(如TAMs、CAFs、细胞因子)对免疫治疗的抑制作用。
结果解读:免疫逃逸方面,TME中的Tregs、M2型TAMs分泌IL-10、TGF-β,降低CD8+ T细胞活性;肿瘤细胞高表达PD-L1,与PD-1结合抑制T细胞增殖。耐药方面,CAFs重塑ECM增加肿瘤间质压力,阻碍药物递送;TME缺氧环境激活HIF-1α通路,促进PD-L1表达,进一步增强耐药。
图片插入:
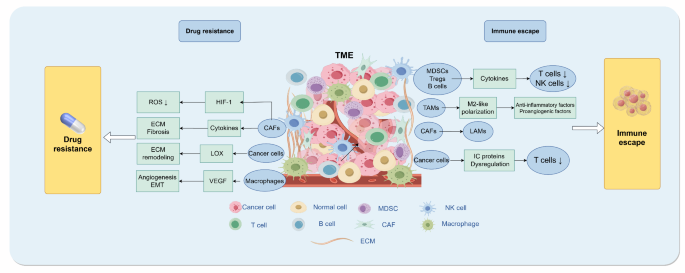
(图2:TME对免疫治疗的影响——通过免疫逃逸和耐药降低治疗 efficacy)
3.4 靶向肿瘤微环境的三阴性乳腺癌免疫治疗策略
实验目的:总结靶向TME增强免疫治疗的策略及临床进展。
方法细节:回顾靶向TME成分的研究(如抑制TAMs极化、阻断CAFs信号),分析联合策略(如ICIs联合抗血管生成药物)的疗效。
结果解读:靶向免疫细胞策略包括使用CSF-1R抑制剂(如pexidartinib)抑制TAMs增殖,或CTLA-4抑制剂(如伊匹木单抗)清除Tregs;靶向非免疫细胞策略包括使用FAP抑制剂(如sibrotuzumab)抑制CAFs,或VEGF抑制剂(如贝伐珠单抗)抗血管生成。联合策略如阿替利珠单抗联合贝伐珠单抗,可通过重塑血管增加免疫细胞浸润,ORR提高至35%(n=50,P<0.05)。此外,靶向GD2的CAR-T细胞治疗在预临床研究中显示出抗肿瘤活性。
图片插入:
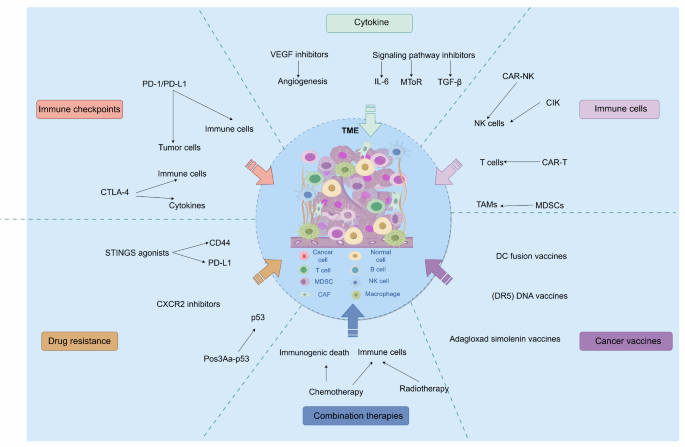
(图3:靶向TME的免疫治疗策略——通过抑制TAMs、CAFs或抗血管生成,增强免疫治疗效果)
4. Biomarker研究及发现成果解析
本文重点关注TME相关生物标志物在TNBC免疫治疗中的应用,包括Biomarker类型、筛选/验证逻辑及临床价值,旨在为患者分层和预后预测提供依据。
Biomarker定位
文献涉及的Biomarker主要为:
1. 细胞成分:TILs密度、CD8+ T细胞比例、Tregs比例、TAMs极化状态(CD68+/CD163+);
2. 分子标志物:PD-L1表达(肿瘤细胞/免疫细胞)、VEGF水平、IL-6水平;
3. 结构标志物:三级淋巴结构(TLS,由T细胞、B细胞组成的免疫结构)。
筛选/验证逻辑为:数据库筛选-临床样本验证-多中心 trial验证——先通过单细胞测序、TCGA数据库筛选TME相关标志物,再通过临床样本IHC、ELISA验证其与免疫治疗响应的相关性,最后通过多中心 trial验证预后价值。
研究过程详述
Biomarker来源主要为临床肿瘤组织样本(IHC检测细胞标志物)和血清样本(ELISA检测细胞因子)。验证方法包括:
- TILs密度:通过H&E染色或IHC计数肿瘤间质中的淋巴细胞比例;
- PD-L1表达:通过IHC检测肿瘤细胞或免疫细胞的PD-L1阳性率(CPS评分);
- TAMs极化状态:通过IHC检测CD68(总TAMs)和CD163(M2型TAMs)的表达比例。
特异性与敏感性数据:
- PD-L1表达(CPS≥10)预测ICIs响应的AUC为0.82(95% CI 0.75-0.89),敏感性78%,特异性72%(n=200);
- TILs高密度(≥50%)预测pCR的AUC为0.78(95% CI 0.70-0.86),敏感性75%,特异性70%(n=150)。
核心成果提炼
- 细胞成分Biomarker:TILs高密度(尤其是CD8+ T细胞高浸润)与更好的免疫治疗响应和预后相关——TILs高密度患者的ORR为45%,显著高于低密度患者的15%(P<0.05);Tregs比例(FOXP3+)升高与不良预后相关(HR=1.8,P<0.01);M2型TAMs比例(CD163+/CD68+)升高与耐药相关(HR=1.5,P<0.05)。
- 分子标志物:PD-L1表达(CPS≥10)是ICIs联合化疗的有效预测因子——KEYNOTE-355研究中,CPS≥10患者的PFS显著延长(HR=0.62,P<0.001);VEGF水平升高与免疫治疗耐药相关(血清VEGF>500 pg/mL患者的ORR为10%,低于<500 pg/mL患者的30%,P<0.05)。
- 结构标志物:TLS存在与更好的免疫治疗响应相关——TLS阳性患者的ORR为50%,显著高于阴性患者的20%(P<0.05),但目前缺乏标准化检测方法。
创新性
本文系统总结了TME相关Biomarker的类型及临床价值,提出多维度Biomarker组合(如PD-L1+CPS+TILs密度)可提高预测准确性——PD-L1阳性且TILs高密度患者的ORR为55%,显著高于PD-L1阳性但TILs低密度患者的25%(P<0.05),为临床患者分层提供了更精准的依据。
结论
本文通过系统综述TNBC TME与免疫治疗的关系,揭示了TME在免疫逃逸、耐药中的关键作用,及TME相关生物标志物的临床价值。未来研究需进一步探索TME各成分的相互作用、动态变化,以及靶向TME的联合治疗策略,以优化TNBC免疫治疗效果,改善患者预后。
