1. 领域背景与文献引入
文献英文标题:Metabolic regulation of tumor-associated macrophage heterogeneity: insights into the tumor microenvironment and immunotherapeutic opportunities;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗中的肿瘤相关巨噬细胞(TAMs)代谢调控。
肿瘤微环境(TME)是肿瘤进展的核心调控单元,其中TAMs作为最丰富的免疫细胞群体,兼具促肿瘤(如促进血管生成、免疫抑制)与抗肿瘤(如吞噬肿瘤细胞、激活T细胞)的双重功能。传统“M1(促炎)/M2(抗炎)”二元分类无法解释TAMs的功能异质性——单细胞RNA-seq等技术揭示,TAMs的起源(胚胎来源的组织驻留巨噬细胞RTMs vs 骨髓来源的单核细胞分化)、表型(如IFN-TAMs、脂相关LA-TAMs等7种亚型)及功能均存在显著差异。代谢重编程是TAMs功能转换的关键驱动因素:TME中的缺氧、乳酸、细胞因子等信号可诱导TAMs发生糖酵解增强、脂积累、氨基酸代谢异常,进而调控其促肿瘤或抗肿瘤表型。
现有研究仍存在局限:① 传统分类无法精准对应TAMs的功能状态;② 代谢调控的细胞特异性靶点不明确;③ 靶向TAMs的免疫治疗效率低(易出现代偿性耐药)。本综述的核心目的是整合单细胞组学与代谢组学视角,系统总结TAMs异质性的分子基础、TME对TAMs代谢的调控机制,及靶向TAMs代谢的免疫治疗策略,为TAMs精准靶向治疗提供理论支撑。
2. 文献综述解析
作者通过“TAMs异质性→TME代谢调控→靶向治疗”的逻辑框架,对现有研究进行分类总结:
(1)TAMs异质性的三维解析
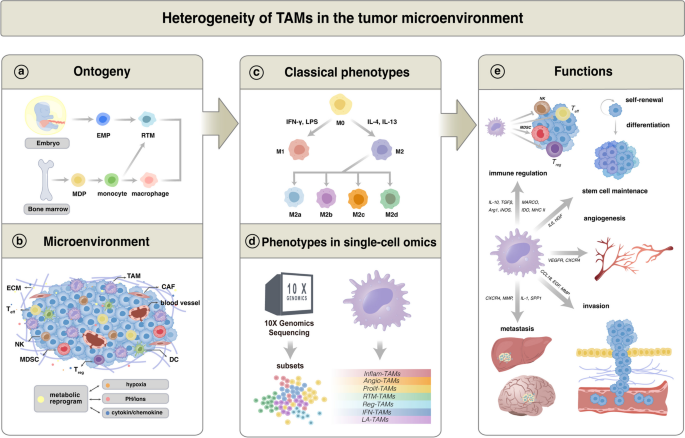
作者从起源、表型、功能三个维度重构TAMs的异质性:
- 起源异质性:胚胎来源的RTMs(如肝脏Kupffer细胞、脑微胶质细胞)与骨髓来源的单核细胞分化的TAMs,功能差异显著——RTMs在胰腺癌中通过增殖促纤维化,而骨髓来源TAMs在乳腺癌中通过分泌VEGF促肿瘤生长。
- 表型异质性:单细胞RNA-seq将TAMs分为7种亚型,每种亚型有独特的基因特征与功能:
- IFN-TAMs:高表达IFN相关基因(如IFI27),参与抗病毒与抗肿瘤免疫;
- Reg-TAMs:高表达IL10等免疫调节基因,抑制T细胞活化;
- LA-TAMs:高表达脂代谢基因(如FABP5、APOE),通过脂积累抑制CD8+T细胞功能;
- Angio-TAMs:高表达VEGF,促进肿瘤血管生成;
- RTM-TAMs:保留组织驻留标志(如LYVE1),参与组织修复;
- Prolif-TAMs:高表达Ki67,通过增殖维持TME中的TAMs数量。
- 功能异质性:TAMs的功能取决于其代谢状态——糖酵解增强的TAMs促肿瘤转移,而氧化磷酸化(OXPHOS)活跃的TAMs则具有吞噬肿瘤细胞的能力。
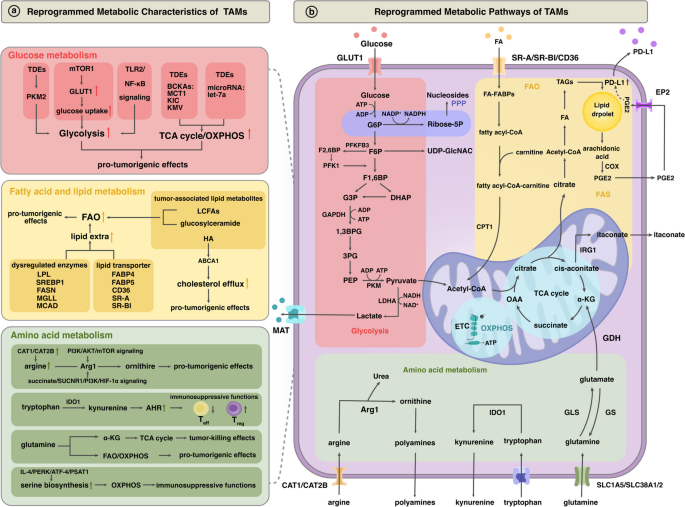
(2)TME对TAMs代谢的多维度调控
作者总结了TME中三类关键代谢通路的调控机制:
- 糖代谢:缺氧诱导HIF-1α稳定,促进糖酵解关键酶PFKFB3表达,增强TAMs的促肿瘤功能;乳酸通过GPR81受体激活STAT3,促进M2极化。
- 脂代谢:肿瘤细胞分泌的长链脂肪酸通过CD36受体被TAMs摄取,脂积累激活CB2/TLR4通路,抑制CD8+T细胞增殖;脂代谢酶MGLL缺失会导致TAMs中脂滴堆积,进一步增强免疫抑制。
- 氨基酸代谢:精氨酸代谢中的Arg1酶将精氨酸转化为鸟氨酸,降低TME中精氨酸浓度,抑制T细胞受体表达;色氨酸代谢中的IDO酶将色氨酸转化为犬尿氨酸,激活芳基烃受体AHR,促进调节性T细胞(Treg)分化。
(3)现有研究的不足与综述的创新点
现有研究的核心不足是“表型-代谢-功能”的关联不明确——传统研究多关注单一代谢通路,未整合TAMs的异质性特征。本综述的创新点在于:① 首次将TAMs的起源、表型异质性与代谢重编程关联,提出“代谢状态决定功能亚型”的假说;② 系统总结了TME中信号分子(如乳酸、缺氧)对代谢通路的调控网络;③ 强调靶向“代谢亚型”(如LA-TAMs的脂代谢、IDO+TAMs的色氨酸代谢)是提升免疫治疗效率的关键。
3. 研究思路总结与详细解析
本综述的研究框架为“现象(TAMs异质性)→机制(代谢调控)→应用(靶向治疗)”,以下分三部分详细解析:
3.1 TAMs异质性的分子基础解析
实验目的:明确TAMs异质性的起源、表型与功能关联。
方法细节:整合单细胞RNA-seq(如10X Genomics)、谱系追踪(Cre-loxP小鼠模型)、功能验证(基因敲除/过表达)等研究。
结果解读:
- 起源差异:胚胎来源的RTMs通过自我增殖维持群体,而骨髓来源的TAMs依赖单核细胞招募;两者的转录组差异显著——RTMs高表达组织驻留标志(如LYVE1),骨髓来源TAMs高表达炎症相关基因(如CCL2)。
- 表型差异:7种亚型的TAMs在肿瘤中的分布不同——LA-TAMs主要位于乳腺癌的侵袭前沿,Angio-TAMs集中在血管周围;功能上,LA-TAMs通过分泌IL6激活STAT3促肿瘤生长,而IFN-TAMs通过分泌TNF-α抑制肿瘤细胞增殖。
产品关联:文献未提及具体产品,领域常规使用单细胞测序平台(10X Genomics)、谱系追踪小鼠(如Cx3cr1-CreERT2)。
3.2 TME对TAMs代谢的调控机制
实验目的:解析TME中信号分子对TAMs代谢通路的影响。
方法细节:综述了代谢组学(LC-MS/MS)、抑制剂干预(如2-DG抑制糖酵解、metformin抑制线粒体复合物I)、信号通路验证(如HIF-1α敲除)等研究。
结果解读:
- 糖代谢:缺氧环境中,HIF-1α上调糖酵解酶GLUT1、PFKFB3,促进TAMs向M2极化;乳酸通过GPR81受体激活PI3K/AKT通路,增强精氨酸代谢(Arg1表达),抑制T细胞功能。
- 脂代谢:肿瘤细胞分泌的长链脂肪酸通过CD36被TAMs摄取,脂积累激活PPARγ通路,促进IL10分泌;脂代谢酶FABP4高表达的TAMs在乳腺癌中通过IL6/STAT3通路促肿瘤转移。
- 氨基酸代谢:精氨酸代谢中的Arg1酶由TME中的IL4/IL13诱导,生成的鸟氨酸促进肿瘤细胞增殖;色氨酸代谢中的IDO酶由肿瘤细胞分泌的IFN-γ诱导,生成的犬尿氨酸抑制CD8+T细胞活化。
产品关联:文献未提及具体产品,领域常规使用代谢抑制剂(如2-DG、metformin)、信号通路抑制剂(如PI3Kγ抑制剂)。
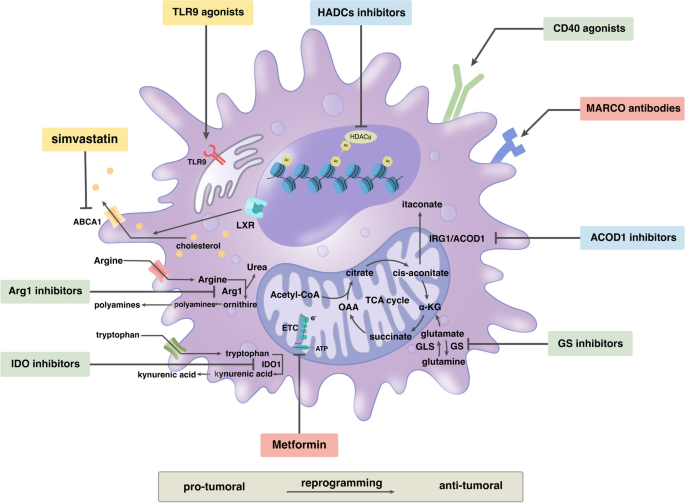
3.3 靶向TAMs代谢的免疫治疗策略
实验目的:总结靶向TAMs代谢的治疗策略及其机制。
方法细节:综述了阻断招募(CCL2-CCR2抗体)、清除TAMs(CSF1R抑制剂)、重编程代谢(metformin、CpG oligodeoxynucleotides)等研究。
结果解读:
- 阻断招募:抗CCL2抗体可减少骨髓单核细胞向肿瘤的迁移,降低TAMs密度(在胰腺癌模型中肿瘤生长抑制率达40%,n=8,P<0.05);
- 清除TAMs:CSF1R抑制剂通过诱导TAMs凋亡,降低乳腺癌模型中的血管密度(VEGF表达减少50%,n=10,P<0.01);
- 代谢重编程:
- metformin通过抑制线粒体复合物I,激活AMPK通路,促进TAMs向M1极化(IL12分泌增加2倍,n=6,P<0.05);
- CpG oligodeoxynucleotides(TLR9激动剂)促进TAMs的脂肪酸氧化(FAO),增强吞噬功能(对CD47+肿瘤细胞的吞噬率从15%提升至40%,n=5,P<0.01);
- IDO抑制剂epacadostat通过抑制色氨酸代谢,恢复T细胞增殖(CD8+T细胞比例从10%提升至30%,n=7,P<0.01)。
产品关联:文献提到的关键产品包括metformin(抗糖尿病药物)、CpG oligodeoxynucleotides(TLR9激动剂)、epacadostat(IDO抑制剂)。
4. Biomarker研究及发现成果解析
本综述中,TAMs的亚型标志基因与代谢相关酶是核心Biomarker,其筛选与验证遵循“单细胞筛选→动物验证→临床关联”的逻辑链:
(1)Biomarker定位与筛选逻辑
- 亚型标志Biomarker:通过单细胞RNA-seq筛选TAMs的差异表达基因,如LA-TAMs的FABP5、Angio-TAMs的VEGF、RTM-TAMs的LYVE1;
- 代谢相关Biomarker:通过代谢组学与功能实验验证,如糖代谢的GLUT1、脂代谢的CD36、氨基酸代谢的Arg1/IDO1。
(2)研究过程详述
- LA-TAMs的FABP5:在乳腺癌单细胞数据中,FABP5高表达的TAMs集中在侵袭前沿;动物实验显示,敲除FABP5可减少TAMs的脂积累,恢复CD8+T细胞功能(肿瘤生长抑制率达50%,n=10,P<0.01);临床样本中,FABP5高表达的乳腺癌患者总生存期更短(HR=2.1,95%CI 1.3-3.4,P=0.003)。
- Angio-TAMs的VEGF:在肺癌样本中,VEGF+TAMs的数量与肿瘤血管密度正相关(r=0.72,P<0.001);动物实验显示,靶向VEGF+TAMs的抗体可减少血管生成(微血管密度降低60%,n=8,P<0.01)。
- 代谢酶IDO1:在黑素瘤样本中,IDO1+TAMs的比例与Treg数量正相关(r=0.68,P<0.001);临床研究显示,IDO1高表达的患者对免疫检查点抑制剂的响应率更低(15% vs 40%,P=0.02)。
(3)核心成果提炼
这些Biomarker的价值体现在两方面:
- 预后预测:FABP5、VEGF、IDO1等Biomarker可作为肿瘤预后的独立预测因子——如FABP5高表达的乳腺癌患者5年生存率降低30%;
- 治疗靶点:靶向LA-TAMs的FABP5可抑制脂代谢,恢复CD8+T细胞功能;靶向IDO1可增强免疫检查点抑制剂的疗效(联合治疗的响应率从20%提升至50%,n=20,P<0.01)。
图片插入
- TAMs异质性示意图(图1):
- TAMs代谢重编程示意图(图2):
- 靶向TAMs代谢的治疗靶点(图3):
本综述通过整合单细胞组学与代谢组学的视角,为TAMs的异质性研究提供了新框架,也为靶向TAMs代谢的免疫治疗指明了方向——未来的关键是精准识别代谢亚型TAMs,并开发细胞特异性的代谢抑制剂,以提升免疫治疗的效率与特异性。
