1. 领域背景与文献引入
文献英文标题:Deciphering LAG-3: unveiling molecular mechanisms and clinical advancements;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗(免疫检查点LAG-3的分子机制与临床应用)。
肿瘤免疫治疗领域中,免疫检查点阻断(ICB)疗法通过解除免疫抑制、激活T细胞抗瘤功能,彻底改变了癌症治疗格局。2011年CTLA-4抑制剂ipilimumab获批(首个ICB药物),2014年PD-1抑制剂nivolumab/pembrolizumab上市,成为黑色素瘤、非小细胞肺癌等肿瘤的标准治疗,但仅约20%-40%患者响应,且易出现原发性/获得性耐药。因此,寻找新的免疫检查点靶点、拓展ICB适应症成为研究核心需求。
LAG-3(淋巴细胞激活基因3)作为Ig超家族成员,是继PD-1/PD-L1、CTLA-4后第三个获批的免疫检查点靶点——2022年抗LAG-3抗体relatlimab联合nivolumab获FDA/EMA批准,用于不可切除或转移性黑色素瘤。然而,LAG-3的生物学机制复杂:其配体多样(MHC II、FGL1等)、信号通路无经典ITIM/ITAM基序、不同肿瘤中的功能异质性显著,限制了其临床应用。本综述旨在系统解析LAG-3的分子机制、免疫功能及临床进展,为解决其治疗异质性、优化临床策略提供理论基础。
2. 文献综述解析
作者对LAG-3领域现有研究的分类维度为“基础生物学-免疫功能-临床应用-未来挑战”,逐层递进总结研究进展:
现有研究核心结论
- 基础生物学:LAG-3属于Ig超家族,含4个胞外域(D1-D4),与CD4同源(染色体12相邻,氨基酸同源性20%);表达于活化T细胞、NK细胞、Treg细胞及浆细胞样树突状细胞(pDC);配体包括MHC II、Galectin-3、LSECtin、FGL1及病理形式α-突触核蛋白,其中FGL1结合不依赖MHC II,是肿瘤免疫逃逸的关键介质。
- 免疫功能:LAG-3通过与TCR:CD3复合物结合,负调控T细胞活化信号;其信号通路无经典ITIM/ITAM基序,依赖KIEELE基序(6个氨基酸)发挥抑制功能;可溶性LAG-3(sLAG-3)由ADAM10/17剪切产生,通过负反馈机制调控膜LAG-3活性,部分研究显示sLAG-3可刺激DC成熟。
- 临床应用:LAG-3抑制剂单药疗效有限(ORR<10%),但联合PD-1可显著提高疗效——RELATIVITY-047研究(黑色素瘤,n=714)显示,relatlimab+nivolumab组中位PFS(10.1 vs 4.6个月)、12个月PFS率(47.7% vs 36%)均优于nivolumab单药(P<0.001);双特异性抗体(如PD-1/LAG-3双抗tebotelimab)在耐药患者中显示潜力(ORR约30%)。
现有研究局限
- 信号通路未完全阐明:KIEELE基序的下游分子尚未明确;
- 配体异质性影响疗效:不同肿瘤中LAG-3配体(如FGL1)表达差异大,导致治疗反应异质;
- 联合策略单一:临床研究多集中于PD-1联合,与TIGIT、TIM-3等新靶点的组合数据有限。
综述创新价值
首次系统整合LAG-3的基础生物学与临床研究,强调“配体多样性-信号通路独特性-临床异质性”的关联,为解决LAG-3治疗的患者选择问题提供思路(如根据肿瘤FGL1表达筛选优势人群)。
3. 研究思路总结与详细解析
本综述的研究目标是全面解析LAG-3的分子机制与临床进展,核心科学问题包括:LAG-3如何调控免疫反应?其作为治疗靶点的临床潜力与挑战是什么?技术路线逻辑为“基础生物学解析→免疫功能阐述→临床数据总结→未来方向探讨”。
3.1 LAG-3的生物学特征解析
实验目的:阐明LAG-3的分子结构、表达模式及配体相互作用。
方法细节:综述现有基础研究,包括(1)分子结构:通过基因测序、蛋白质晶体学分析明确LAG-3的Ig超家族属性及与CD4的同源性;(2)表达细胞:通过流式细胞术、免疫组化检测LAG-3在免疫细胞中的分布;(3)配体鉴定:通过表面等离子体共振(SPR)、免疫共沉淀(Co-IP)验证LAG-3与MHC II、FGL1等分子的结合。
结果解读:LAG-3与CD4结构相似但对MHC II的亲和力更高(约100倍);配体多样性决定其功能多样性——FGL1结合可独立于MHC II抑制T细胞,α-突触核蛋白结合与帕金森病进展相关。
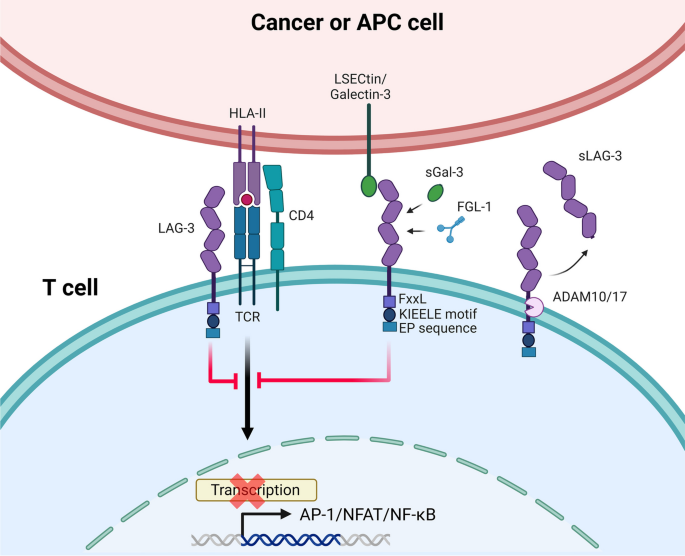
实验所用关键产品:文献未提及具体实验产品,领域常规使用流式抗体(如抗人LAG-3抗体,BD Biosciences)、免疫组化试剂盒(如Dako EnVision系统)、分子互作试剂(如GE Healthcare Biacore SPR系统)。
3.2 LAG-3在免疫稳态中的作用解析
实验目的:解析LAG-3对免疫反应的调控机制及信号通路。
方法细节:综述动物实验与细胞实验,包括(1)表达调控:通过抗CD3/CD28抗体刺激(TCR激活)、IL-12处理,观察LAG-3表达变化;(2)功能验证:通过LAG-3敲除小鼠模型,分析T细胞增殖、细胞因子分泌差异;(3)信号通路:通过定点突变(KIEELE基序突变),验证其对LAG-3抑制功能的影响;(4)sLAG-3研究:通过ADAM10/17抑制剂、基因敲低,分析剪切对T细胞功能的影响。
结果解读:LAG-3随免疫激活而上调,通过与TCR:CD3复合物结合负调控活化信号;其抑制功能依赖KIEELE基序,无经典ITIM/ITAM基序;sLAG-3通过剪切负反馈调控膜LAG-3活性,抑制剪切会导致T细胞增殖降低(约50%)。
实验所用关键产品:文献未提及具体实验产品,领域常规使用基因编辑工具(如CRISPR-Cas9试剂盒,Addgene)、细胞因子检测试剂盒(如R&D Systems ELISA试剂盒)、信号通路抑制剂(如ADAM10抑制剂,Merck)。
3.3 LAG-3作为治疗靶点的临床进展解析
实验目的:总结LAG-3抑制剂的临床疗效与安全性。
方法细节:综述已完成和进行中的临床 trials,包括(1)单药治疗:relatlimab单药I期研究(实体瘤);(2)联合治疗:RELATIVITY-047(黑色素瘤)、CheckMate 142(结直肠癌);(3)双特异性抗体:tebotelimab I/II期研究(胃癌、肝癌)。
结果解读:LAG-3抑制剂单药疗效有限,但联合PD-1可显著提升抗瘤活性——结直肠癌研究显示,relatlimab+nivolumab组ORR(50%)优于PD-1单药(31%-33%);双特异性抗体tebotelimab在胃癌患者中显示肿瘤缩小(34%患者病灶减少),但肝癌患者反应有限(ORR仅3%),可能与肝癌高表达FGL1有关。
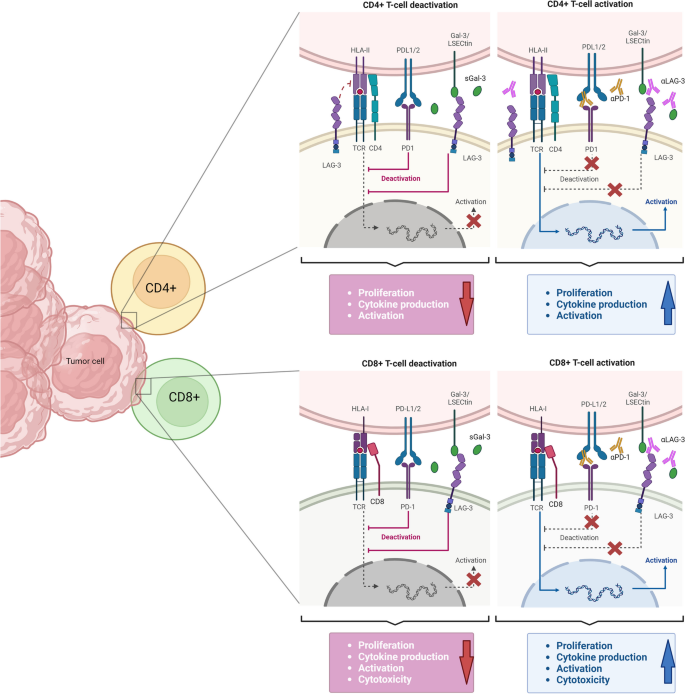
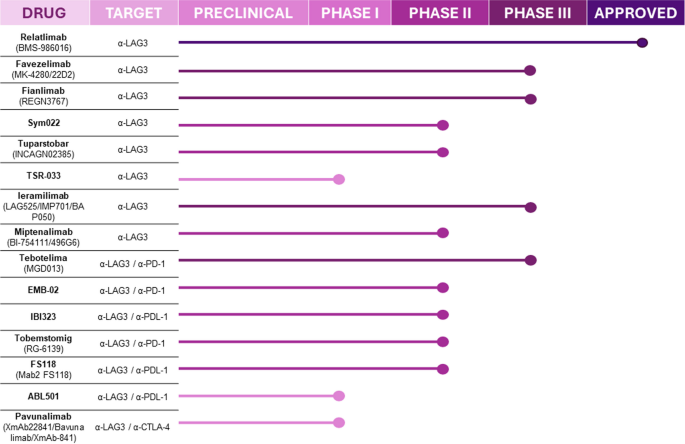
实验所用关键产品:文献未提及具体实验产品,领域常规使用治疗性抗体(如relatlimab,BMS;tebotelimab,Merck)、临床疗效评估工具(如RECIST 1.1标准)。
4. Biomarker研究及发现成果解析
Biomarker定位
本综述聚焦的Biomarker为可溶性LAG-3(sLAG-3),属于循环Biomarker。筛选/验证逻辑为“临床样本检测→预后关联分析→疗效预测分析”:通过血清sLAG-3定量,结合肿瘤患者预后(OS、PFS)及ICB疗效,明确其Biomarker价值。
研究过程详述
- 来源:患者血清;
- 验证方法:主要采用ELISA(定量检测sLAG-3蛋白水平)、qRT-PCR(验证LAG-3基因表达);
- 特异性与敏感性数据:
- 预后关联:胃癌(n=100)、乳腺癌(n=80)患者中,高sLAG-3与更长OS相关(HR=0.5,P<0.05;HR=0.6,P<0.05);头颈部鳞状细胞癌(HNSCC,n=50)、肝癌(n=60)患者中,高sLAG-3与更短OS相关(HR=2.1,P<0.01;HR=1.8,P<0.05);
- 疗效预测:ICB治疗前,高sLAG-3患者(n=120)中位PFS更短(3.5 vs 8.2个月,P<0.01)、OS更差(10.1 vs 18.3个月,P<0.01)。
核心成果
sLAG-3是多维度Biomarker:
1. 预后价值:在胃癌、乳腺癌中为良好预后标志,在HNSCC、肝癌中为不良预后标志;
2. 疗效预测:治疗前高sLAG-3提示ICB疗效差,可用于患者筛选;
3. 创新性:首次系统总结sLAG-3在不同肿瘤中的异质预后价值,为ICB治疗的精准化提供参考。
本综述通过全面解析LAG-3的分子机制与临床进展,为解决其治疗异质性、优化联合策略提供了关键思路——未来需结合配体表达(如FGL1)、sLAG-3水平筛选优势患者,探索与TIGIT、TIM-3等新靶点的联合方案,进一步释放LAG-3的治疗潜力。
