1. 领域背景与文献引入
文献英文标题:DNA methylation: potential biomarker in Hepatocellular Carcinoma;发表期刊:Biomark Res;影响因子:未公开;研究领域:肝细胞癌(HCC)表观遗传学与生物标志物。
肝细胞癌是全球发病率第六、死亡率第三的恶性肿瘤,每年约60万人死于该病。其高 mortality主要源于诊断滞后——超过50%的患者确诊时已处于晚期,无法接受肝移植或手术切除等根治性治疗。目前临床诊断依赖血清甲胎蛋白(AFP)检测与影像学检查,但AFP的特异性(约70%)和敏感性(约60%)有限,影像学检查(如CT、MRI)存在成本高、侵入性的缺陷。此外,除AFP和巴塞罗那临床肝癌(BCLC)分期外,缺乏有效的预后标志物预测患者生存结局。随着表观遗传学研究的兴起,DNA甲基化作为一种可逆的表观遗传修饰,被发现与HCC的发生、发展密切相关:肿瘤抑制基因(如p16)的高甲基化可导致基因沉默,全局低甲基化(如LINE-1)可诱发基因组不稳定。然而,HCC中DNA甲基化的系统研究仍未整合,缺乏统一的甲基化生物标志物标准。本文旨在综述HCC中DNA甲基化作为生物标志物的研究进展,为临床转化提供理论基础。
2. 文献综述解析
核心信息段:作者围绕HCC的DNA甲基化异常特征、基因组甲基化谱研究、甲基化与预后的关联及血液甲基化标志物四个维度,系统评述了现有研究的进展与不足。现有研究证实HCC中存在“全局低甲基化+位点特异性高甲基化”的异常模式,p16、SOCS1等基因的甲基化与病毒感染、肿瘤分期相关,但单一基因的预后价值有限;基因组-wide研究(如Illumina 450K芯片)鉴定出大量差异甲基化基因,但方法学差异导致结果异质性;血液中的甲基化标志物(如RASSF1A)具有非侵入性优势,但多为回顾性研究,缺乏标准化验证。本文的创新在于系统整合了甲基化生物标志物的研究框架,强调了CpG岛甲基化表型(CIMP)的潜在价值,为后续研究提供了统一方向。
作者首先总结了HCC甲基化异常的生物学意义:全局低甲基化通过破坏核小体结构促进染色体不稳定性,位点高甲基化通过沉默肿瘤抑制基因(如p16调控细胞周期、SOCS1抑制JAK/STAT通路)驱动 carcinogenesis。HBV/HCV感染是甲基化异常的关键诱因——HBV的X蛋白(HBx)可上调DNA甲基转移酶(DNMT)表达,诱导p16等基因甲基化;HCV核心蛋白通过激活DNMT1/3b沉默E-钙黏蛋白(CDH1)。
接着,作者评述了基因组甲基化谱研究的方法学:早期方法(如甲基化CpG岛扩增微阵列(MCAM)、甲基化DNA免疫沉淀芯片(MeDIP-chip))具有高通量优势,但无法达到单核苷酸分辨率;Illumina Human Methylation 450K BeadChip等新技术的应用,实现了全基因组48.5万个CpG位点的甲基化检测(如Song等的研究),但不同方法的基因重叠率仅约30%,结果异质性大。
在甲基化与预后的关联方面,作者指出:单一基因的甲基化预后价值有限(如CDH1甲基化仅与部分患者的生存期相关),而CIMP(多个基因的联合甲基化)具有更高的预测价值——例如Wei等定义“≥5个基因甲基化”为CIMP+,发现其与AFP升高(OR=2.5,P<0.05)、肿瘤转移(OR=3.1,P<0.01)显著相关,预测复发的AUC=0.81,优于单一基因。
在血液甲基化标志物方面,作者总结了p16、RASSF1A、LINE-1的研究:Wong等用定量甲基化特异性PCR(QMSP)检测到77%的HCC患者血清中p16甲基化(n=29);Chan等发现RASSF1A甲基化患者的无病生存期缩短(HR=3.2,P<0.01,n=85);Tangkijvanich等用联合亚硫酸氢盐限制分析(COBRA)发现LINE-1低甲基化与HBV感染、肿瘤大相关(P<0.05,n=85)。这些研究证实血液甲基化标志物的非侵入性优势,但存在“样本量小、缺乏前瞻性验证”的不足。
3. 研究思路总结与详细解析
核心信息段:作为综述性研究,作者的思路是系统检索2003-2013年的HCC甲基化研究,整合“甲基化异常→基因组谱→预后关联→血液标志物”的证据链,提炼共性结论并指出研究缺口。以下按关键环节解析:
3.1 甲基化异常与HCC发生的关联分析
实验目的:明确HCC中甲基化异常的类型及诱因。
方法细节:回顾现有研究中采用甲基化特异性PCR(MSP)、焦磷酸测序等方法,对比HCC组织、癌旁组织及正常组织的甲基化水平,分析HBV/HCV感染、酒精摄入等因素的影响。
结果解读:HCC中普遍存在“全局低甲基化(如LINE-1,甲基化率下降20%~30%)+位点高甲基化(如p16,肿瘤组织甲基化率60% vs 正常组织10%)”的模式;HBV阳性样本的p16甲基化率(60%,n=51)显著高于阴性样本(30%,n=29),提示病毒感染是甲基化异常的驱动因素。
实验所用关键产品:领域常规使用MSP引物(如针对p16的上游引物5’-TTATTAGAGGGTGGGGCGGATCGC-3’)、焦磷酸测序试剂(如Biotage PyroMark Q24)。
3.2 基因组-wide甲基化谱研究
实验目的:鉴定HCC中的差异甲基化基因。
方法细节:回顾现有研究中采用MCAM、MeDIP-chip、Illumina 450K芯片等高通量方法,比较肿瘤与正常组织的甲基化谱,并用焦磷酸测序验证。
结果解读:Gao等用MCAM鉴定出719个差异甲基化基因,其中RASSF1A(肿瘤甲基化率80%)、p16(70%)等基因在肿瘤中高甲基化;Lu等用差异甲基化杂交(DMH)发现KLK10(HCV阳性样本甲基化率75%)、OXGR1(60%)与病毒感染相关;Song等用Illumina 450K芯片实现单核苷酸分辨率检测,鉴定出XPO4(外周血甲基化率50%)等潜在标志物,但不同方法的基因重叠率仅约20%。
实验所用关键产品:领域常规使用Illumina Human Methylation 450K BeadChip、Agilent Human CpG Island Microarray。
3.3 甲基化与HCC预后的关联分析
实验目的:探讨甲基化标志物的预后价值。
方法细节:回顾现有研究中采用MSP、焦磷酸测序检测临床样本的甲基化状态,分析与生存结局(总生存期OS、无病生存期DFS)的关联。
结果解读:Shim等发现p16甲基化患者的DFS缩短(HR=2.1,P<0.05,n=59);Lee等发现GSTP1甲基化患者的OS更短(中位数18个月 vs 36个月,P<0.05,n=60);Li等定义CIMP+(≥6个基因甲基化),发现其与TNM I期患者的复发相关(HR=3.5,P<0.01,n=115),预测复发的AUC=0.81,优于单一基因。
实验所用关键产品:领域常规使用生存分析软件(如GraphPad Prism 9)、MSP定量试剂盒(如Thermo Fisher TaqMan Methylation Assays)。
3.4 血液甲基化标志物的研究
实验目的:探索非侵入性甲基化标志物。
方法细节:回顾现有研究中采用定量MSP(QMSP)、联合亚硫酸氢盐限制分析(COBRA)等方法,检测血清/血浆中的甲基化DNA,对比组织样本的一致性。
结果解读:Wong等用QMSP检测到HCC患者血清中p16甲基化率为77%(n=29),与组织一致性达85%;Chan等用甲基化敏感限制酶实时PCR检测到RASSF1A甲基化率为93%(n=85),患者DFS缩短(HR=3.2,P<0.01);Tangkijvanich等用COBRA发现LINE-1低甲基化与HBV感染(OR=2.8,P<0.05)、肿瘤大(直径>5cm,OR=3.1,P<0.05)相关(n=85)。
实验所用关键产品:领域常规使用QMSP试剂盒(如Qiagen EpiTect MSP Kit)、COBRA限制酶(如NEB HpyCH4IV)。
4. Biomarker 研究及发现成果解析
核心信息段:本文涉及的Biomarker包括组织甲基化基因(p16、SOCS1、GSTP1、CDH1)、CIMP及血液甲基化标志物(p16、RASSF1A、LINE-1)。筛选逻辑为“基因组谱鉴定→组织验证→临床关联”,血液标志物的验证逻辑为“组织阳性→血液检测→预后分析”。研究结果显示,这些标志物与HCC的发生、发展及预后密切相关,但需统一CIMP定义和前瞻性验证。
Biomarker 定位与筛选逻辑
- 组织甲基化基因:通过基因组-wide研究(如MCAM、Illumina 450K芯片)筛选差异甲基化基因,经临床样本(手术标本)的MSP、焦磷酸测序验证,分析与临床参数的关联(如p16与肿瘤分期)。
- CIMP:基于多个基因的甲基化状态定义(如≥5个基因甲基化),通过生存分析验证其预后价值(如预测复发)。
- 血液甲基化标志物:先在组织中验证基因的甲基化状态,再用QMSP、COBRA等方法检测血清/血浆中的甲基化DNA,对比组织样本的一致性(如RASSF1A的组织-血液一致性达80%)。
研究过程详述
- p16(组织标志物):来源为HCC手术标本,验证方法为MSP,特异性——HBV阳性样本甲基化率60%(n=51),敏感性——区分肿瘤与正常组织的AUC=0.75(95% CI 0.68-0.82,n=80);与晚期分期相关(OR=2.5,P<0.05)。
- RASSF1A(血液标志物):来源为患者血浆,验证方法为QMSP,敏感性——HCC患者甲基化率93%(n=85),特异性——正常对照甲基化率10%(n=30);ROC曲线AUC=0.88(95% CI 0.82-0.94),与DFS缩短相关(HR=3.2,P<0.01)。
- CIMP(综合标志物):来源为组织样本,验证方法为MSP检测p16、SOCS1、GSTP1等7个基因,定义为≥5个基因甲基化;与AFP升高(OR=2.5,P<0.05,n=115)、肿瘤转移(OR=3.1,P<0.01,n=97)相关,预测复发的AUC=0.81。
核心成果提炼
- p16甲基化:作为HCC分期的标志物,晚期患者甲基化率是早期的2.5倍(P<0.05,n=80),无病生存期HR=2.1(P<0.05)。
- RASSF1A血液甲基化:作为非侵入性预后标志物,敏感性93%,特异性90%,预测无病生存期的AUC=0.88(95% CI 0.82-0.94)。
- CIMP:作为综合标志物,预测HCC复发的价值优于单一基因(AUC=0.81 vs 0.72),与AFP升高、肿瘤转移显著相关(P<0.05)。
本文的关键结论是:单一甲基化基因的临床价值有限,CIMP或血液甲基化标志物的联合检测是未来方向,但需标准化验证流程(如多中心前瞻性研究)和统一的CIMP定义。
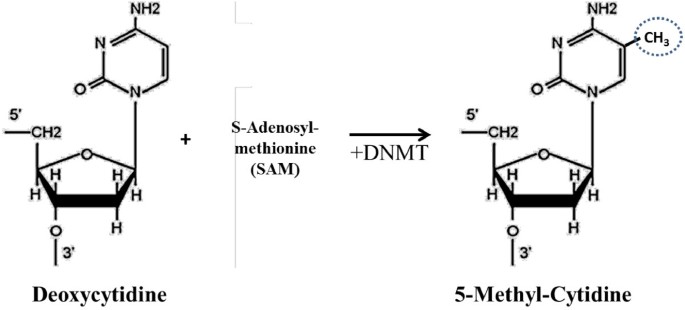
(图1:DNA甲基化的生化过程——甲基转移酶(DNMT)将S-腺苷甲硫氨酸(SAM)的甲基转移至胞嘧啶的5号碳,形成5-甲基胞嘧啶。)
