1. 领域背景与文献引入
文献英文标题:Identification of a circulating long non-coding RNA signature panel in plasma as a novel biomarker for the detection of acute/early-stage HIV-1 infection;发表期刊:Biomarker Research;影响因子:未公开;研究领域:HIV-1感染早期诊断生物标志物研究。
HIV-1感染是全球重大公共卫生问题,2023年WHO数据显示全球约3900万人感染,2022年新增130万例。急性HIV-1感染(AHI)是病毒载量峰值期(可达>1×10⁷拷贝/ml),但此时抗体尚未产生,导致现有抗体检测法完全漏检,核酸检测(NAT)也存在短暂窗口期(暴露后数天内无法检测)。AHI患者因不知情仍参与高风险行为,贡献了约50%的新发感染,因此早期检测是防控关键。
长链非编码RNA(lncRNA)是长度>200nt的非编码RNA,通过调控基因表达参与HIV-1复制、潜伏及免疫反应(如lncRNA NRON促进HIV-1在静止CD4⁺T细胞中潜伏,NEAT1与CD4⁺T细胞计数相关)。近年研究发现,循环lncRNA(血浆中的lncRNA)作为非侵入性生物标志物具有潜力,但既往研究多聚焦细胞内lncRNA,循环lncRNA的研究存在三大局限:①单lncRNA诊断准确性低(AUC<0.9);②小样本(<50例)且无独立验证;③未覆盖HIV-1不同感染阶段(如eclipse期,病毒载量低且抗原抗体阴性)。
本研究针对上述空白,系统筛选并验证循环lncRNA面板,旨在解决HIV-1早期检测的窗口期问题,为临床提供高灵敏度、高特异性的诊断工具,早期干预减少传播。
2. 文献综述解析
文献综述的核心评述逻辑为:从诊断局限切入→强调AHI高传染性→引入lncRNA功能→指出既往研究不足→提出本研究创新。
现有研究的关键结论包括:①lncRNA是HIV-1感染的重要调控因子(如NRON通过降解Tat蛋白促进潜伏,NEAT1下调与HIV-1复制增强相关);②PCR阵列是高效筛选候选lncRNA的工具,但单lncRNA研究无法满足临床需求。现有研究的局限性:①未聚焦循环lncRNA;②样本量小且无独立验证;③未评估治疗响应。
本研究的创新价值:①首次系统研究循环lncRNA在HIV-1急性/早期感染中的作用;②采用“发现-验证-面板构建-面板测试”四阶段设计,覆盖172份样本(含eclipse、急性、血清转换后及ART治疗组);③通过逻辑回归构建lncRNA面板,显著提高诊断准确性(AUC>0.99),解决单lncRNA的不足。
3. 研究思路总结与详细解析
整体框架:研究目标是鉴定循环lncRNA面板作为HIV-1急性/早期感染的生物标志物;核心科学问题是循环lncRNA能否区分不同感染阶段与健康对照,及ART对其表达的影响;技术路线为“发现→验证→面板构建→面板测试→ART响应评估”闭环。
3.1 样本收集与分组
实验目的是获取不同HIV-1感染阶段及健康对照的血浆样本,为后续研究提供基础。
方法细节:购买商业血清转换面板(SeraCare、ZeptoMetrix)及HIV阳性血浆样本,健康志愿者样本来自NIH血库(EDTA-K2管收集);按Fiebig分期、病毒载量、血清学指标(p24抗原、抗体、Western blot p31条带)分为5组:eclipse期(病毒载量低、抗原抗体阴性,n=20)、急性期(病毒载量高、p24阳性、抗体阴性,n=20)、血清转换后p31阴性(抗体阳性、Western blot无p31条带,n=20)、血清转换后p31阳性(抗体阳性、Western blot有p31条带,n=20)、ART治疗组(治疗≥12周、病毒载量<100拷贝/ml,n=20),健康对照(n=24)。
结果解读:成功收集172份血浆样本,分组符合实验设计要求,覆盖HIV-1全感染周期。
实验所用关键产品:血清转换面板(SeraCare、ZeptoMetrix)、EDTA-K2管(BD Vacutainer)。

3.2 发现阶段:lncRNA PCR阵列筛选
实验目的是从84个候选lncRNA中筛选HIV-1感染相关的差异表达lncRNA。
方法细节:采用RT² lncRNA PCR阵列(Qiagen,LAHS-001Z)检测20份样本(16例HIV阳性、4例健康对照),阵列包含84个功能相关lncRNA、5个管家基因(RN7SK、RPLP0等)及质控位点(DNA污染、RT效率);使用RT² SYBR Green ROX qPCR Master Mix(Qiagen,330523)在Applied Biosystems ViiA7仪器上检测,△△Ct法计算fold change(fold change>2或<0.5为差异显著)。
结果解读:筛选出21个差异表达lncRNA(15个上调、6个下调),其中DISC2、H19、PRINS等lncRNA在HIV阳性样本中显著高表达(fold change>3),为后续验证提供候选。
实验所用关键产品:RT² lncRNA PCR Array Human lncFinder(Qiagen,LAHS-001Z)、Applied Biosystems ViiA7实时PCR仪。
3.3 验证阶段:qPCR验证候选lncRNA
实验目的是验证发现阶段的21个lncRNA在更大样本中的差异表达。
方法细节:采用qPCR检测80例HIV阳性(eclipse20例、急性20例、p31阴性20例、p31阳性20例)和20例健康对照的血浆lncRNA,使用RT² lncRNA qPCR Assays(Qiagen,330701)及管家基因RN7SK、RPLP0的qPCR试剂盒,△Ct法归一化表达量(△Ct=目标lncRNA Ct - 管家基因平均Ct)。
结果解读:14个lncRNA在HIV阳性样本中显著差异表达(12个上调、2个下调),其中PRINS(AUC=0.861)、GACAT1(AUC=0.857)的诊断准确性较高;15个lncRNA在早期HIV感染(eclipse+急性+p31阴性)中差异表达(13个上调、2个下调)。
实验所用关键产品:RT² lncRNA qPCR Assays(Qiagen,330701)、RN7SK qPCR试剂盒(Qiagen,LPH28399A)。

3.4 面板构建:逻辑回归组合lncRNA
实验目的是通过组合lncRNA提高诊断准确性。
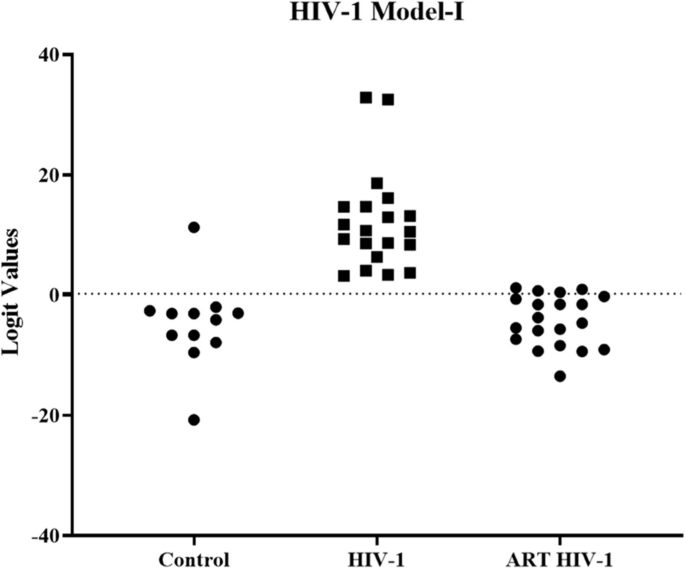
方法细节:将验证阶段的14个差异lncRNA纳入逻辑回归分析,构建区分不同感染阶段与健康对照的模型(如Pmodel-I用于区分所有HIV感染阶段,Pmodel-II用于eclipse期),计算logit值(如Pmodel-I的logit公式:11.866–0.953×DISC2–1.010×H19 + 0.649×IPW + 0.388×KRASP1 + 0.880×NEAT1–1.220×PRINS – 0.728×WT1-AS + 2.318×ZFAS1),通过ROC曲线评估性能。
结果解读:Pmodel-I(8个lncRNA组合)区分HIV感染与健康对照的AUC为0.990(95%CI 0.972-1.000,n=100,P<0.00001),灵敏度98.75%、特异性95%;Pmodel-II(eclipse期,4个lncRNA)和Pmodel-III(急性期,4个lncRNA)的AUC均为1.00(100%灵敏度、100%特异性),显著优于单lncRNA。
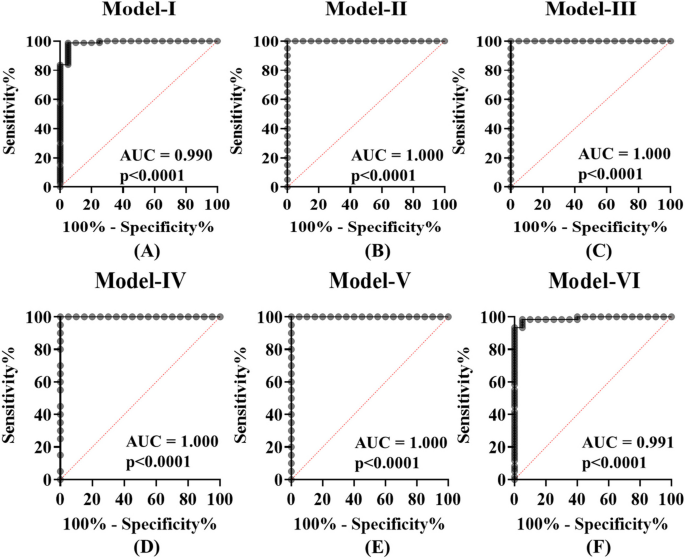
3.5 面板测试:独立样本验证
实验目的是验证面板的临床实用性。
方法细节:使用20例HIV阳性(eclipse5例、急性5例、p31阴性5例、p31阳性5例)和12例健康对照的独立样本,qPCR检测lncRNA表达,代入验证阶段的模型计算logit值,评估灵敏度、特异性。
结果解读:Pmodel-I区分HIV感染与健康对照的灵敏度100%(20/20)、特异性91.67%(11/12);Pmodel-II(eclipse期)准确性94.12%(16/17),Pmodel-VI(早期HIV)准确性92.59%(25/27),验证了面板的临床价值。
3.6 ART治疗样本评估:治疗响应分析
实验目的是评估ART对lncRNA表达的影响。
方法细节:收集20例ART治疗患者的血浆样本(治疗≥12周,病毒载量<100拷贝/ml),qPCR检测Pmodel-I中的8个lncRNA,与健康对照比较。
结果解读:lncRNA表达显著恢复至健康对照水平(logit值接近健康对照),提示这些lncRNA可作为治疗响应的生物标志物,监测ART疗效。
4. Biomarker研究及发现成果解析
Biomarker定位
本研究的Biomarker为循环lncRNA特征面板,包括:
- Pmodel-I(8个lncRNA:DISC2、H19、IPW、KRASP1、NEAT1、PRINS、WT1-AS、ZFAS1):区分所有HIV感染阶段与健康对照;
- Pmodel-II(4个lncRNA:DISC2、GACAT1、H19、NEAT1):区分eclipse期与健康对照;
- Pmodel-III(4个lncRNA:FTX、GACAT1、H19、NEAT1):区分急性期与健康对照。
筛选/验证逻辑:发现阶段(PCR阵列)→验证阶段(qPCR)→面板构建(逻辑回归)→面板测试(独立样本),形成完整证据链。
研究过程详述
- 来源:血浆样本(非侵入性,易获取);
- 验证方法:qPCR(定量准确,重现性好);
- 特异性与敏感性:
- Pmodel-I:AUC=0.990(95%CI 0.972-1.000),灵敏度98.75%,特异性95%;
- Pmodel-II(eclipse期):AUC=1.00,100%灵敏度、100%特异性;
- Pmodel-III(急性期):AUC=1.00,100%灵敏度、100%特异性。
核心成果提炼
- 功能关联:①Pmodel-I是HIV-1感染的通用生物标志物,可区分不同阶段;②Pmodel-II解决了eclipse期(病毒载量低、抗原抗体阴性)的检测难题;③lncRNA表达随ART治疗恢复正常,可监测疗效。
- 创新性:①首次构建循环lncRNA面板用于HIV-1急性/早期感染检测,准确性显著高于单lncRNA;②覆盖HIV-1全感染阶段,包括最难检测的eclipse期;③验证了生物标志物的治疗响应性,为临床提供“诊断+监测”双重工具。
本研究的发现为HIV-1早期诊断提供了新型非侵入性生物标志物,有望缩短窗口期,早期干预减少传播,同时为lncRNA在 infectious diseases中的应用提供了范例。
