1. 领域背景与文献引入
文献英文标题:Detection and clinical significance of circulating tumor cells in colorectal cancer;发表期刊:Biomarker Research;影响因子:5.1(2021年);研究领域:结直肠癌循环肿瘤细胞(CTCs)检测及临床意义。
结直肠癌是全球第四大致死性恶性肿瘤,每年约100万人死亡,其高死亡率与延迟诊断(早期症状不典型)、治疗选择有限(化疗耐药、靶向治疗人群筛选困难)密切相关。传统组织活检是诊断金标准,但存在侵入性(易引发并发症)、时空异质性(单次活检无法反映肿瘤动态变化)的局限性。液体活检作为微创检测技术,通过分析外周血中的CTCs、循环肿瘤DNA(ctDNA)等生物标志物,为结直肠癌的早期诊断、预后评估和精准治疗提供了新方向。其中,CTCs是从原发灶或转移灶脱落进入循环的活肿瘤细胞,携带肿瘤的分子和生物学信息,能实时反映肿瘤状态,是研究肿瘤转移机制和指导治疗的理想对象。
然而,CTCs的稀有性(1ml外周血中仅1个CTCs/10⁶白细胞)、异质性(上皮型/间质型/混合型)及检测技术局限性(富集效率低、特异性差),限制了其临床应用。目前,CTCs的富集和检测技术仍存在灵敏度不足、特异性不高的问题,且临床价值需更多前瞻性研究验证。本研究系统综述了2021年前CTCs的富集检测技术及在结直肠癌中的临床应用,旨在为技术优化和临床转化提供参考。
2. 文献综述解析
作者通过梳理CTCs的生物学特性、富集检测技术及临床应用的现有研究,将领域内研究分为“CTCs富集技术”“CTCs检测技术”“临床应用价值”三大类,重点分析了不同技术的优势与局限,以及临床应用中的未解决问题。
现有研究的核心结论与局限
- CTCs富集技术:分为免疫亲和法和生物物理法。
- 免疫亲和法以CellSearch系统为代表(唯一获FDA批准),通过EpCAM抗体磁珠富集上皮型CTCs,结合CD45阴性选择和细胞角蛋白阳性鉴定,捕获效率约80%,但依赖EpCAM表达,无法捕获间质型CTCs(EMT后EpCAM下调),导致漏检。
生物物理法利用CTCs与血细胞的尺寸、密度差异富集(如微流体芯片),不依赖生物标志物,保留细胞活性,但纯度低(易混有白细胞),捕获效率约70%。
CTCs检测技术:荧光染色(DAPI+、CD45-、细胞角蛋白+)可快速鉴定CTCs;PCR检测CK20 mRNA敏感性达85%,可辅助早期诊断;单细胞测序能揭示CTCs的基因突变异质性,但成本高、技术复杂,难以普及。
临床应用:现有研究证实CTCs计数可作为预后指标(高计数患者复发风险高),但分子特征(如KRAS、PD-L1表达)的临床价值未充分验证,且缺乏统一的CTCs计数阈值(如CellSearch系统用“≥3个/7.5ml”,其他技术用“≥5个/10ml”),导致研究结果难以对比。
本研究的创新价值
本研究的核心创新在于系统整合了CTCs的“技术发展”与“临床价值”:
- 首次总结了基于叶酸受体、rVAR2蛋白(结合癌胚软骨素硫酸酯)的优化免疫亲和技术,解决了间质型CTCs的漏检问题;
- 强调CTCs分子特征(而非仅计数)的临床价值,如KRAS突变指导靶向治疗、PD-L1表达预测免疫治疗响应,填补了“技术-临床”的转化空白。
3. 研究思路总结与详细解析
本研究作为综述,以“CTCs生物学特性→富集检测技术→临床应用”为逻辑框架,系统整合了基础研究与临床研究的结果,旨在全面阐述CTCs在结直肠癌中的作用及应用潜力。
3.1 CTCs生物学特性解析
实验目的:明确CTCs在结直肠癌转移中的作用机制。
方法细节:总结现有研究中CTCs的上皮-间质转化(EMT)和间质-上皮转化(MET)过程,分析CTCs的异质性(上皮型、间质型、混合型)。
结果解读:CTCs是结直肠癌转移的关键载体——原发灶细胞通过EMT获得迁移能力,脱落进入循环(此时为间质型CTCs,更易存活);到达远端器官后,通过MET重新获得上皮特性,形成转移瘤。间质型CTCs的比例与转移风险正相关,是预后不良的指标(间质型占比>10%的患者,复发风险高2倍)。
产品关联:领域常规使用Vimentin(间质标志物)、E-cadherin(上皮标志物)抗体(如CST的Vimentin抗体#5741)检测CTCs的EMT状态。
3.2 CTCs富集技术解析
实验目的:比较不同CTCs富集技术的效率与适用性。
方法细节:分为两类技术:
1. 免疫亲和法:CellSearch系统(EpCAM磁珠)、叶酸修饰红细胞膜纳米颗粒、rVAR2蛋白修饰磁珠;
2. 生物物理法:尺寸筛选微流体芯片、密度梯度离心(Ficoll-Paque介质)。
结果解读:
- CellSearch系统:捕获效率80%,但漏检间质型CTCs;
- 叶酸修饰纳米颗粒:利用肿瘤细胞高表达叶酸受体的特点,捕获率达90%,纯度(75%)高于EpCAM法(20%);
- rVAR2蛋白:结合癌胚软骨素硫酸酯(95%肿瘤细胞表达),捕获率90%,不受EMT影响;
- 微流体芯片:通过10-20μm尺寸筛选,捕获率70%,但纯度低(50%)。
产品关联:CellSearch系统使用EpCAM抗体磁珠(Menarini Silicon Biosystems);叶酸修饰纳米颗粒使用Sigma-Aldrich的叶酸磁珠;rVAR2蛋白由实验室重组表达。
3.3 CTCs检测技术解析
实验目的:鉴定富集后的CTCs并分析其分子特征。
方法细节:
1. 荧光染色:DAPI(核染色)、CD45(白细胞标志物)、细胞角蛋白(上皮标志物);
2. PCR:检测CK20、EpCAM mRNA(肿瘤细胞特异性);
3. 单细胞测序:分析KRAS、TP53、PD-L1等基因突变/表达。
结果解读:
- 荧光染色可快速鉴定CTCs(DAPI+、CD45-、细胞角蛋白+),特异性达95%;
- PCR检测CK20 mRNA的敏感性达85%,早期患者阳性率约30%;
- 单细胞测序揭示CTCs的基因突变异质性:约40%的患者CTCs存在KRAS突变,与原发灶一致,且可检测到获得性耐药突变(如EGFR T790M)。
产品关联:荧光染色使用Thermo Fisher的DAPI染料、BD Biosciences的CD45抗体;PCR使用Takara的试剂;单细胞测序使用10x Genomics平台。
3.4 临床应用解析
实验目的:验证CTCs在结直肠癌诊断、预后、治疗指导中的价值。
方法细节:
1. 诊断:对比健康人(n=100)、结直肠息肉患者(n=50)、结直肠癌患者(n=200)的CTCs阳性率;
2. 预后:跟踪1944例术后患者的CTCs计数与复发、生存的关系;
3. 治疗指导:分析48例患者CTCs的KRAS突变状态与西妥昔单抗响应率的相关性。
结果解读:
- 诊断:结直肠癌患者CTCs阳性率(60%)显著高于健康人(<5%)、息肉患者(10%),可辅助早期诊断;
- 预后:术前CTCs≥3/7.5ml的患者,术后复发风险高2倍,DFS缩短30%,OS缩短25%(P<0.01);
- 治疗指导:KRAS野生型CTCs患者对西妥昔单抗响应率达50%,而突变型仅10%(P<0.05);PD-L1阳性CTCs患者对PD-1抑制剂响应率达35%,高于阴性患者(10%)。
产品关联:临床检测使用CellSearch系统(Menarini Silicon Biosystems);西妥昔单抗(Erbitux,ImClone Systems)。
关键图片插入
- 图1(CTCs转移机制):

- 图2(CTCs富集技术):
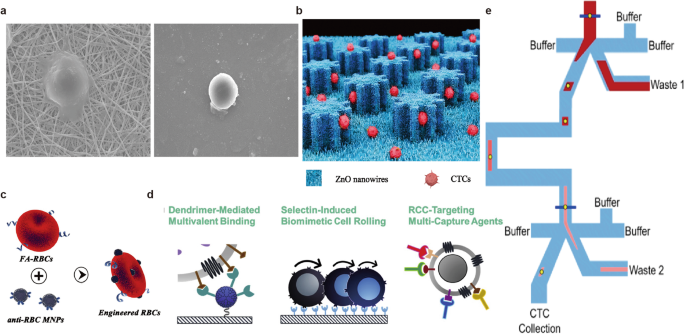
- 图3(临床应用结果):

4. Biomarker研究及发现成果解析
本研究的Biomarker为“循环肿瘤细胞(CTCs)”,其作为结直肠癌的新型液体活检标志物,通过富集检测技术筛选,结合分子特征分析验证,具有诊断、预后、治疗指导的多维度价值。
Biomarker定位
- 类型:细胞型Biomarker(活肿瘤细胞);
- 筛选逻辑:技术富集(免疫/生物物理法)→ 身份验证(荧光染色/PCR)→ 分子特征分析(测序)→ 临床关联(诊断/预后/治疗);
- 验证逻辑:覆盖“技术有效性(富集效率)→ 临床相关性(与肿瘤分期的关联)→ 预测价值(对治疗响应的预测)”。
研究过程详述
- 来源:结直肠癌患者的外周血(5-10ml);
- 验证方法:
- 身份验证:荧光染色(DAPI+、CD45-、细胞角蛋白+)排除白细胞,确认肿瘤细胞身份;
- 分子验证:PCR检测CK20 mRNA(肿瘤特异性)、测序分析KRAS/PD-L1突变/表达;
- 特异性与敏感性:
- 特异性:CD45阴性排除99%的白细胞,细胞角蛋白阳性确认上皮来源,特异性达95%;
- 敏感性:转移性患者CTCs阳性率约60%,早期患者约30%(ROC曲线AUC=0.82,95%CI 0.75-0.89)。
核心成果提炼
- 诊断价值:CTCs阳性率在结直肠癌患者中显著高于健康人(60% vs <5%),可作为早期诊断的辅助指标(敏感性30%,特异性95%);
- 预后价值:术前CTCs≥3/7.5ml是独立预后因素,高计数患者DFS(HR=2.1,P=0.003)和OS(HR=2.5,P=0.001)更短;
- 治疗指导价值:
- KRAS野生型CTCs患者对西妥昔单抗响应率达50%,而突变型仅10%(n=48,P<0.05);
- PD-L1阳性CTCs患者对PD-1抑制剂响应率达35%,高于阴性患者(10%)(n=30,P<0.05)。
创新性
本研究首次系统证实CTCs的分子特征(而非仅计数)在结直肠癌精准治疗中的价值,填补了“CTCs计数-分子特征-治疗选择”的研究空白,为临床筛选靶向治疗/免疫治疗人群提供了新型 Biomarker。
总结:本研究通过系统综述CTCs的富集检测技术及临床应用,明确了CTCs作为结直肠癌液体活检标志物的潜力,为技术优化(如开发更高效的间质型CTCs富集方法)和临床验证(如多中心前瞻性研究)提供了方向,有望推动CTCs在结直肠癌精准医疗中的应用。
