1. 领域背景与文献引入
文献英文标题:Assessing biological and technological variability in protein levels measured in pre-diagnostic plasma samples of women with breast cancer;发表期刊:Biomarker Research;影响因子:3.286;研究领域:乳腺癌预诊断蛋白质生物标志物。
乳腺癌是全球女性最常见的恶性肿瘤之一,早期诊断是改善预后的核心——局部病灶患者5年生存率可达>98%,而转移性患者仅29.6%(SEER数据)。血液蛋白质因易获取、能反映肿瘤微环境变化,成为乳腺癌早筛生物标志物的重要研究方向。然而,现有研究存在三大局限:①多基于诊断时样本,假设诊断时的蛋白变化可推广至预诊断阶段,但纵向研究显示蛋白谱随肿瘤进展动态变化;②预诊断样本稀缺,仅少数研究使用确诊前1-5年的血浆,且样本量小;③技术变异性大,蛋白质组学技术(如质谱的无偏检测、免疫法的靶向验证)的重复性、稳定性及可比性未充分评估,导致生物标志物难以验证。
针对上述空白,本文以预诊断乳腺癌血浆样本为研究对象,采用10对姐妹配对设计(预诊断病例与未患癌的生物学姐妹),通过三种主流蛋白质检测技术(LC-MS/MS、Myriad-RBM、Olink),系统评估技术/生物变异性及小样本下的统计效力,为预诊断生物标志物研究提供技术选择与实验设计框架。
2. 文献综述解析
本文综述的核心逻辑为:“乳腺癌早筛的必要性→现有生物标志物研究的局限→技术优缺点对比→本研究的创新性”。
现有研究的关键结论与局限
现有研究已证实血液蛋白可区分乳腺癌病例与对照(如EGFR、 glycolysis相关蛋白),但多基于诊断时样本,预诊断样本的验证极少;技术层面,质谱(LC-MS/MS)可无偏检测数千种蛋白,但仅能相对定量;免疫法(如Luminex、Olink)靶向检测已知 biomarkers,可绝对定量,但依赖抗体特异性,且检测范围有限。现有研究的优势在于“发现-验证”的互补性,但局限性显著:①样本量小(多<50例),难以评估变异性;②预诊断样本稀缺,缺乏纵向数据;③未系统对比多技术的表现,导致结果不可比。
本研究的创新价值
本文的突破在于:①首次对比三种技术在预诊断样本中的表现,覆盖无偏发现(LC-MS/MS)与靶向验证(Myriad-RBM、Olink);②配对姐妹设计,减少遗传(同卵/异卵姐妹)与环境混杂,提高统计效力;③小样本框架,针对预诊断样本“量少珍贵”的特点,评估技术的样本需求(如Olink仅需20μL血浆)与统计效力,为后续研究提供参考。
3. 研究思路总结与详细解析
整体框架概括
研究目标:评估三种蛋白质检测技术在预诊断乳腺癌血浆样本中的生物/技术变异性,及小样本下的统计效力;
核心科学问题:不同技术在预诊断样本中的表现(检测深度、变异性)如何?配对设计是否能减少混杂?
技术路线:样本选择(10对姐妹)→三种技术检测→数据过滤→技术变异评估→生物vs技术变异分析→病例对照比较→结论。
3.1 样本收集与选择
实验目的:获取遗传/环境相似的预诊断样本,减少混杂。
方法细节:从乳腺癌家族登记处(BCFR)选取10对女性:病例为“确诊前2年内提供血浆的乳腺癌患者”,对照为“未患癌的生物学姐妹”。样本采集后存储于-70℃,无肿瘤史、无激素治疗史(避免干扰蛋白谱)。
结果解读:配对设计使病例与对照在遗传(姐妹共享50%基因)、环境(共同生活史)上高度相似,有效控制“生活方式、遗传背景”等混杂因素。
产品关联:文献未提及具体样本存储产品,领域常规使用-80℃超低温冰箱(如Thermo Fisher的Revco系列)。
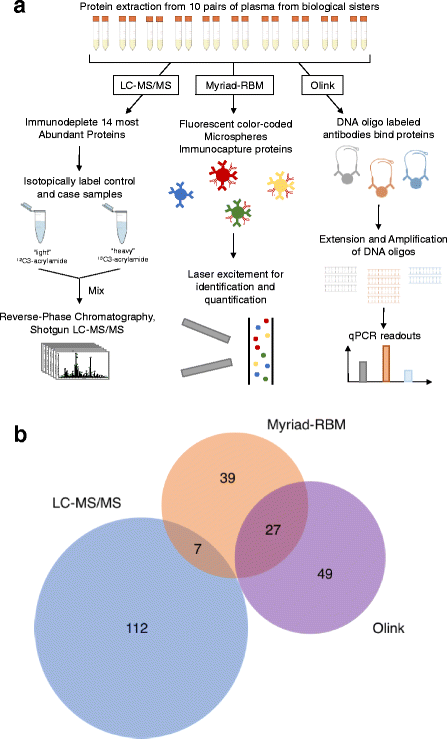
3.2 三种技术的样本处理与检测
实验目的:用三种技术检测血浆蛋白质,覆盖无偏发现与靶向验证。
方法细节:
- LC-MS/MS:250μL血浆经CaptureSelect™ HumanPlasma14试剂盒去除14种高丰度蛋白(如白蛋白、IgG);病例样本用“重 acrylamide(¹³C3)”标记,对照用“轻 acrylamide(¹²C3)”标记;混合后经C8柱分馏、胰酶消化,用LTQ-Orbitrap Velos质谱仪(Thermo Fisher)分析。
- Myriad-RBM:200μL血浆用Human OncologyMAP® v.1.0 assay(Luminex xMap技术)检测101种靶向蛋白(如癌抗原、细胞因子),通过荧光微球捕获-激光检测定量。
- Olink:20μL血浆用Proseek Multiplex Oncology I 96×96 kit,通过“邻近依赖PCR”(抗体-寡核苷酸探针结合目标蛋白后,PCR扩增信号),用Fluidigm BioMark HD qPCR平台检测96种蛋白。
结果解读:三种技术的检测能力差异显著(图1):LC-MS/MS检测119种蛋白(相对定量),Myriad-RBM检测73种(绝对定量),Olink检测76种(绝对定量);无蛋白被三种技术共同检测,仅7种被LC-MS/MS与Myriad-RBM重叠,27种被Olink与Myriad-RBM重叠。
产品关联:实验所用关键产品包括:CaptureSelect™ HumanPlasma14 depletion material、Myriad-RBM的Human OncologyMAP® v.1.0 assay、Olink的Proseek Multiplex Oncology I 96×96 kit、Fluidigm BioMark HD real-time PCR平台。
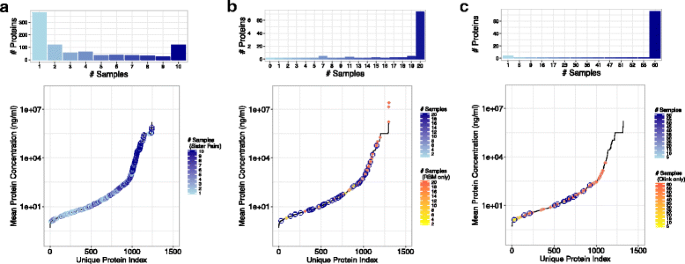
3.3 数据过滤与质量控制
实验目的:保留高质量数据,保证统计效力。
方法细节:
- LC-MS/MS:仅保留“在所有10对样本中定量的蛋白”;
- Myriad-RBM/Olink:仅保留“≥80%样本中检测值高于最低检测限(LDD)”的蛋白。
结果解读:过滤后的数据量符合统计要求(如Olink保留76种蛋白),减少了缺失值对结果的影响。
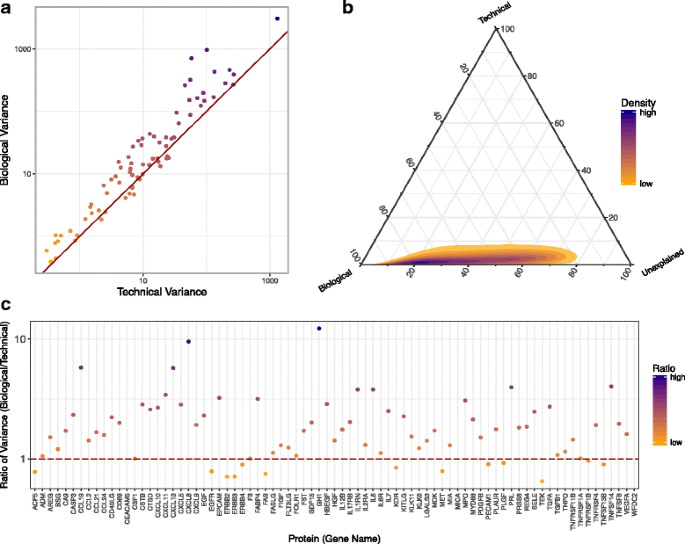
3.4 技术变异评估
实验目的:评估不同技术的固有变异性(重复检测的一致性)。
方法细节:
- LC-MS/MS:用“同一样本的多肽段重复”计算相对误差(标准差/均值);
- Olink:用“同一样本的三联重复”计算相对误差。
结果解读:LC-MS/MS的平均相对误差约10%(图4a),说明质谱的重复性较好;Olink的平均相对误差约20%(图4c),但误差与蛋白丰度无关(图4b,调整R²=0.01),说明技术稳定性不受蛋白含量影响。
产品关联:文献未提及具体误差分析工具,领域常规使用R软件的stats包计算相对误差。
3.5 生物变异与技术变异分析
实验目的:明确“生物差异(个体间)”与“技术差异(重复检测)”的贡献。
方法细节:以Olink数据为例,技术变异为“三联重复的标准差”,生物变异为“所有样本的均值标准差”;用方差分解(ANOVA)评估两者的比例。
结果解读:生物变异显著大于技术变异(图5a,多数蛋白的生物变异>技术变异);方差分解显示,个体差异贡献了>70%的总变异(图5b),说明预诊断样本的蛋白谱差异主要来自“个体生物学特征”而非技术误差。此外,不同蛋白的变异性不同(图5c),如“炎症相关蛋白”的生物变异更大,“ housekeeping蛋白”的技术变异更小。
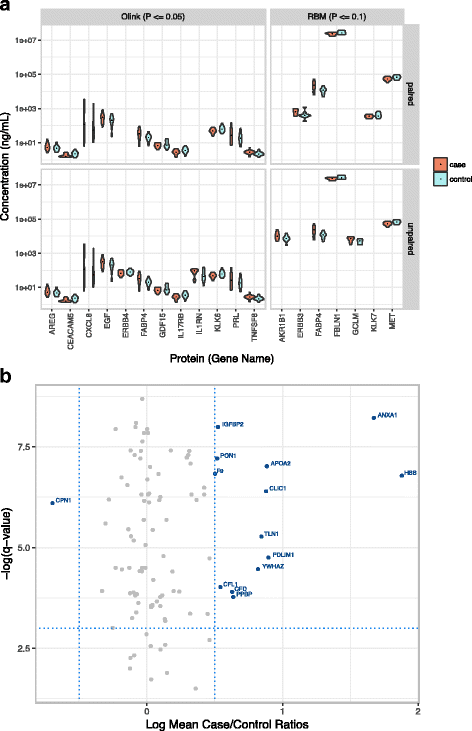
3.6 病例对照比较
实验目的:评估三种技术检测“病例-对照差异”的能力。
方法细节:
- PCA分析:将高维数据降维,观察病例与对照的分离情况;
- 统计检验:配对t检验(利用姐妹配对减少混杂)、未配对t检验,用Benjamini-Hochberg校正多重检验。
结果解读:
- PCA未分离病例与对照(补充图S1a),说明蛋白谱的个体差异大于病例-对照差异;
- t检验发现32种蛋白有差异(p<0.1),但无蛋白通过多重检验校正(图6);
- Olink检测到更多差异蛋白(18种),Myriad-RBM最少(5种);脂肪酸结合蛋白4(FABP4)在两种抗体技术中均有差异(p<0.1),提示其可能是潜在 biomarker,但需更大样本验证。
4. Biomarker 研究及发现成果解析
Biomarker 定位与筛选逻辑
Biomarker类型:循环血浆蛋白质;
筛选逻辑:通过三种技术(无偏+靶向)检测预诊断血浆蛋白,利用“配对设计+统计检验”筛选差异蛋白,再通过多重检验验证。
研究过程详述
Biomarker来源:BCFR的预诊断血浆样本(确诊前2年内采集);
验证方法:
- LC-MS/MS:无偏检测119种蛋白,相对定量;
- Myriad-RBM:靶向检测101种已知 biomarkers,绝对定量;
- Olink:靶向检测96种 Oncology相关蛋白,绝对定量;
特异性与敏感性:无明确的ROC曲线数据,但t检验显示32种蛋白的病例-对照差异有统计学趋势(p<0.1),但未通过多重检验校正,说明特异性不足(假阳性率高)。
核心成果提炼
- 技术对比结论:Olink需样本量小(20μL),适合珍贵的预诊断样本;LC-MS/MS检测深度高,适合 biomarker发现;Myriad-RBM的靶向性强,但在本研究中表现最差(仅5种差异蛋白)。
- Biomarker 潜力:FABP4在两种抗体技术中均有差异,且其功能与“脂肪代谢、乳腺癌转移”相关(文献报道FABP4高表达与乳腺癌不良预后相关),但需更大样本验证。
- 统计效力:小样本(n=10)下,配对设计未显著提高统计效力,提示后续研究需扩大样本量(≥50例),或采用“多技术联合”策略(如LC-MS/MS发现+Olink验证)。
总结:本文为预诊断乳腺癌生物标志物研究提供了“技术选择-实验设计-数据解析”的框架,强调“生物变异>技术变异”是预诊断样本的核心挑战,小样本研究需优先选择“样本量需求小、稳定性高”的技术(如Olink),并通过“配对设计”减少混杂。虽未发现明确的 biomarker,但为后续研究指明了方向——“更大样本+多技术联合+纵向验证”。