1. 领域背景与文献引入
文献英文标题:DLGAP1 directs megakaryocytic growth and differentiation in an MPL dependent manner in hematopoietic cells;发表期刊:Biomarker Research;影响因子:未公开;研究领域:骨髓增殖性肿瘤(MPN)与巨核细胞生物学。
巨核细胞是血小板的前体细胞,其生长、分化及血小板生成主要由促血小板生成素(TPO)与其受体MPL(myeloproliferative leukemia protein)结合激活的信号通路调控。MPL信号异常会导致骨髓增殖性肿瘤(MPN),这是一组以髓系细胞过度增殖为特征的克隆性造血干细胞疾病,包括真性红细胞增多症(PV)、原发性血小板增多症(ET)和原发性骨髓纤维化(PMF)。过去十年,JAK2 V617F、MPL W515L及CALR突变被鉴定为MPN的核心驱动突变,这些突变通过激活JAK-STAT通路导致细胞异常增殖。然而,仍有15%的MPN患者缺乏上述驱动突变,且MPN向急性髓系白血病(AML)转化的分子机制尚未完全阐明。此外,现有研究多聚焦于已知驱动突变的功能,对MPL信号通路中的协同调控因子(尤其是造血系统特异性因子)关注不足,这些因子可能在MPN的发生、克隆演化中发挥关键作用。
本研究旨在通过逆转录病毒插入诱变技术,筛选与MPL信号协同作用的基因,揭示其在巨核细胞生长和分化中的功能,为MPN的发病机制提供新的候选因子。
2. 文献综述解析
作者对现有研究的评述逻辑围绕“MPN的驱动突变-信号通路-未解决问题”展开:
1. MPN的核心驱动突变:JAK2、MPL、CALR突变解释了约85%的MPN病例,这些突变通过直接或间接激活JAK-STAT通路导致细胞增殖;
2. 现有研究的局限性:仍有15%的患者无已知驱动突变,且MPN向AML转化的机制不明,提示存在未被发现的协同因子参与MPL信号调控;
3. DLGAP1的研究空白:DLGAP1属于Scribble细胞极性复合物成员,既往主要在神经组织中研究(参与突触功能和细胞极性调控),但在造血系统中的功能尚未报道。
本研究的创新点在于:首次将DLGAP1与MPL信号通路关联,通过逆转录病毒插入诱变筛选到DLGAP1作为MPL信号的协同因子,揭示其在巨核细胞生长和分化中的调控作用,为MPN的研究提供了新的分子靶点。
3. 研究思路总结与详细解析
本研究的核心目标是筛选MPL信号的协同因子并探讨其功能,技术路线为“逆转录病毒插入诱变筛选候选基因→细胞定位分析→激酶调控研究→功能验证(生长、多倍体化)”。
3.1 逆转录病毒插入诱变筛选MPL协同因子
实验目的:识别与MPL信号协同、支持造血细胞增殖的基因。
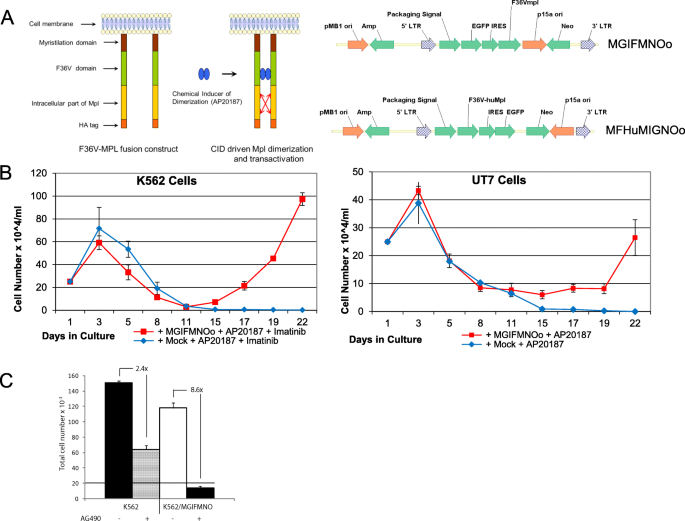
方法:构建含诱导型MPL融合蛋白(F36V-MPL)的MSCV逆转录病毒载体(MGIFMNOo、MFHuMIGNOo),转导K562(用Imatinib抑制BCR-ABL信号)、UT7/TPO细胞;加入AP20187激活MPL信号,筛选存活的GFP阳性克隆;通过测序逆转录病毒插入位点(RIS)识别候选基因。
结果:36次独立转导后,共回收203个独立插入位点,其中3个独立插入事件均位于DLGAP1基因的第4内含子(n=3),提示DLGAP1是与MPL信号协同的关键候选基因。
实验所用关键产品:Phoenix gag-pol包装细胞、Polybrene试剂、Imatinib(诺华)、AP20187(ARIAD Pharmaceuticals)。
3.2 DLGAP1在造血细胞中的定位分析
实验目的:明确DLGAP1在造血细胞中的亚细胞定位及细胞周期依赖性。
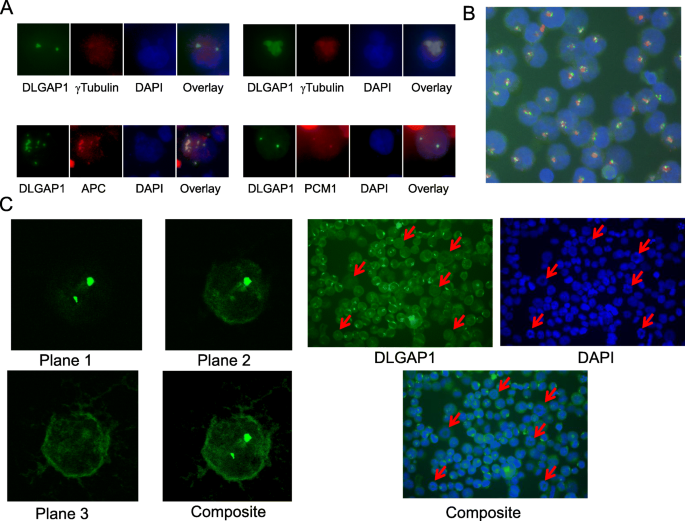
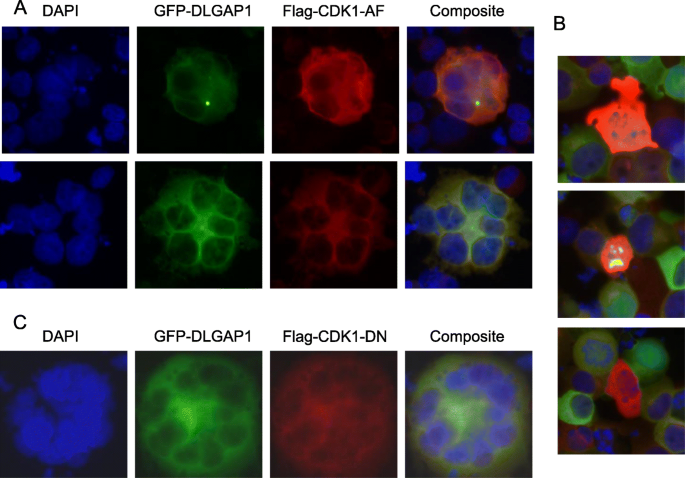
方法:用免疫荧光染色检测DLGAP1与中心体标记物(γ-微管蛋白、APC)、PCM1(中心体卫星蛋白)的共定位,使用K562、UT7/TPO、HEL等细胞系。
结果:全长DLGAP1定位于中心体和细胞质,与γ-微管蛋白(中心体特异)、APC(中心体及细胞质 speckles)共定位;截短型DLGAP1(缺失N端5个14氨基酸重复域)无中心体定位。此外,DLGAP1的中心体定位具有细胞周期依赖性:有丝分裂期(如UT7/TPO细胞的 metaphase 阶段),DLGAP1从中心体解离,仅保留细胞质定位。
实验所用关键产品:抗DLGAP1抗体(SCBT sc-25662、sc-12219;NeuroMab 75-236)、抗γ-微管蛋白抗体(SCBT sc-17787)、抗APC抗体(SCBT sc-896)。
3.3 激酶抑制剂对DLGAP1定位的影响
实验目的:探讨造血相关激酶(JAK2、SRC、MAPK)对DLGAP1中心体定位的调控。
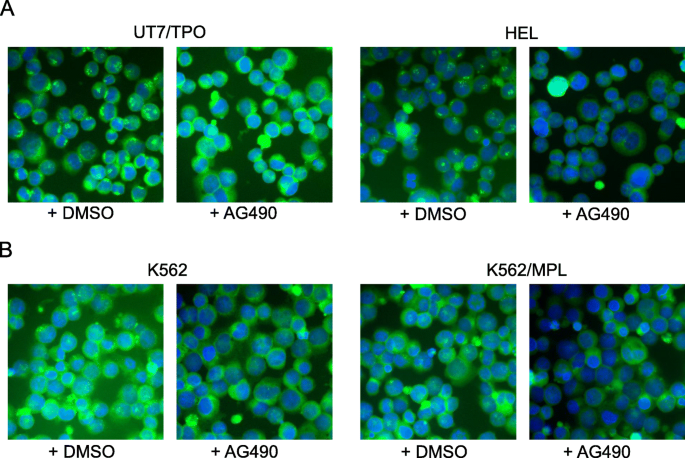
方法:用JAK2抑制剂AG490、SRC抑制剂SU6656、MAPK抑制剂U0126处理UT7/TPO、HEL、K562细胞,免疫荧光检测DLGAP1定位变化。
结果:三种抑制剂处理后,DLGAP1均从中心体解离,提示JAK2、SRC、MAPK的活性是维持DLGAP1中心体定位的关键;而中心体卫星蛋白PCM1的定位不受抑制剂影响,说明DLGAP1的中心体定位独立于PCM1通路。
实验所用关键产品:AG490(Cayman Chemical)、SU6656(Cayman Chemical)、U0126(Cell Signaling Technology)。
3.4 DLGAP1对巨核细胞多倍体化的作用
实验目的:研究DLGAP1对巨核细胞分化标志(多倍体化)的影响。
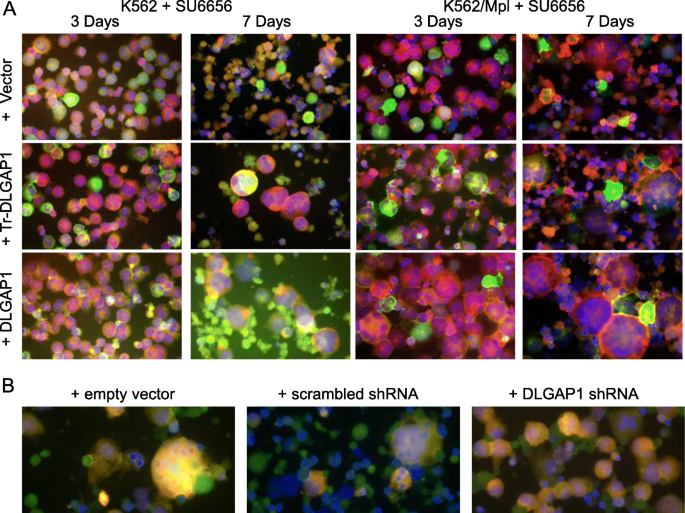
方法:1. 在K562、MPL依赖的K562细胞中过表达全长或截短型DLGAP1(融合EGFP),用SU6656(SRC抑制剂,诱导多倍体化)处理3-7天,检测细胞倍性;2. 用DLGAP1特异性shRNA knockdown HEL细胞的DLGAP1表达,用Nocodazole+PMA诱导巨核细胞分化,观察细胞形态及多倍体比例。
结果:1. 过表达全长DLGAP1显著促进SU6656诱导的多倍体化(7天处理后,多倍体比例高于对照组),而截短型DLGAP1则抑制多倍体化;2. Knockdown DLGAP1后,HEL细胞无法完成晚期分化(无高倍体细胞),仅出现早期细胞直径增大。
实验所用关键产品:pEGFP-C1载体、SU6656(Cayman Chemical)、Nocodazole(SCBT)、PMA(SCBT)。
3.5 CDK1对DLGAP1的调控
实验目的:探讨CDK1(造血细胞主要周期蛋白依赖性激酶)对DLGAP1定位及功能的影响。
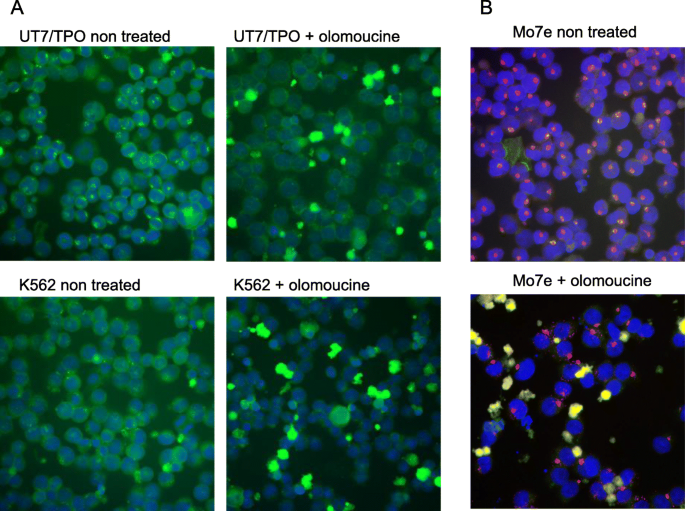
方法:1. 用CDK1抑制剂Olomoucine处理UT7/TPO、K562细胞,免疫荧光检测DLGAP1定位;2. 过表达组成型活性CDK1(Flag-CDK1-AF)或显性负性CDK1(Flag-CDK1-ND),观察DLGAP1定位及多倍体化变化。
结果:1. Olomoucine处理使DLGAP1从中心体解离;2. 组成型活性CDK1维持DLGAP1的中心体定位,抑制多倍体化;3. 显性负性CDK1促进DLGAP1从中心体解离,增强多倍体化(出现高倍体细胞)。
实验所用关键产品:Olomoucine(SCBT)、Flag-CDK1-AF/ND质粒(Dr. Daniel Wu馈赠)。
4. Biomarker研究及发现成果解析
Biomarker定位
DLGAP1是MPN进展的候选Biomarker,类型为mRNA/蛋白质,筛选逻辑为“逆转录病毒插入诱变筛选候选基因→临床数据库验证表达”。
研究过程详述
- 来源与验证:通过FHCRC(Fred Hutchinson Cancer Research Center)患者数据库分析,DLGAP1 mRNA在慢性髓系白血病(CML)的blast期(急变期)表达水平显著高于慢性期(高10-100倍);Oncomine数据库进一步验证,DLGAP1在多种髓系恶性肿瘤(如急性髓系白血病、骨髓增生异常综合征)中表达升高,但基因拷贝数无明显变化(排除扩增或缺失导致的表达异常)。
- 功能关联:DLGAP1的表达水平与巨核细胞分化相关——全长DLGAP1高表达促进多倍体化(分化标志),截短型DLGAP1高表达则抑制分化;其中心体定位状态直接调控巨核细胞生长(解离后促进分化,结合时抑制生长)。
核心成果提炼
- Biomarker潜力:DLGAP1可作为MPN进展的候选Biomarker,其mRNA水平与CML疾病阶段正相关(blast期显著升高),可能用于监测疾病进展。
- 功能创新性:首次揭示DLGAP1作为MPL信号的协同因子,通过“中心体定位-激酶调控”机制调控巨核细胞生长和分化——全长DLGAP1从中心体解离后,促进多倍体化;截短型DLGAP1则通过保留SHANK结合域(C端)增强增殖信号。
- 临床意义:DLGAP1可能参与MPN的发生,尤其是无已知驱动突变(JAK2/MPL/CALR野生型)的患者,其异常表达或剪接(如截短型isoform)可能是疾病的潜在驱动因素。
本研究为MPN的发病机制提供了新的分子靶点,也为DLGAP1作为Biomarker的进一步临床验证奠定了基础。
