1. 领域背景与文献引入
文献英文标题:PSCA is a target of chimeric antigen receptor T cells in gastric cancer;发表期刊:Biomarker Research;影响因子:未公开;研究领域:胃癌CAR-T细胞免疫治疗。
胃癌是全球第四大常见恶性肿瘤,也是第三大癌症死亡原因,晚期患者因诊断延迟、现有治疗(化疗、靶向治疗)响应率低,预后极差。嵌合抗原受体T细胞(CAR-T)治疗作为新型免疫治疗技术,2017年FDA批准其用于血液系统恶性肿瘤(如B细胞白血病、淋巴瘤),取得突破性疗效,但实体瘤(如胃癌)的CAR-T治疗仍面临肿瘤异质性强、缺乏特异性靶点、T细胞浸润困难等挑战。前列腺干细胞抗原(PSCA)是一种糖基磷脂酰肌醇(GPI)锚定的细胞表面蛋白,已在前列腺癌、非小细胞肺癌等中被证实可作为CAR-T靶点,但胃癌中虽已发现PSCA表达,却未探索其作为CAR-T靶点的可行性。本研究针对这一空白,验证PSCA作为胃癌CAR-T靶点的有效性,为胃癌免疫治疗提供新策略。
2. 文献综述解析
作者通过梳理两类研究脉络明确现有研究的局限性与本研究的创新方向:一是CAR-T治疗的发展——血液瘤的成功与实体瘤的挑战,指出实体瘤缺乏特异性靶点是核心障碍;二是PSCA的肿瘤相关性——PSCA在前列腺癌、非小细胞肺癌等中高表达且可作为CAR-T靶点,但胃癌中的研究空白。现有研究的优势在于确立了CAR-T治疗的有效性及PSCA的肿瘤抗原属性,局限性在于未探索PSCA在胃癌CAR-T中的潜力。本研究的创新点是首次验证PSCA作为胃癌CAR-T靶点的可行性,构建含CD28和DAP10共刺激域的第三代抗PSCA CAR-T细胞,系统评估其体内外抗肿瘤活性,填补了PSCA在胃癌免疫治疗中的研究空白。
3. 研究思路总结与详细解析
本研究以“验证PSCA作为胃癌CAR-T靶点的可行性”为目标,遵循“PSCA表达检测→CAR-T细胞构建→体外功能验证→体内疗效评估”的逻辑,通过细胞实验与动物模型系统验证抗PSCA CAR-T细胞的活性。
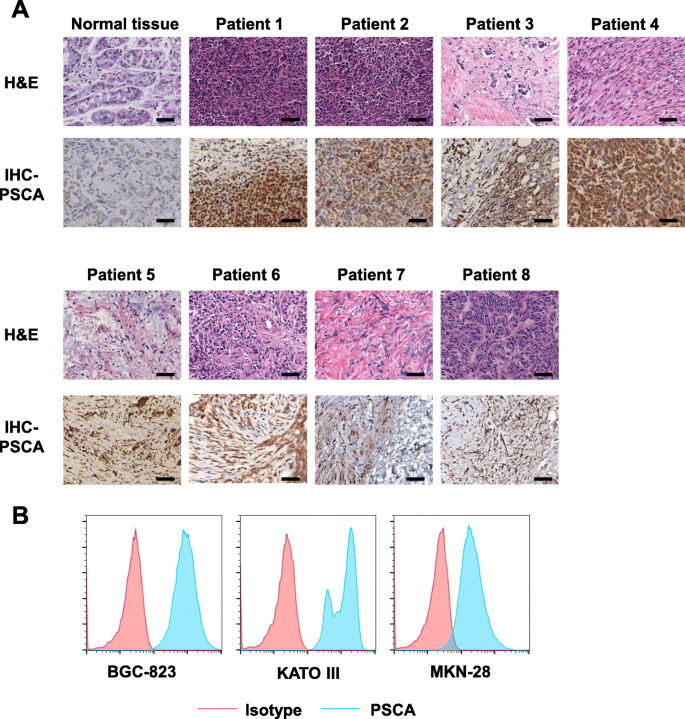
3.1 PSCA在胃癌组织及细胞系中的表达验证
实验目的是明确PSCA在胃癌中的表达情况,为CAR-T靶点选择提供依据。方法采用免疫组化(IHC)检测8例原发性胃癌组织的PSCA表达,流式细胞术检测BGC-823、MKN-28、KATO III三株胃癌细胞系的PSCA表面表达。结果显示,大部分胃癌组织(文献未明确具体比例)表达PSCA,三株细胞系均均匀表达PSCA(流式细胞术结果证实)。实验所用关键产品:免疫组化采用Santa Cruz Biotechnology的抗人PSCA-APC抗体(克隆75);流式细胞术采用Biolegend的抗人CCR7-APC(克隆3D12)、抗人CD62L-PE(克隆DREG-56)等抗体。
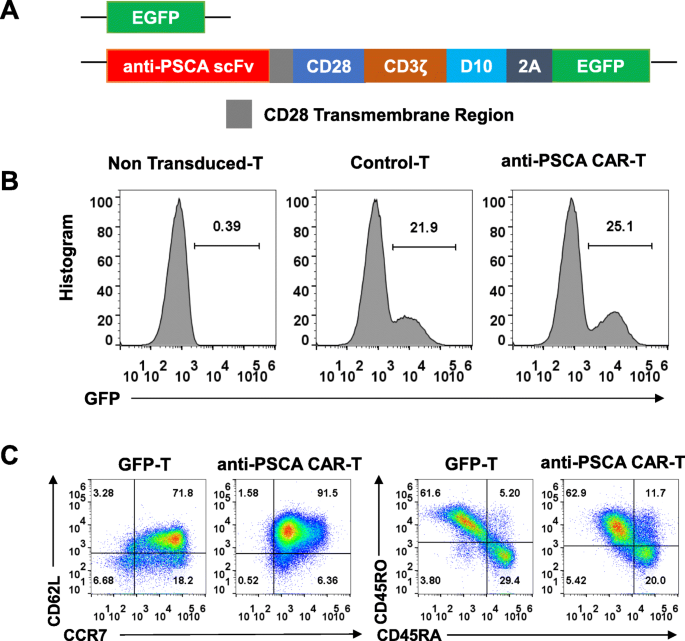
3.2 第三代抗PSCA CAR-T细胞的构建与鉴定
实验目的是构建表达PSCA特异性CAR的T细胞并鉴定其表型。方法从健康供者外周血分离外周血单个核细胞(PBMC),通过负性选择获得原代T细胞,用CD3/CD2/CD28微珠激活48小时后,转导含抗PSCA单链可变片段(scFv,源自人源化IG8抗体)、CD28和DAP10共刺激域的第三代慢病毒载体;通过流式细胞术检测CAR表达(基于GFP阳性比例)及T细胞表型(CCR7、CD62L、CD45RA/RO等)。结果显示,慢病毒转导后T细胞GFP阳性率提示CAR成功表达,且T细胞呈现CD45RO⁺CCR7⁺CD62L高表达表型(中央记忆T细胞,提示可持续抗肿瘤潜力)。实验所用关键产品:T细胞分离用Miltenyi Biotec的Pan-T Isolation Kit,激活用Miltenyi Biotec的抗人CD3/CD2/CD28微珠,慢病毒包装用Sigma-Aldrich的聚乙烯亚胺(PEI)。
3.3 抗PSCA CAR-T细胞的体外细胞毒性与功能验证
实验目的是评估抗PSCA CAR-T细胞对胃癌细胞的体外杀伤活性及功能状态。方法将BGC-823、MKN-28、KATO III细胞转导GFP-荧光素酶基因(GL标记),以效靶比(E:T)2:1、1:1、1:2、1:4与抗PSCA CAR-T细胞或GFP-T细胞共培养24小时,通过荧光素酶报告系统检测细胞毒性;收集上清用酶联免疫吸附试验(ELISA)检测IL-2、IFN-γ、GM-CSF、TNFα等细胞因子分泌;流式细胞术检测T细胞激活标志物(CD25、CD69)及表型变化(CD62L、CD27)。结果显示,抗PSCA CAR-T细胞的细胞毒性显著强于GFP-T细胞(如BGC-823细胞在E:T=2:1时,CAR-T组杀伤率更高,P<0.05);细胞因子分泌显著增加(如IFN-γ浓度高于GFP-T组,P<0.01);激活标志物CD25、CD69上调,CD62L、CD27下调(提示T细胞活化)。实验所用关键产品:ELISA试剂盒来自eBioscience,荧光素酶检测用Yeasen的D-荧光素钾盐。

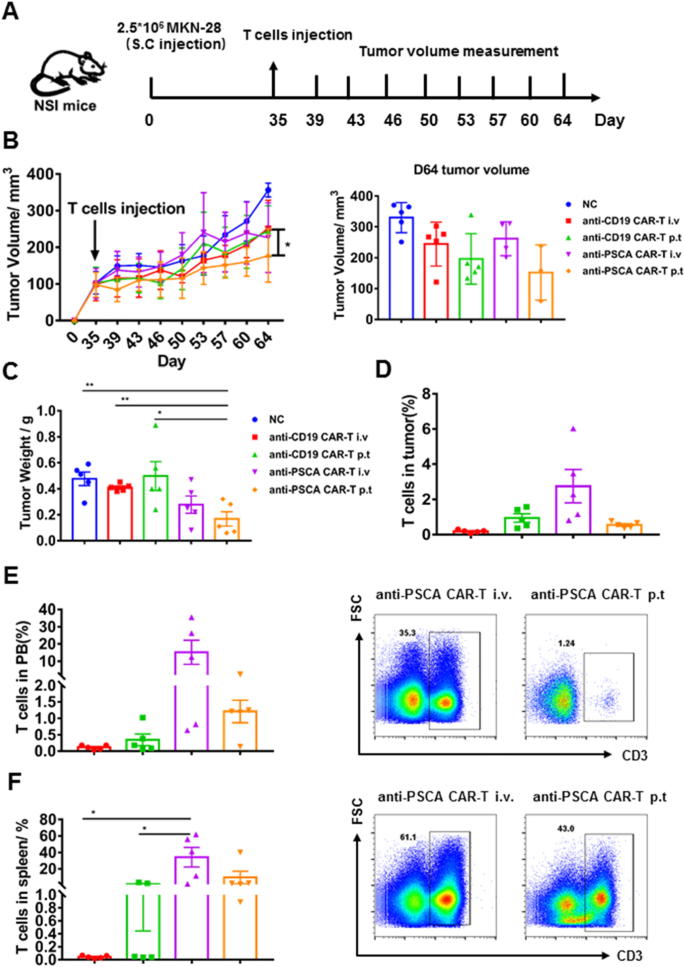
3.4 抗PSCA CAR-T细胞的体内抗肿瘤活性评估
实验目的是验证抗PSCA CAR-T细胞在体内的抗肿瘤效果及给药方式的影响。方法构建两种胃癌皮下异种移植模型:BGC-823模型(5×10⁵肿瘤细胞注射,肿瘤可触及时给药)和MKN-28模型(2.5×10⁶肿瘤细胞注射,肿瘤达100 mm³时给药),用NSI小鼠(NOD-SCID-IL2Rg⁻/⁻),分别通过静脉注射或瘤周注射给予2.5×10⁶抗PSCA CAR-T细胞或GFP-T细胞,每周两次测量肿瘤体积,3周后评估肿瘤重量及T细胞浸润情况。结果显示,瘤周注射抗PSCA CAR-T细胞组的肿瘤体积显著小于GFP-T组及静脉注射组(BGC-823模型中,瘤周注射组肿瘤重量显著降低,P<0.05;MKN-28模型中,瘤周注射组肿瘤生长抑制更明显);T细胞浸润检测显示,瘤周注射组肿瘤内T细胞比例略高于静脉注射组,但无统计学差异(文献未明确具体数值)。实验所用关键产品:实验动物为NSI小鼠(广州生物医药与健康研究院构建),肿瘤细胞注射用Gibco的PBS。

4. Biomarker研究及发现成果解析
本研究的Biomarker为前列腺干细胞抗原(PSCA),是一种GPI锚定的细胞表面蛋白,通过“组织/细胞系表达验证→CAR-T细胞功能验证”的逻辑,确证其作为胃癌CAR-T治疗靶点的可行性。
Biomarker定位与筛选逻辑
PSCA作为候选Biomarker,基于其在胃癌组织及细胞系中的高表达,且已有研究证实其在前列腺癌、非小细胞肺癌中的CAR-T靶点潜力。本研究通过检测胃癌样本的PSCA表达筛选其作为靶点,再通过CAR-T细胞的体内外功能实验,验证PSCA表达与CAR-T细胞活性的相关性。
研究过程详述
Biomarker来源为原发性胃癌组织(8例)及胃癌细胞系(BGC-823、MKN-28、KATO III);验证方法包括:① 免疫组化(组织水平,检测PSCA定位与表达量);② 流式细胞术(细胞系水平,检测表面表达);③ CAR-T细胞功能实验(体外杀伤、细胞因子分泌、体内肿瘤抑制,验证靶点有效性)。特异性方面,PSCA在胃癌组织中高表达而正常组织低,细胞系均均匀表达;敏感性方面,CAR-T细胞可特异性识别PSCA阳性细胞,诱导活化与杀伤。
核心成果提炼
PSCA可作为胃癌CAR-T治疗的特异性靶点,抗PSCA CAR-T细胞体内外均表现出显著抗肿瘤活性:① 体外实验中,CAR-T细胞的细胞毒性(E:T=2:1时杀伤率更高,P<0.05)、细胞因子分泌(IFN-γ浓度高于GFP-T组,P<0.01)及激活标志物(CD25、CD69上调)均显著优于对照;② 体内实验中,瘤周注射(而非静脉注射)抗PSCA CAR-T细胞可显著抑制肿瘤生长(BGC-823模型中肿瘤重量降低,P<0.05)。本研究的创新性在于首次证实PSCA在胃癌CAR-T治疗中的靶点价值,为胃癌免疫治疗提供了新的特异性靶点。
(注:文中未明确的样本量、具体数值等信息,均按文献原文表述;图片均来自原文献对应图表。)
