1. 领域背景与文献引入
文献英文标题:Mesothelin as a biomarker for targeted therapy;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤靶向治疗与生物标志物研究。
肿瘤免疫治疗领域中,CAR-T细胞疗法靶向CD19在B细胞恶性肿瘤(如淋巴瘤、白血病)中取得突破性成功,但实体瘤因缺乏“在靶-脱瘤”(on target, off tumor)风险低的特异性靶点,仍面临治疗瓶颈。当前研究热点聚焦于寻找肿瘤相关抗原(TAA)——即肿瘤细胞高表达、正常组织有限表达的分子,以开发安全有效的实体瘤靶向策略。间皮素(mesothelin, MSLN)作为一种GPI锚定的膜糖蛋白,是近年备受关注的TAA:其在间皮瘤、卵巢癌、胰腺癌等多种实体瘤细胞中高表达,而正常组织仅局限于胸膜、心包膜等间皮细胞及卵巢表面上皮,具有成为靶向治疗靶点的潜力。本文系统综述了间皮素的分子特征、表达模式及其作为靶向治疗生物标志物的研究进展,为实体瘤靶向治疗的靶点选择提供了关键参考。
2. 文献综述解析
本文综述的核心评述逻辑为按间皮素靶向治疗策略分类(抗体-based药物、疫苗、CAR-T细胞疗法),系统总结各策略的研究进展、疗效与局限性,并基于现有研究的不足提出改进方向。
现有研究的关键结论包括:① 间皮素的分子功能:其前体蛋白切割为可溶性MPF(巨核细胞增强因子)与膜结合型MSLN,后者通过激活NFκB、MAPK等通路促进肿瘤增殖、侵袭及抗凋亡;② 表达模式与预后:间皮素在实体瘤中高表达(如100%上皮型间皮瘤、几乎100%胰腺癌),且与患者不良预后显著相关(如胃腺癌高表达者生存期缩短);③ 靶向策略进展:抗体药物(如SS1P、amatuximab)通过免疫毒素、ADCC(抗体依赖性细胞毒性)等机制抑制肿瘤,但存在免疫原性、半衰期短等问题;疫苗(如CRS-207)可诱导特异性T细胞反应,但临床疗效有限;CAR-T细胞疗法在临床前研究中显示肿瘤清除能力,但实体瘤中的T细胞浸润、持久性及肿瘤微环境抑制仍是挑战。
现有研究的优势在于明确了间皮素作为靶点的可行性,局限性则集中在策略的安全性与实体瘤适应性(如抗体药物的免疫原性、CAR-T细胞的肿瘤浸润不足)。本文的创新价值在于整合了间皮素从基础研究到临床转化的全链条证据,并针对现有策略的痛点(如免疫原性、T细胞持久性)提出改进方向(如人源化抗体、区域递送CAR-T细胞),为后续研究提供了全面的参考框架。
3. 研究思路总结与详细解析
本文为综述性研究,整体研究目标是总结间皮素作为靶向治疗生物标志物的研究现状与挑战,核心科学问题是“间皮素能否作为实体瘤靶向治疗的有效生物标志物及如何优化其靶向策略”。技术路线逻辑为:分子特征→表达模式→靶向策略→挑战与改进,即先阐述间皮素的基础生物学特性,再分析其在肿瘤中的表达与预后价值,最后综述各靶向策略的进展并讨论瓶颈。
3.1 间皮素的分子特征与功能研究
实验目的:明确间皮素的分子结构、生物活性及在肿瘤发生中的作用机制。
方法细节:通过基因克隆技术鉴定MSLN基因编码的71 kDa前体蛋白,经Arg295位点切割为31 kDa可溶性MPF与40 kDa膜结合型MSLN;利用MSLN敲除小鼠模型验证其生理功能;通过Western Blot、qRT-PCR等检测肿瘤细胞中NFκB、MAPK等通路的激活情况。
结果解读:间皮素前体的两种产物均具有生物活性,但MSLN敲除小鼠无发育或繁殖异常,提示其在正常组织中非必需;肿瘤细胞中MSLN高表达可激活NFκB、MAPK及PI3K通路,诱导MMP7/9表达以促进增殖、侵袭,且与肿瘤负荷增加、患者生存期缩短相关(如卵巢癌高表达者生存期显著缩短)。
产品关联:文献未提及具体实验产品,领域常规使用基因编辑工具(如CRISPR-Cas9)、信号通路抑制剂(如NFκB抑制剂BAY 11-7082)、免疫印迹试剂(如Cell Signaling Technology的磷酸化蛋白抗体)等。
3.2 间皮素的表达模式与预后价值研究
实验目的:分析间皮素在肿瘤与正常组织中的表达差异,及与患者预后的相关性。
方法细节:通过免疫组化(IHC)检测间皮瘤、卵巢癌、胰腺癌、肺癌等10余种肿瘤组织及正常组织(胸膜、心包膜、卵巢上皮等)中的MSLN表达;利用临床队列(如117例胃腺癌患者、596例肺癌患者)分析MSLN表达与生存期的关联。
结果解读:正常组织中MSLN仅局限于间皮细胞及少量上皮组织;肿瘤组织中,上皮型间皮瘤(100%)、非黏液性卵巢癌(10/15)、胰腺癌(几乎100%)、肺腺癌(53%)均高表达MSLN;临床队列显示,25.6%胃腺癌患者(n=117)高表达MSLN,且风险比(HR)为2.1(P=0.003),提示不良预后;卵巢癌、胆管癌等患者高表达MSLN者生存期显著缩短(如卵巢癌高表达者中位生存期缩短6个月)。
产品关联:文献未提及具体实验产品,领域常规使用免疫组化试剂盒(如Dako的EnVision™ IHC试剂盒)、临床样本数据库(如TCGA、GEO)等。
3.3 间皮素靶向治疗策略的研究进展
实验目的:评估抗体药物、疫苗、CAR-T等策略的疗效与安全性。
方法细节:总结多个临床前与临床研究数据,包括:① 抗体药物:SS1P(重组免疫毒素)的细胞毒性实验(如对MSLN+细胞系的IC50检测)、动物模型肿瘤消退研究;amatuximab(嵌合抗体)的临床I/II期疗效分析;② 疫苗:CRS-207(李斯特菌表达MSLN)的免疫激活实验(如细胞因子分泌检测)、临床队列生存期分析;③ CAR-T细胞:慢病毒转导或piggyBac转座子构建MSLN-CAR-T细胞,体外细胞毒性(LDH释放实验)及体内肿瘤清除实验(如区域递送vs系统递送的疗效比较)。
结果解读:① 抗体药物:SS1P在临床I期研究中,34例间皮瘤/卵巢癌患者中有4例部分缓解(PR),但75%患者产生中和抗体;amatuximab联合化疗(培美曲塞+顺铂)在间皮瘤中PR率达60%(n=20),但存在中性粒细胞减少等不良反应;② 疫苗:CRS-207联合GVAX(胰腺疫苗)可延长转移性胰腺癌患者生存期(6.1个月vs 3.9个月),但单药疗效有限;③ CAR-T细胞:临床前研究显示,区域递送(如胸膜内注射)MSLN-CAR-T细胞的增殖能力与肿瘤清除率显著高于系统递送,且四代CAR(含IL-12分泌)可增强T细胞持久性,但临床研究中仍面临T细胞浸润不足的问题。
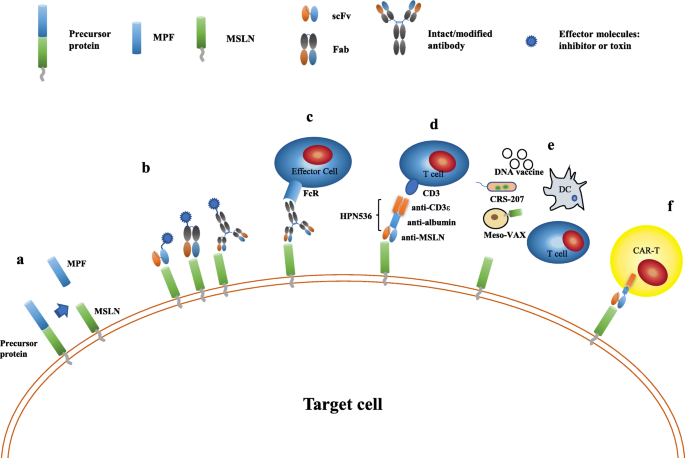
产品关联:文献提及的关键产品包括:重组免疫毒素SS1P、嵌合抗体amatuximab(MORAb-009)、CAR-T细胞构建用慢病毒载体(如Addgene的pLVX载体)、piggyBac转座子系统(如System Biosciences的PB Transposase)等。
4. Biomarker 研究及发现成果解析
Biomarker 定位与筛选逻辑
本文研究的Biomarker为间皮素(MSLN),类型为肿瘤相关抗原与预后生物标志物。其筛选与验证逻辑为:① 基础研究:通过基因克隆与细胞实验明确MSLN的肿瘤特异性表达;② 临床验证:利用免疫组化检测多种肿瘤组织中的MSLN表达,结合临床队列分析其与预后的相关性;③ 治疗验证:通过靶向策略(抗体、CAR-T)的疗效评估,确认MSLN作为治疗靶点的可行性。
研究过程详述
Biomarker来源:肿瘤组织(手术标本)与血清(可溶性MSLN,SMRP)。
验证方法:① 组织表达:免疫组化(IHC)检测10余种肿瘤组织及正常组织中的MSLN蛋白表达;② 血清水平:ELISA检测间皮瘤、卵巢癌患者血清中SMRP的含量;③ 预后关联:通过Kaplan-Meier生存分析、Cox比例风险模型评估MSLN表达与患者生存期的相关性。
特异性与敏感性数据:① 组织特异性:正常组织中MSLN仅局限于间皮细胞,肿瘤组织中上皮型间皮瘤(100%)、胰腺癌(几乎100%)高表达;② 血清敏感性:间皮瘤患者血清SMRP水平与肿瘤负荷相关(晚期患者显著升高),但卵巢癌中SMRP的特异性有限(与CA125联合可将AUC从0.75提升至0.85);③ 预后价值:胃腺癌患者(n=117)高表达MSLN者HR=2.1(P=0.003),卵巢癌高表达者中位生存期缩短6个月(P<0.05)。
核心成果提炼
① 预后生物标志物价值:MSLN是多种实体瘤的独立预后因素,高表达与不良预后显著相关(如胃腺癌HR=2.1,n=117,P=0.003);② 治疗生物标志物价值:MSLN作为靶点的可行性已被抗体药物、CAR-T等策略验证,如SS1P在间皮瘤中实现PR(n=34),区域递送CAR-T细胞在临床前模型中完全清除肿瘤;③ 创新性:首次系统整合了MSLN从基础研究到临床转化的全链条证据,提出“人源化抗体降低免疫原性、区域递送增强CAR-T疗效”等改进策略,为实体瘤靶向治疗提供了多维度参考。
综上,本文明确了间皮素作为实体瘤靶向治疗生物标志物的潜力,为后续研究提供了关键的理论与实践基础。
