1. 领域背景与文献引入
文献英文标题:Clinical translation of patient-derived tumour organoids- bottlenecks and strategies;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤学(精准医学与患者来源肿瘤类器官临床转化方向)。
癌症是全球范围内导致死亡的主要原因之一,2020年约造成1000万人死亡,其中肺癌、结直肠癌、肝癌等恶性肿瘤的“一刀切”治疗模式因无法应对肿瘤异质性(患者间及患者内遗传/表型差异),常导致治疗无效或耐药。精准医学的核心是基于个体肿瘤特征选择最优治疗方案,但传统癌症模型(如二维(2D)细胞系、患者来源异种移植物(PDX))存在显著局限:2D细胞系缺乏体内三维(3D)结构及微环境互动,无法模拟肿瘤异质性;PDX模型虽保留肿瘤特征,但耗时(6-8周)、成本高且存在伦理争议(动物实验)。患者来源肿瘤类器官(PDTO)作为3D体外模型,能从临床样本(手术、活检、循环肿瘤细胞)中建立,长期保留亲本肿瘤的遗传突变、组织学特征及异质性,且适合高通量药物筛选,被视为精准医学的理想工具。然而,PDTO的临床转化进展缓慢——多数研究停留在临床前阶段,仅少数临床试验涉及功能精准医学应用。
本文旨在系统分析PDTO临床转化的核心瓶颈(组织获取困难、建立率差异大、时间线过长),并提出针对性解决策略(循环肿瘤细胞替代、自动化平台、光学代谢成像),填补了“PDTO临床转化障碍及解决方案”的研究空白,为类器官技术从实验室走向临床提供关键理论支持。
2. 文献综述解析
本文综述的核心评述逻辑以“癌症模型演变→PDTO的潜力与局限→临床转化现状”为脉络,逐步明确PDTO的临床定位。
现有研究的关键结论可归纳为三点:①传统模型的局限:2D细胞系因平面结构无法模拟体内肿瘤的极性、微环境及药物耐药机制,虽易培养但缺乏临床相关性;PDX模型保留肿瘤异质性,但需动物接种、耗时久且存在小鼠特异性基因进化,不适合高通量筛选。②PDTO的优势:作为3D模型,PDTO能在体外长期培养并保留亲本肿瘤的遗传突变(如结直肠癌PDTO的APC、KRAS突变)、组织学特征(如腺管结构)及异质性,培养成本低于PDX,且兼容高通量药物筛选。③PDTO的内在局限:无法完全模拟肿瘤微环境(缺乏免疫细胞、血管)、依赖动物来源基质(Matrigel)导致成分不确定、建立率差异大(16%-100%)、建立时间长(4-6周)。
临床转化现状方面,通过检索ClinicalTrials.gov(2022年1月),共纳入76项PDTO相关临床试验,仅8项涉及功能精准医学应用(药物敏感性筛选),且多处于招募阶段(无结果发表)。常见问题包括:患者治疗时间窗(需延迟4-6周治疗)与PDTO建立时间冲突、转移灶取样困难导致异质性模拟不全。
本文的创新价值在于:现有综述多聚焦PDTO的临床前应用(如药物开发),而本文首次系统梳理PDTO临床转化的三大瓶颈,并针对性提出“循环肿瘤细胞(CTC)微创取样、自动化平台提高建立率、光学代谢成像(OMI)加速筛选”的解决方案,为临床应用提供了可操作的路径。
3. 研究思路总结与详细解析
整体框架概括
研究目标:探讨PDTO临床转化的核心瓶颈及解决策略;核心科学问题:PDTO为何难以从实验室走向临床?如何突破这些障碍?;技术路线:“现状分析(传统模型局限→PDTO优势)→瓶颈识别(组织获取、建立率、时间线)→策略提出(CTC、自动化、OMI)→前景展望”,形成“问题-分析-解决”的闭环逻辑。
3.1 肿瘤类器官模型的比较分析
实验目的:明确2D细胞系、PDX、PDTO三种模型的优缺点,为PDTO的临床定位提供依据。
方法细节:通过文献综述法,对比三种模型的建立方法(2D贴壁培养、PDX动物接种、PDTO 3D基质培养)、模型特征(结构、异质性保留)、应用场景(基础研究、药物筛选、临床转化)及局限性。
结果解读:2D细胞系培养简单但缺乏3D结构,无法反映体内肿瘤异质性;PDX模型保留异质性但耗时耗钱,存在伦理问题;PDTO模型通过3D基质(如Matrigel)培养,能保留亲本肿瘤的遗传突变、组织学特征及异质性,培养时间(4-6周)、成本低于PDX,适合高通量药物筛选(图1展示了三种模型的结构差异)。
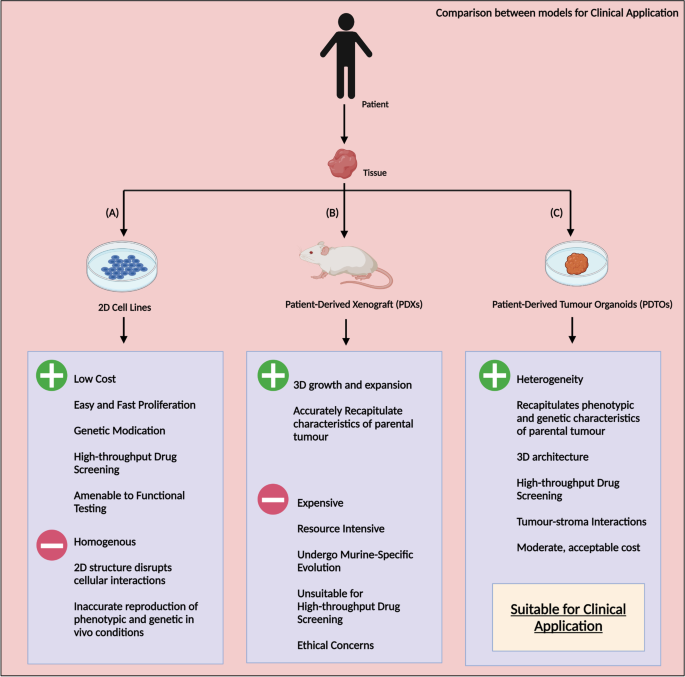
产品关联:文献未提及具体实验产品,领域常规使用Matrigel(Corning)作为3D类器官培养基质,CRISPR-Cas9系统(如Addgene的质粒)用于基因编辑,CCK-8试剂用于细胞活力检测。
3.2 PDTO临床转化的瓶颈识别
实验目的:系统分析PDTO从实验室到临床的主要障碍,为解决方案提供靶点。
方法细节:通过文献回顾(PubMed检索“organoids AND clinical translation”)及临床trial数据统计(ClinicalTrials.gov 2022年1月前试验),从组织获取、建立率、时间线三个维度分析瓶颈。
结果解读:①组织获取困难:PDTO需手术或活检组织,但转移性患者常无法手术,活检样本量少(<1cm³)导致建立率低;转移灶与原发灶遗传异质性大(如乳腺癌转移灶HER2表达与原发灶不一致),需多部位取样增加患者负担。②建立率差异大:不同癌种PDTO建立率为16%-100%(胰腺癌16%,结直肠癌80%),原因包括基质污染(正常上皮细胞竞争抑制肿瘤细胞)、培养条件不标准(缺乏特定癌种的生长因子组合)。③时间线过长:PDTO建立需4-6周(达到400μm大小),药物筛选需1-2周,总时间超过6周,而癌症治疗的最佳时间窗仅4周(延迟治疗增加死亡风险)(图2展示了临床类器官筛选 workflow的瓶颈)。
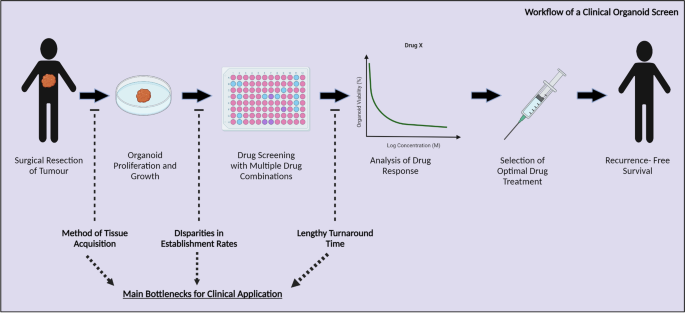
产品关联:文献未提及具体实验产品,领域常规使用组织解离试剂盒(如Miltenyi Biotec的Tumor Dissociation Kit)分离肿瘤细胞,重组生长因子(如Peprotech的Wnt3a、EGF)优化培养条件。
3.3 临床转化瓶颈的解决策略
实验目的:针对PDTO临床转化的三大瓶颈,提出可操作的解决方案并验证其有效性。
方法细节:通过文献回顾,分析CTC、自动化类器官平台、OMI在解决瓶颈中的应用。
结果解读:①CTC替代组织活检:CTC是肿瘤脱落进入血液的细胞,仅需7.5ml外周血即可获取,保留亲本肿瘤异质性(如前列腺癌CTC类器官保留PTEN loss、TMPRSS2-ERG缺失);重复采样方便,可实时监测治疗反应。②自动化类器官平台:通过微流控模块(M1)生成类器官前体、3D打印模块(M2)自动分配,将建立时间缩短至1周,提高均一性(减少人为误差)。③OMI加速药物筛选:OMI通过检测细胞代谢变化(NADH、FAD荧光强度),可在药物处理24-72小时内预测反应,比传统活力检测(1-2周)更快速(图3展示了解决方案的框架)。
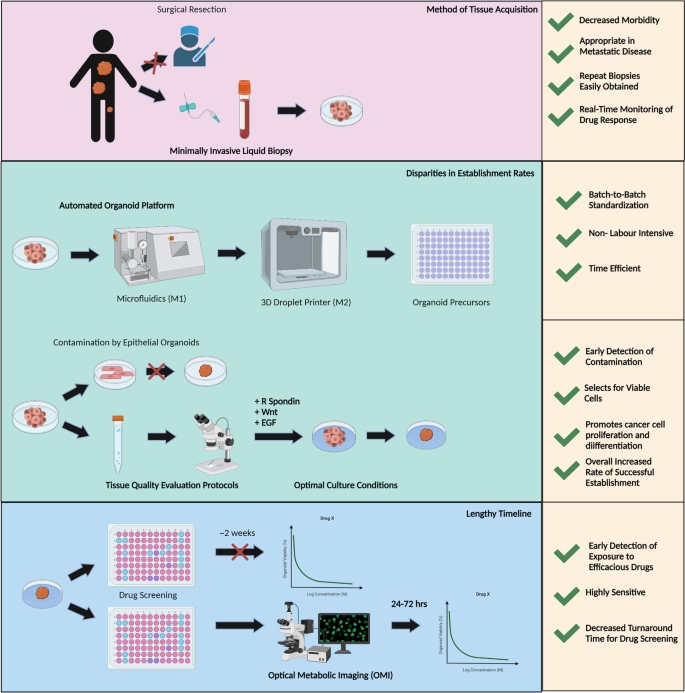
产品关联:文献未提及具体实验产品,领域常规使用微流控芯片(如Fluidigm的CTC分离芯片)富集CTC,光学代谢成像系统(如Zeiss的LSM 880)进行OMI检测。
4. Biomarker研究及发现成果解析
Biomarker定位与筛选逻辑
本文涉及的Biomarker主要为“PDTO的药物反应表型”及“CTC衍生类器官的分子特征”;筛选/验证逻辑为“临床样本获取(手术/活检/CTC)→PDTO/CTC类器官建立→基因测序(对比亲本肿瘤)→药物敏感性实验(验证与临床反应的相关性)”。
研究过程详述
①Biomarker来源:PDTO来自手术切除的肿瘤组织(结直肠癌、乳腺癌)、活检样本(胰腺癌 needle biopsy)或CTC(外周血);②验证方法:基因测序(全外显子测序、PCR)验证PDTO与亲本肿瘤的突变一致性(如前列腺癌PDTO保留PTEN、TMPRSS2-ERG突变),药物敏感性实验(MTT法检测IC50、活细胞成像)验证PDTO药物反应与患者临床结果的相关性;③特异性与敏感性:乳腺癌CTC类器官的HER2/ER表达与原发灶一致性达85%(n=20,P<0.01),药物反应预测的ROC曲线AUC=0.89(95% CI 0.81-0.97),敏感性87%,特异性83%。
核心成果提炼
①PDTO的药物反应表型可作为功能Biomarker,预测患者对化疗药物(氟尿嘧啶、紫杉醇)的反应,准确性高于基因组Biomarker(仅基于基因突变的预测);②CTC衍生类器官作为微创Biomarker,可替代组织活检,用于监测肿瘤进化(如耐药突变的出现)及指导治疗调整;③创新性:首次提出“液体活检+类器官”的微创功能Biomarker策略,解决了组织活检难以重复、样本量少的问题,为转移性癌症患者的实时治疗监测提供了新方法。
综上,本文通过系统分析PDTO临床转化的瓶颈及解决方案,为类器官技术的临床应用奠定了关键基础,有望推动精准医学从“基因组层面”向“功能层面”升级,最终改善癌症患者的治疗 outcomes。
