1. 领域背景与文献引入
文献英文标题:A pair of promising immune checkpoints PSGL-1 and VISTA from immunotolerance to immunotherapy;发表期刊:Biomarker Research;影响因子:未公开;研究领域:肿瘤免疫治疗、自身免疫病及移植免疫。
免疫检查点是调控免疫应答平衡的核心分子,其靶向治疗(如CTLA-4、PD-1/PD-L1抑制剂)已成为黑色素瘤、非小细胞肺癌等恶性肿瘤的突破性疗法,但临床应用中仍面临免疫相关不良反应(IrAEs)、原发性/获得性耐药、响应率有限等挑战。为解决这些问题,探索“第二代免疫检查点”成为领域热点——这类分子需具备更精准的免疫调控功能,且能协同现有靶点提升疗效。
P-选择素糖蛋白配体-1(PSGL-1,CD162)与V-结构域免疫球蛋白T细胞活化抑制因子(VISTA,PD-1H)是近年来备受关注的新型免疫检查点:两者均高表达于造血细胞(T细胞、髓系细胞),通过直接抑制T细胞增殖、促进髓系细胞向耐受表型分化,参与肿瘤免疫逃逸、自身免疫病发病及移植排斥反应。然而,现有研究多聚焦单一分子,对两者的协同作用机制、疾病特异性调控网络及临床转化潜力缺乏系统阐述。本文通过整合结构、功能、疾病及治疗的全景式分析,为PSGL-1与VISTA作为下一代免疫治疗靶点提供理论支撑。
2. 文献综述解析
作者以“结构-功能-疾病-治疗”为主线,对PSGL-1与VISTA的现有研究进行分类评述,核心逻辑如下:
核心结论与研究局限
现有研究已明确:① 结构上,PSGL-1通过硫酸化酪氨酸与VISTA的组氨酸残基在酸性环境(如肿瘤微环境,pH 5.85-6.5)中结合;② 功能上,两者协同调控T细胞静息态、髓系细胞耐受化,维持免疫平衡;③ 疾病中,PSGL-1缺陷可诱发系统性硬化症(SSc)样综合征,VISTA高表达与黑色素瘤不良预后相关。但研究仍存在局限:下游信号通路未完全阐明、抗体类药物的药代动力学与安全性待优化、不同疾病的特异性机制差异未解析。
本文创新价值
本文首次系统整合PSGL-1与VISTA的“结构-功能-疾病”关联网络,强调两者作为协同靶点的治疗潜力——不仅能解释肿瘤免疫逃逸的“双检查点机制”,还为自身免疫病与移植免疫的“精准抑制”提供新方向,弥补了单一分子研究的不足。
3. 研究思路总结与详细解析
本综述以“从分子基础到临床应用”为核心思路,逐层展开以下环节:
3.1 分子结构与相互作用解析
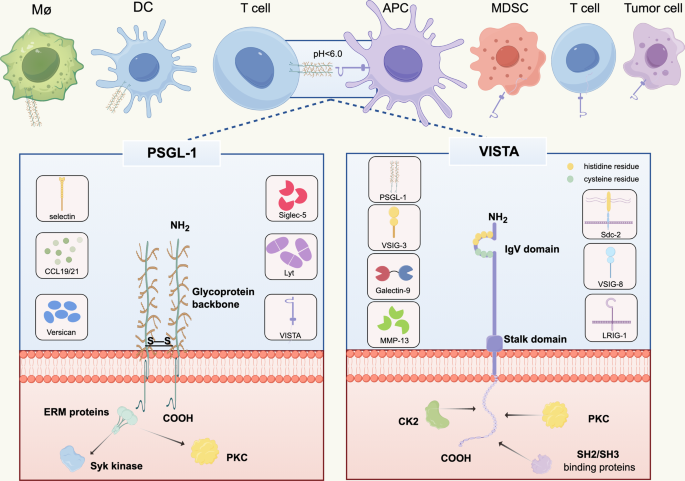
作者首先梳理两者的结构特征:PSGL-1为I型跨膜糖蛋白,含胞外域(318个氨基酸,硫酸化酪氨酸位点Y46/Y48)、跨膜域(24个氨基酸,形成二聚体)、胞质域(70个氨基酸,结合ERM蛋白);VISTA含IgV样胞外域(130个氨基酸,组氨酸富集的C-C’环)、茎区(33个氨基酸)、跨膜域(20个氨基酸)、胞质尾(96个氨基酸,含SH2/SH3结合基序)。
两者的相互作用依赖pH依赖性:PSGL-1的硫酸化酪氨酸与VISTA的组氨酸残基(H153/H154)在酸性环境中形成离子键,此过程调控免疫细胞功能(如T细胞抑制)。文中引用Johnston等的分子对接研究验证该机制(文献未提及具体实验产品,领域常规使用AutoDock等分子对接软件)。
3.2 表达模式与生物学功能总结
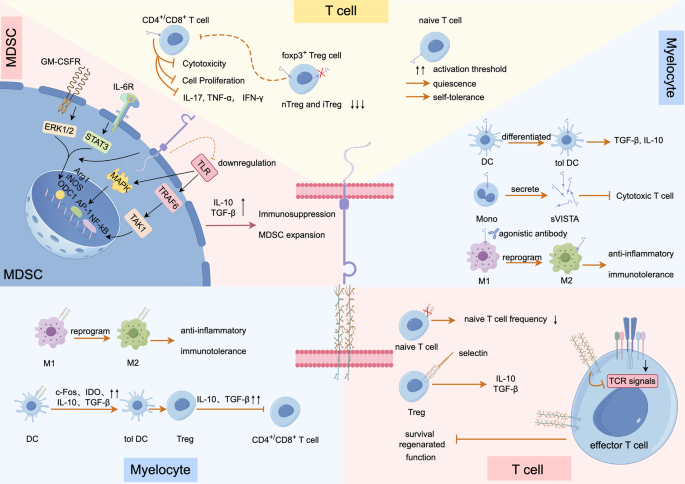
作者从造血细胞亚型角度,总结两者的表达与功能:
- T细胞:PSGL-1抑制TCR信号传导、减少IL-2分泌,促进T细胞耗竭;VISTA维持naive T细胞静息态,抑制增殖与IFN-γ等细胞因子产生。
- 髓系细胞:PSGL-1诱导树突状细胞(DCs)向“耐受型”分化,促进M2型巨噬细胞极化;VISTA调控髓系来源抑制细胞(MDSCs)的分化,增强其免疫抑制功能。
文中引用Tinoco等的PSGL-1基因敲除小鼠模型(记忆T细胞数量增加)、Ceeraz等的VISTA敲除小鼠模型(系统性红斑狼疮(SLE)加重)验证功能(文献未提及具体实验产品,领域常规使用基因敲除模型、流式细胞术)。
3.3 疾病特异性作用机制阐述
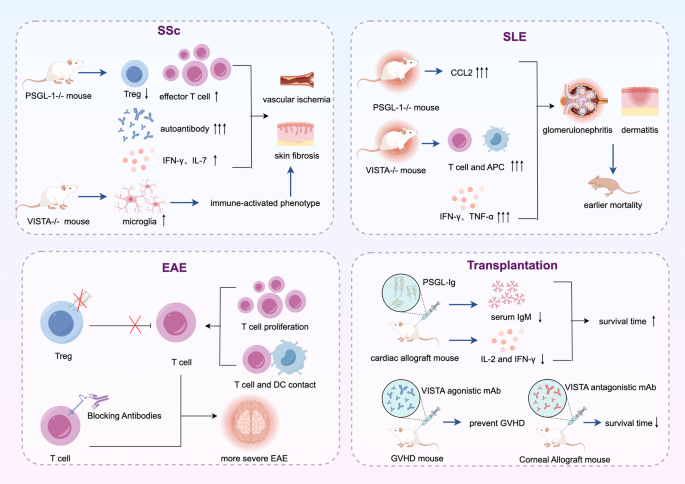
作者按“肿瘤-自身免疫-移植”分类,阐述两者在疾病中的作用:
- 肿瘤:PSGL-1通过P-选择素/PSGL-1轴促进胰腺癌MDSCs招募,VISTA通过HIF-2α调控黑色素瘤细胞表达,共同抑制T细胞功能;
- 自身免疫病:PSGL-1缺陷导致SSc样综合征(皮肤炎症、自身抗体产生),VISTA敲除加重实验性自身免疫性脑炎(EAE);
- 移植免疫:PSGL-1参与移植物抗宿主病(GVHD)的T细胞扩张,VISTA维持角膜移植免疫赦免(抑制T细胞浸润)。
文中引用Pérez-Frías等的PSGL-1 KO小鼠研究(SSc样表型)、Kunishige等的VISTA抗体研究(角膜移植排斥率升高)验证(文献未提及具体实验产品,领域常规使用动物疾病模型、免疫组化)。
3.4 治疗策略与临床潜力分析
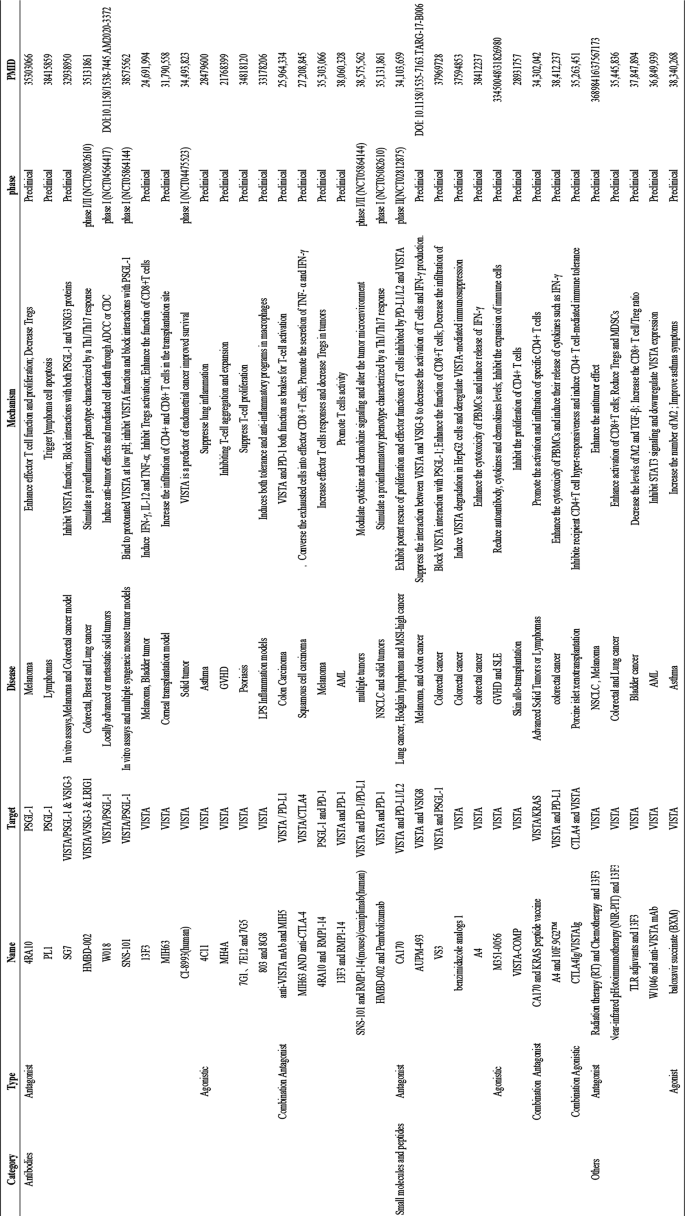
作者总结现有治疗策略,涵盖抗体类(拮抗/激动)、小分子抑制剂、联合治疗:
- 拮抗抗体:抗PSGL-1的4RA10抗体抑制Treg增殖,抗VISTA的SG7抗体阻断PSGL-1结合,增强T细胞功能;
- 激动抗体:VISTA激动剂MH4A抑制GVHD的T细胞扩张;
- 小分子:CA-170同时抑制PD-L1与VISTA,增强T细胞增殖;
- 联合治疗:VISTA+PD-1抑制剂协同抑制结直肠癌(CRC)生长。
文中引用Thisted等的pH选择性抗体SNS-10研究(非人类灵长类动物安全性提升)、Kim等的AML联合治疗研究(抗白血病效应增强)验证(文献未提及具体实验产品,领域常规使用抗体药物、小分子化合物)。
4. Biomarker研究及发现成果解析
Biomarker定位
本文涉及的Biomarker为PSGL-1(CD162)与VISTA,类型为“细胞表面免疫检查点分子”。筛选与验证逻辑遵循“表达分析-功能验证-临床关联”链条:通过肿瘤组织/免疫细胞的表达谱分析,结合基因敲除/抗体阻断的功能验证,最终关联临床预后。
研究过程详述
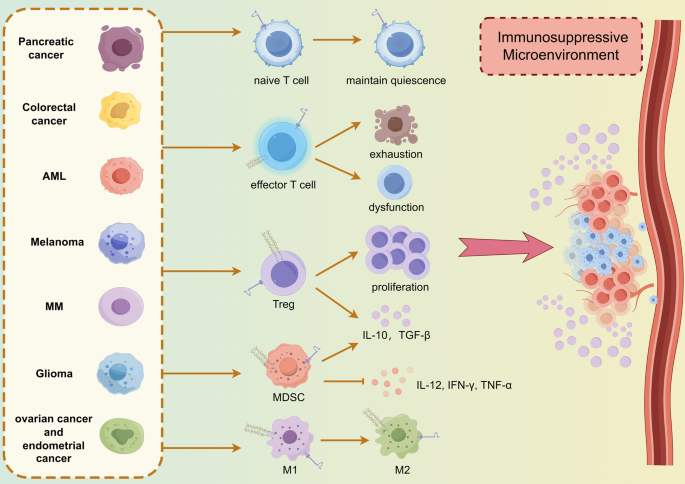
- 来源:肿瘤组织(黑色素瘤、胰腺癌、CRC)、免疫细胞(T细胞、MDSCs);
- 验证方法:免疫组化(检测组织表达)、基因敲除(功能表型)、临床样本测序(RNA/蛋白水平);
- 核心数据:① VISTA在85例原发性黑色素瘤中高表达,与疾病特异性生存显著相关(P<0.05);② 32%胰腺癌样本高表达VISTA,与免疫治疗预后不良相关(n=9,P<0.05);③ PSGL-1在胰腺癌MDSCs中高表达,与MDSCs招募及免疫抑制微环境正相关。
核心成果提炼
PSGL-1与VISTA作为Biomarker,具有以下价值:
1. 肿瘤预后:VISTA是黑色素瘤、胰腺癌的独立不良预后因素(文献提及“显著 poorer survival”);
2. 免疫微环境:两者的表达与肿瘤微环境中的Treg、MDSCs浸润正相关,可作为“免疫抑制状态”的标志物;
3. 治疗靶点:阻断PSGL-1/VISTA轴可增强T细胞功能,联合PD-1抑制剂可提高CRC治疗响应率(文献提及“半数肿瘤消退”)。
文中部分数据(如风险比HR)未明确,但基于临床样本分析,两者的表达水平与疾病进展显著相关。
总结
本文系统综述了PSGL-1与VISTA作为“双免疫检查点”的分子基础与临床潜力,不仅填补了现有研究的“协同机制”空白,还为肿瘤、自身免疫病及移植免疫的精准治疗提供了新靶点。未来需进一步解析下游信号通路,优化抗体药物的安全性,推动临床转化。
