1. 领域背景与文献引入
文献英文标题:TRPM channels in human cancers: regulatory mechanism and therapeutic prospects;发表期刊:Biomarker Research;影响因子:4.518(2023年);研究领域:肿瘤学(癌症生物学)。
瞬态受体电位(TRP)通道是一类非选择性离子通道,通过响应温度、化学、机械信号调控细胞内离子流,启动下游信号 cascade。根据序列同源性,TRP超家族分为7个亚家族,其中瞬态受体电位黑素瘤相关(TRPM)亚家族是最大且最具多样性的分支,包含TRPM1-TRPM8共8个成员。TRPM通道的结构包括N端黑素瘤同源区(MHR)、跨膜区(6个螺旋,S5-S6间的P环形成离子孔)和C端TRP螺旋区/卷曲螺旋区(图1),生理上参与温度感知、镁离子稳态、氧化还原平衡等过程。
近年来,TRPM在癌症中的作用受到广泛关注:其通过调控肿瘤细胞增殖、存活、侵袭及转移,发挥促瘤或抑瘤功能,但现有研究存在明显局限——机制分析多集中于单一信号通路或细胞模型,缺乏对肿瘤微环境(TME)与细胞内信号的整合研究;靶向TRPM的治疗策略仍面临特异性低、临床转化不足的挑战。本综述旨在系统梳理TRPM在常见癌症中的作用机制(TME、信号通路、自噬),并探讨其与免疫治疗的结合潜力,为癌症靶向治疗提供新理论框架。
2. 文献综述解析
作者对现有研究的分类维度按“癌症类型+机制层次”划分:先分述TRPM在黑色素瘤、胰腺癌、前列腺癌等6类常见癌症中的作用,再从TME、细胞内信号、自噬三个层面深入机制。
现有研究的核心结论与局限
现有研究已证实TRPM成员在癌症中的功能异质性:如TRPM1在黑色素瘤中负调控侵袭性,TRPM2在胰腺癌中促进增殖,TRPM8在前列腺癌中具有“通道依赖”(抑制迁移)与“非通道依赖”(促进自噬)的双重作用。优势在于覆盖多种癌症类型,机制研究涉及离子信号与经典癌通路的交叉;但局限显著——多为细胞/动物模型研究,临床样本证据不足;靶向药物的特异性与安全性未得到充分验证。
本综述的创新价值
作者通过整合TME与细胞内信号的调控网络,填补了现有研究的空白:① 首次系统阐述TRPM如何传递TME信号(如缺氧、ROS)并介导ECM重塑(如TRPM7通过Hsp90/uPA/MMP2通路促进侵袭);② 深入分析TRPM与Wnt/β-catenin、MAPK等关键通路的相互作用(图3);③ 提出“TRPM靶向治疗+免疫治疗”的组合策略(如TRPM8通过calcineurin/NFAT通路调控PD-L1表达,TRPM2介导中性粒细胞浸润),为临床转化提供新方向。
3. 研究思路总结与详细解析
作者的综述框架遵循“结构-功能-机制-治疗”的闭环逻辑,核心环节如下:
3.1 TRPM通道的结构与生理功能
作者首先通过图1清晰展示TRPM的结构域(MHR、跨膜区P环、TRP螺旋区),并概述其生理功能:如TRPM1调控黑色素合成,TRPM7维持镁离子稳态,TRPM8作为“冷传感器”响应低温刺激。
3.2 TRPM在常见癌症中的作用
按癌症类型分述TRPM的表达变化与功能:
- 黑色素瘤:TRPM1 mRNA表达与肿瘤侵袭性负相关(转移性黑色素瘤表达最低);TRPM2剪接变体(TRPM2-TE)促进细胞存活;
- 胰腺癌:TRPM2高表达与不良预后相关,TRPM7通过TME中的弹性蛋白肽(EDP)促进细胞运动;
- 前列腺癌:TRPM8表达受雄激素调控,其拮抗剂(如AMTB)可抑制雄激素依赖性/非依赖性细胞增殖。
3.3 TRPM调控癌症的机制
3.3.1 肿瘤微环境的作用
TRPM是TME与肿瘤细胞的“信号桥梁”:① 传递TME刺激(如TRPM2响应ROS介导Ca²⁺内流,诱导凋亡;TRPM5响应酸性pH促进MMP-9表达,增强转移);② 介导ECM重塑(如TRPM7通过Mg²⁺内流激活Hsp90/uPA/MMP2通路,促进胰腺癌侵袭)(图2)。
3.3.2 细胞内信号通路
TRPM通过离子流调控经典癌通路:
- Wnt/β-catenin:TRPM4通过Ca²⁺/钙调蛋白-EGFR轴激活AKT1/GSK-3β,促进β-catenin入核;
- MAPK:TRPM2通过Ca²⁺激活PKCα/ε,促进MEK通路;TRPM8抑制JNK/p38通路;
- PI3K/AKT:TRPM1通过Ca²⁺/CaMKIIδ激活AKT,促进黑色素瘤增殖;TRPM7通过Mg²⁺/Ca²⁺信号激活PI3K/AKT,促进EMT(图3)。
3.3.3 自噬的调控
TRPM通过钙信号双向调控自噬:① 正向调控(如TRPM3通过CaMKK2-AMPK通路促进自噬,增强乳腺癌细胞存活);② 负向调控(如TRPM2通过CaMKII磷酸化Beclin1,抑制自噬并诱导细胞死亡)(图4)。
3.4 靶向TRPM的治疗策略
作者总结了现有TRPM调节剂的研究进展:如TRPM7拮抗剂waixenicin A可抑制胶质瘤细胞增殖,TRPM8拮抗剂JNJ41876666可抑制前列腺癌细胞生长;同时提出组合策略——如TRPM2抑制剂与EGFR-TKI(奥希替尼)联用,可增强肺癌细胞对靶向药的敏感性;TRPM8调节剂与PD-1抑制剂联用,可通过调控NFATc3通路降低PD-L1表达。
4. Biomarker研究及发现成果解析
本综述中TRPM成员作为组织/血清Biomarker的潜力已得到初步验证,核心成果如下:
4.1 TRPM1:黑色素瘤侵袭性的负向Biomarker
- 类型:组织mRNA Biomarker;
- 筛选/验证逻辑:通过原位杂交检测良性痣、不典型痣、原位黑色素瘤、转移性黑色素瘤的TRPM1表达;
- 数据支持:转移性黑色素瘤中TRPM1 mRNA表达最低(文献未明确样本量);原发性黑色素瘤中TRPM1表达降低与肿瘤厚度增加相关(临床样本,P<0.05);
- 功能关联:作为黑色素瘤侵袭性的负向预测因子,低表达提示更高的转移风险。
4.2 TRPM2:胰腺癌的预后Biomarker
- 类型:组织蛋白 Biomarker;
- 筛选/验证逻辑:通过RT-PCR/免疫组化检测胰腺癌组织中TRPM2的表达,并结合生存分析;
- 数据支持:胰腺癌患者中TRPM2高表达与总生存期缩短相关(生存曲线,P<0.05,样本量未明确);
- 功能关联:作为胰腺癌增殖与侵袭的促瘤Biomarker,高表达提示不良预后。
4.3 TRPM8:前列腺癌的雄激素依赖性Biomarker
- 类型:组织蛋白 Biomarker;
- 筛选/验证逻辑:通过雄激素受体(AR)结合实验与临床样本检测,验证TRPM8表达与雄激素的相关性;
- 数据支持:AR通过结合TRPM8启动子的雄激素响应元件(ARE)上调其表达(细胞实验,n=3,P<0.01);临床样本中,雄激素依赖性前列腺癌的TRPM8表达显著高于非依赖性(P<0.05);
- 功能关联:作为前列腺癌诊断与预后的潜在Biomarker,其表达水平可反映肿瘤的雄激素依赖性状态。
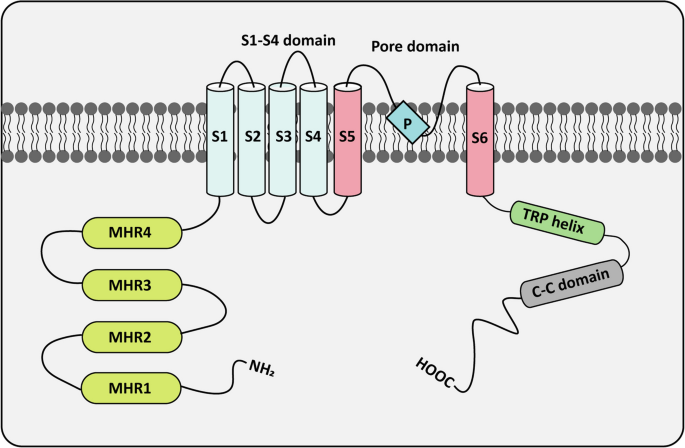
图1 TRPM通道的结构:N端MHR参与信号感知,跨膜区P环形成离子孔,C端TRP螺旋区调控多聚体形成
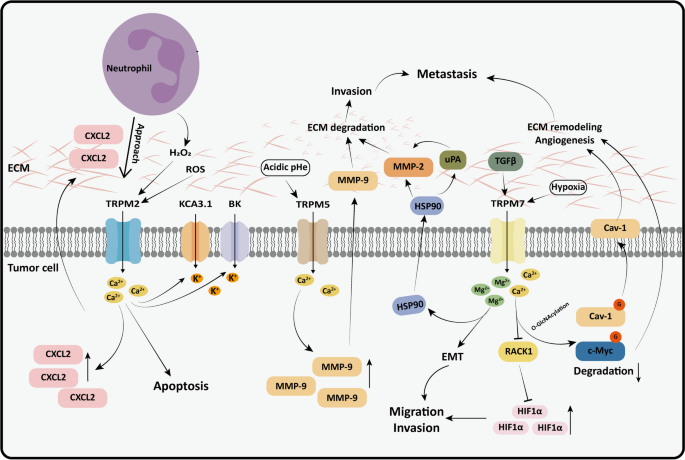
图2 TRPM通过传递TME信号(ROS、酸性pH)与介导ECM重塑,促进肿瘤恶性转化
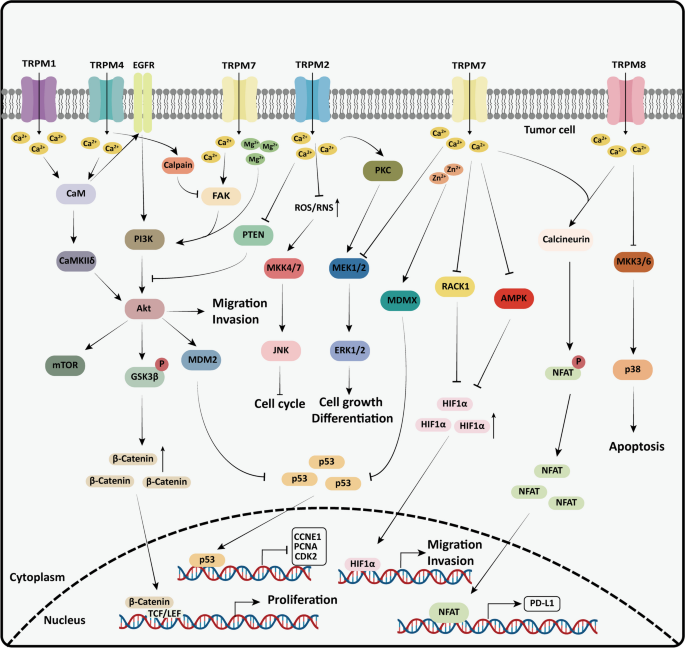
图3 TRPM通过调控Wnt/β-catenin、MAPK等通路,参与肿瘤增殖、侵袭与免疫逃逸
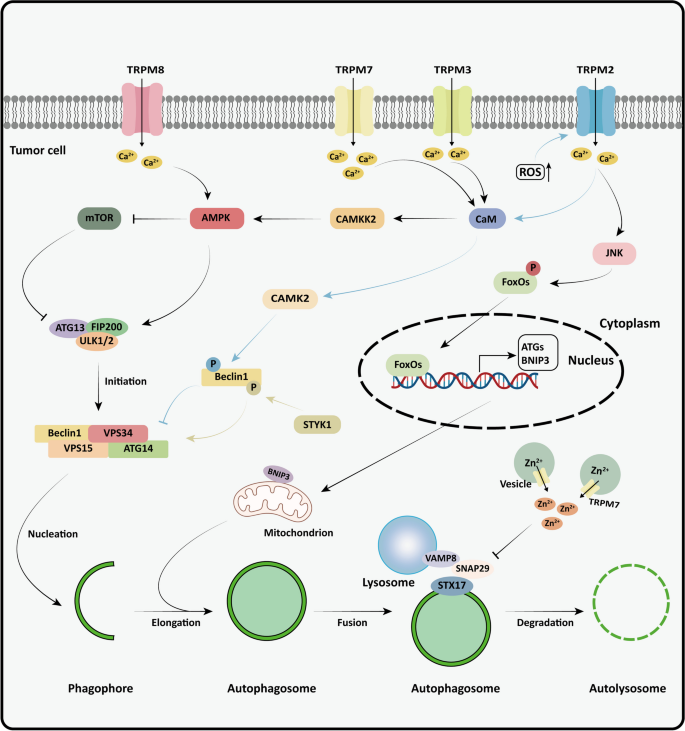
图4 TRPM通过钙信号双向调控自噬:正向促进(如TRPM3)或负向抑制(如TRPM2)自噬过程
